腌鱼中产生物胺菌株的筛选、鉴定及其特性研究
张黎明,章 祎,赵云松,林心萍,梁会朋,张素芳,纪超凡
(大连工业大学食品学院 国家海洋食品工程技术研究中心 辽宁大连 116034)
腌制是鱼类的传统加工方式之一。腌制后鱼肉风味独特,富含维生素及蛋白质等人体所需的营养物质[1]。鱼肉在腌制过程中会发生自然发酵,发酵微生物可能产生以组胺为主的生物胺。生物胺是由微生物的氨基酸脱羧酶催化相应的氨基酸脱羧形成。有研究表明:当人体摄入组胺超过100 mg 时,会引发一系列诸如头痛、痉挛、恶心呕吐等中毒症状,严重时甚至会危及生命[2-3]。我国规定高组胺鱼类制品的组胺含量不得超过400 mg/kg,其它鱼类制品不得超过200 mg/kg[4]。明确腌鱼中产生物胺微生物的种类、产胺能力以及降低其生长和生物胺积累的理化因素等工作亟待开展。
目前报道的鱼制品中常见的产生物胺微生物包括:发光杆菌属、肠杆菌属、摩根氏菌属、产酸克雷伯菌属、拉氏普罗威登斯菌属等[5-7]。有研究表明,原料中产生物胺微生物的种类和数量与其产品中生物胺含量密切相关[8]。原料和加工方式不同造成的环境异质性也是影响菌株生长及生物胺积累的关键因素。Kimura 等[9]发现鱼露中的产组胺菌株嗜盐链球菌在pH 5.8 条件下产组胺能力高于pH 7.6。Wang 等[10]发现在草鱼片中加入2%~10%的盐,对生物胺的形成有一定影响,且盐度越高对生物胺积累的抑制效果越好。分离、鉴定产生物胺的微生物,明确影响其生长及产生物胺能力的理化因素,是降低腌鱼制品中生物胺含量的理论基础。本研究以腌制鱼为研究对象,筛选产生物胺菌株,研究盐度及pH 值对其生长及其产生物胺的影响,为腌鱼制品加工过程中控制产生物胺微生物生长,降低生物胺含量提供理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 试验原料 草鱼(Ctenopharyngodon idellus)与马鲛鱼(Scomberomorus niphonius),购自大连仟和市场;食盐与福临门丝苗米,购自超市。密封发酵罐,购自淘宝。
1.1.2 培养基 生物胺检测(显色)培养基[11]:蛋白胨0.5%,酵母浸粉0.5%,NaCl 0.5%,碳酸钙0.1%,琼脂2%,溴甲酚紫0.006%,氨基酸1%(苯丙氨酸、组氨酸、精氨酸、鸟氨酸、赖氨酸、色氨酸),酪氨酸0.04%,pH 5.5。
氨基酸脱羧酶试验培养基[12]:蛋白胨0.5%,酵母浸粉0.3%,葡萄糖0.1%,吡哆醛-5'-磷酸0.005%,氨基酸 0.1%(苯丙氨酸、组氨酸、精氨酸、赖氨酸、鸟氨酸、色氨酸),酪氨酸0.04%,溴甲酚紫0.006%,pH 5.5~6.5。
琼脂、酵母浸粉、蛋白胨、胰蛋白胨大豆肉汤(TSB),青岛海博生物技术有限公司。
1.1.3 主要试剂 氨基酸(苯丙氨酸、组氨酸、赖氨酸、色氨酸、酪氨酸),上海阿拉丁生化科技有限公司;精氨酸,上海玉博生物科技有限公司;鸟氨酸,北京索莱宝生物科技有限公司;吡哆醛-5'-磷酸,上海麦克林生化科技有限公司;溴甲酚紫,天津市天新精细化工开发中心;碳酸钙,天津市光复科技有限公司;氯化钠,国药集团化学试剂有限公司;甲醇(色谱级),美国Spectaum 公司。
1.1.4 仪器与设备 AB2004-N 电子分析天平、FE28-Standard pH 计,梅特勒-托利多仪器(上海) 有限公司;Bioscreen+C 全自动生长曲线分析仪,芬兰Labsystems 公司;LC-30A 超高效液相色谱仪,日本岛津公司;QtrapR5500 三重四极杆质谱仪,加拿大AB Sciex 公司;BJ-2CD 超净工作台,日本AIRTECH 公司;Jipad-20 拍打式无菌均质器,上海旌派仪器有限公司;LRH-150 生化培养箱,上海一恒科学仪器有限公司;Scan Speed 40 真空离心浓缩仪,丹麦Labogene 公司。
1.2 试验方法
1.2.1 鱼茶及腌制马鲛鱼制备方法 草鱼,去除头部、尾部、鳞片及内脏,清洗干净,切成1 cm×1 cm×1 cm 的均匀鱼块。将切好的鱼块置于饱和食盐水中15 ℃腌制3 h,腌制结束后洗净,备用。将米与水按1∶2 的比例蒸熟后,冷却至室温。分别称取80 g 鱼块及140 g 熟米,混合均匀后填装至密封玻璃罐中,20 ℃密封发酵。马鲛鱼,去头部、尾部及内脏,清洗干净,切成质量均匀的鱼块【(50±5)g】。将质量为(50±5)g 的鱼块与120 mL 6%食盐水混合均匀,置发酵罐内,15 ℃密封发酵。
1.2.2 不同发酵时间产生物胺菌株的筛选 分别在鱼茶及腌制马鲛鱼发酵至第7,14,28 天时,在超净工作台中取样25 g,放入无菌均质袋中,同时加入0.85%的无菌生理盐水225 mL,在均质器中拍打均匀。取混合均匀的稀释液1 mL,加入9 mL 0.85%无菌生理盐水中,梯度稀释。选择适宜稀释梯度,吸取100 μL 稀释液,分别涂布于生物胺检测(显色)培养基上,30 ℃恒温培养48 h。挑取蓝紫色单菌落,分离纯化二至三代。
1.2.3 产生物胺菌株的复筛 用接种环挑取分离纯化后的可疑产生物胺菌株,接种至氨基酸脱羧酶培养基中,同时设置空白对照(未接种),于30℃恒温培养箱中培养至48 h,观察颜色变化。
1.2.4 产生物胺菌株的鉴定 挑取活化的目标菌株接种至TSB 培养基中,30 ℃培养18 h;培养结束后,离心(4 ℃,8 000 r/min)10 min,弃上清液,取1 μL 菌体加入50 μL 反应体系[13]。采用通用引物(上游27F:5’-AGAGTTTGATCCTGGCTCAG-3’,下游1492R:5’-GGTTACCTTGTTACGACTT-3’),进行PCR 扩增。PCR 纯化产物,经1.0%琼脂糖凝胶电泳检测后送样,测序,然后用NCBI 数据库和Blast 软件进行比对。
1.2.5 不同盐度条件下生长曲线的测定 将氯化钠按0%,2%,4%,6%,8%的比例添加至不含溴甲酚紫的氨基酸脱羧酶培养基中,121 ℃15 min 灭菌,备用。在培养基中分别接种活化后的产生物胺菌株,混和均匀后取300 μL 混合液加入培养孔板中,设置3 个平行,30 ℃恒温培养48 h,利用全自动生长曲线分析仪测定产生物胺菌株生长动态。
1.2.6 不同pH 值条件下生长曲线的测定 将不含溴甲酚紫的氨基酸脱羧酶培养基分别调节pH值至4.5,5.5 和6.5,分装至试管,121 ℃15 min 灭菌,备用。其次,将活化的产生物胺菌株分别接种于培养基中,取300 μL 混合液加入培养孔板,设置3 个平行,30 ℃恒温培养48 h,利用全自动生长曲线分析仪测定产生物胺菌株生长动态。
1.2.7 生物胺含量的测定 生长曲线测定结束后,立即收集培养液,于高速冷冻离心机中10 000 r/min 离心5 min,保留上清液。参照Zhang 等[14]的生物胺测定方法,对样品进行前处理,用超高效液相色谱-质谱联用仪测定生物胺含量。
2 结果与分析
2.1 产生物胺菌株初筛
以腌鱼为研究对象,分别取发酵不同周期样品中的微生物,梯度稀释后涂布于培养基上。生物胺是生物碱,在添加溴甲酚紫指示剂(变色范围:5.2 黄~6.8 紫)的培养基中,若菌落呈蓝紫色,则说明有碱性物质产生,初步认为其可能具有产生物胺的能力。图1为典型的阳性和阴性菌株的显色培养基。产碱性物质的菌落周围呈明显的紫色,未产碱性物质的菌落周围培养基无明显颜色变化。经初步分离纯化,从腌制鱼中筛选出40 株使培养基明显变蓝紫色的菌株(编号YC-1~YC-20,BY-1~BY-20)。

图1 产生物胺菌株初筛培养基Fig.1 Positive-and negative-BAs-producing strains
2.2 产生物胺菌株复筛
将初筛获得的40 株可能具有产生物胺能力的菌株接种至氨基酸脱羧酶培养基中。培养48 h后观察颜色变化,“-”代表黄色,“+++”、“++”、“+”分别代表由深紫、紫到浅紫,颜色变化情况见表1。培养初期,菌株分解培养液中的葡萄糖产酸,使培养基颜色呈黄色。随着培养时间的延长,一些菌株开始产氨基酸脱羧酶,使培养基中的前体氨基酸脱羧,形成CO2和相应的胺类,使培养液的pH值升高,颜色由黄色逐渐变成紫色。
从表1可以看出,培养48 h 后,从腌鱼中筛选的菌株,有11 株培养基颜色变为深紫色,3 株颜色变为紫色,11 株呈浅紫色。其余15 株菌的培养基均呈黄色,说明菌株无氨基酸脱羧活性。经氨基酸脱羧酶培养基复筛,选取25 株颜色发生变化的菌株开展鉴定工作。

表1 初筛所得菌株的氨基酸脱羧酶试验结果Table 1 Results of amino acid decarboxylase test of the strains
2.3 产生物胺菌株鉴定
将腌鱼中筛选出的25 株产生物胺菌株进行16S rDNA 分析,分析结果见表2。鉴定出的产生物胺菌株包括8 个种属,其中肠杆菌属(Enterobacter sp.)10 株,不动杆菌属(Acinetobacter sp.)1 株,产气单胞菌属(Aeromonas sp.)1 株,摩根氏菌属(Morganella sp.)3 株,肥杆菌属(Obesumbacterium sp.)2 株,希瓦氏菌属(Shewanella sp.)4株,普罗威登斯菌属(Providencia sp.)3 株,嗜盐单胞菌属(Halomonas sp.)1 株。前期研究表明,摩根氏菌属、肠杆菌属、普罗威登斯菌属和希瓦氏菌属是鱼制品中常见的产生物胺菌属,如Emborg[15]从海产品中筛选出具有较强产组胺能力的嗜冷摩根氏菌(Morganella psychrotolerans sp.nov.)。Kim等[16]从鱼制品中筛选出产尸胺与腐胺的肠杆菌(Enterobacter asburiae)。Hu 等[17]从蓝圆鰺中分离出产腐胺的希瓦氏菌(Shewanella baltica)。刘红等[5]从秋刀鱼中分离出产腐胺较强的拉氏普罗威登斯菌(Providencia rustigianii)。其中对于分离自鱼制品中的不动杆菌属、肥杆菌属、产气单胞菌属和嗜盐单胞菌属鲜有研究报道。本文选取2.2 节中使氨基酸脱羧酶培养基显示深紫色的6 株菌:拉氏普罗威登斯菌BY-11、希瓦氏菌BY-19、嗜盐单胞菌BY-17、肠杆菌YC-1、肠杆菌YC-2 和摩根氏菌YC-16 进行下一步研究。

表2 产生物胺菌株16S rDNA 序列分析结果Table 2 Results of 16S rDNA sequence analysis for BAs-producer
2.4 盐度及pH 值对产生物胺菌株生长的影响
大部分微生物不耐高渗环境,当盐含量超过10%时,细菌活性受到明显抑制。本研究选取0%,2%,4%,6%,8% 5 种盐度条件进行研究,6 株菌的生长情况如图2所示。其中菌株拉氏普罗威登斯菌(Providencia sp.)BY-11 对盐度最敏感,当盐度含量达2%时,与空白组(0%)相比,其OD600nm值降低49%,说明盐度对菌株拉氏普罗威登斯菌BY-11 的生长产生一定的抑制作用;当盐含量为2%时,菌株希瓦氏菌BY-19 与嗜盐单胞菌BY-17 的OD600nm值与空白组相近,这可能与菌株的特异性有关。当存在一定浓度的NaCl 时,细胞膜的通透性发生改变;当盐浓度超过一定范围时,细胞膜的通透性受到抑制,从而降低菌株的活性。菌株肠杆菌YC-1,肠杆菌YC-2 和摩根氏菌YC-16则随着盐度的增加,OD600nm值降低,说明菌株的活性受盐度的影响,盐度越高生长越缓慢。徐赛男等[18]研究的两株产组胺的肠杆菌属菌株,在小于5%的腌制盐度下生长稳定,说明其具有一定的耐盐性,与本研究结果相近。


图2 盐度对产生物胺菌株生长的影响Fig.2 Effects of salinity on the growth of BAs producing bacteria
经测定,两种腌制鱼产品的pH 值变化范围分别为4.0~6.7(鱼茶)和5.8~6.7(腌制马鲛鱼)。本研究选取pH 4.5,pH 5.5 和pH 6.5 条件进行研究,菌株生长情况如图3所示。其中菌株拉氏普罗威登斯菌BY-11 的OD600nm值在pH 5.5 和pH 4.5时较接近,显著低于pH 6.5 的OD600nm值。菌株嗜盐单胞菌BY-17 与之呈相同趋势,说明当pH 值低于5.5 时,两株菌的活性受到抑制。当pH 4.5时,菌株摩根氏菌YC-16 的OD600nm值在培养0~48 h 内无明显增长,说明该菌株对低酸环境较敏感。随着培养时间逐渐延长,菌株肠杆菌YC-1 与菌株肠杆菌YC-2 在pH 4.5 时OD600nm值最高,说明低酸条件更有益于两株肠杆菌属菌株的生长。由于菌株的特异性,因此,在鱼制品生产加工中应结合产品中微生物的群落特性,控制pH 值,从而抑制微生物生长,降低生物胺的含量。
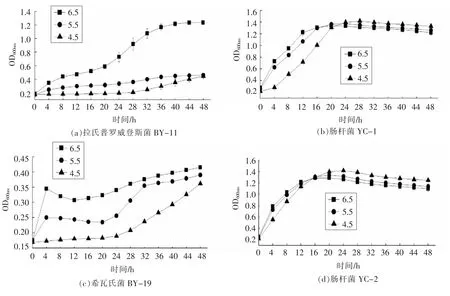

图3 pH 值对产生物胺菌株生长的影响Fig.3 Effects of pH value on the growth of BAs producing bacteria
2.5 盐度及pH 值对生物胺含量的影响
不同盐度条件下生物胺含量如图4所示。可以看出随着盐度的增加,生物胺含量呈下降趋势;与对照组(0%)相比,当盐含量为2%时,6 株菌的生物胺总量分别降低了94%,82%,82%,90%,66%和46%;其中,希瓦氏菌BY-19 与摩根氏菌YC-16 是主要的产组胺菌株;嗜盐单胞菌BY-17、拉氏普罗威登斯菌BY-11、肠杆菌YC-1 和肠杆菌YC-2 是主要的产尸胺与腐胺菌株。从低盐(0%)至高盐(8%),菌株肠杆菌YC-1 的尸胺与腐胺总量从201.8 mg/L 降至1.6 mg/L,菌株肠杆菌YC-2 的尸胺与腐胺总量从280.7 mg/L 降至20.7 mg/L。结合图2可知,高盐浓度抑制菌株的生长及生物胺积累,低盐浓度下菌株虽具有生长活性,但生物胺含量大幅度降低,这可能与氨基酸脱羧酶的基因表达量受抑制有关[19],因此生物胺含量间接降低。梁静静等[20]发现,随着盐度的升高,两株芽孢杆菌的产生物胺能力受到抑制,当盐含量达8%以上时,几乎不产生物胺,这与本研究结果相近。

图4 不同盐度条件对生物胺含量的影响Fig.4 Effects of different salinity on the content of BAs
在不同pH 值条件下,6 种菌株的生物胺变化情况如图5所示。可以看出,当pH 6.5 时,菌株拉氏普罗威登斯菌BY-11 的腐胺和尸胺含量分别为51.5 mg/L 和65.9 mg/L,随着pH 值的降低,腐胺和尸胺含量下降;菌株希瓦氏菌BY-19 与摩根氏菌YC-16 的生物胺含量随着pH 值的上升而增加,其中,菌株希瓦氏菌BY-19 在pH 6.5 时6 种生物胺总量为36.3 mg/L,高于pH 5.5 和pH 4.5两组;菌株摩根氏菌YC-16 在pH 5.5 和pH 6.5时组胺含量较高,分别为38.8 mg/L 和34.7 mg/L,这与该菌株的生长情况一致;菌株肠杆菌YC-1的腐胺含量在pH 4.5 时最高,达240.6 mg/L,这与吕佳良[19]的研究结果一致,阴沟肠杆菌产腐胺能力随pH 值的降低而升高;菌株嗜盐单胞菌BY-17 在pH 4.5 和pH 5.5 时组胺含量高于pH 6.5,这可能与菌株应激特性有关,在缺少营养物质和低酸条件下,微生物通过代谢氨基酸维持其生长活性,从而形成碱性的生物胺[21]。

图5 不同pH 值对生物胺含量的影响Fig.5 Effects of different pH value on the content of BAs
本研究筛选的8 个属的产生物胺菌株,均能产氨基酸脱羧酶,其中肥杆菌属与嗜盐单胞菌属之前无文献报道其具有产生物胺的能力。本文结合腌鱼产品中不同盐度及pH 值变化对筛选菌株的产生物胺特性进行分析,结果表明:当盐度达2%以上时,菌株具有生长活性,而生物胺积累大幅度降低,这可能是由于盐度造成氨基酸脱羧酶活性降低,导致生物胺下降;同时,大部分菌株对低酸环境较敏感。本研究提示在腌鱼加工过程中应选择新鲜的原料,以减少初始产生物胺微生物的数量。其次,在不影响产品品质及风味条件下适当增加盐度、喷涂乳酸酸性食品添加剂或接种少量乳酸菌[2]等可以抑制产生物胺菌株的生长,使脱羧酶活性维持在较低的水平,最终降低产品中生物胺含量,使其符合限量标准。此外,酸性环境对肠杆菌YC-1 等菌株产生物胺能力的刺激作用表明产生物胺菌代谢调控的复杂性,未来相关领域的研究亟待开展。

3 结论
从腌制鱼中筛选产生物胺微生物,经鉴定分别为肠杆菌属(Enterobacter sp.)、不动杆菌属(Acinetobacter sp.)、产气单胞菌属(Aeromonas sp.)、摩根氏菌属(Morganella sp.)、肥杆菌属(Obesumbacterium sp.)、希瓦氏菌属(Shewanella sp.)、普罗威登斯菌属(Providencia sp.)和嗜盐单胞菌属(Halomonas sp.)。选择6 株脱羧作用较强的不同菌株,对其生长及产生物胺特性进行分析。结果表明,两株肠杆属菌株肠杆菌YC-1 与肠杆菌YC-2 是主要的产尸胺与腐胺微生物,希瓦氏菌BY-19 与摩根氏菌YC-16 是主要的产组胺菌株。肠杆菌属在低酸环境下生长活性较强,生物胺积累较多,其它4 株细菌在低酸环境下,活性受到抑制。6 株产生物胺菌株随盐度的增加,生物胺含量显著下降。可见,盐度也是影响菌株产生物胺的关键因素,可通过调节盐度及pH 值,抑制菌株生长活性,减少氨基酸脱羧酶表达,降低生物胺含量。由于微生物种类不同,其生长及产生物胺特性存在显著差异。研究不同产生物胺菌株的特性,采取针对性措施降低生物胺含量,对腌鱼制品的工业化生产具有重要意义。

