绿豆皮对高脂饲料联合链脲佐菌素诱导的糖尿病小鼠糖脂代谢的改善作用
侯殿志,陈博睿,王 晗,陈昶宇,沈 群*
(1北京工商大学食品与健康学院 北京食品营养与人类健康高精尖创新中心 北京 100048 2中国农业大学食品科学与营养工程学院 植物蛋白与谷物加工北京市重点实验室 北京 100083)
糖尿病是一种复杂的代谢综合征,其特征是持续的高血糖和异常的脂质代谢[1]。如果得不到严格的控制,最终就会引发严重的并发症,例如:动脉粥样硬化、冠心病、中风和肾功能衰竭[2]。目前,市场上的一些药物对糖尿病患者普遍具有局限性和不耐受性,并且长期服用可能会引发多种副作用[3]。除了使用药物外,饮食管理和体力活动被认为是控制血糖,改善胰岛细胞敏感性和降低胆固醇水平的首要选择[4]。其中,膳食干预因在治疗和管理糖尿病方面潜在的健康益处而受到广泛的重视。近年来,豆类丰富的营养物质和低能量密度,在糖尿病的预防和治疗中引发研究者浓厚的兴趣[5]。
绿豆(Vigna radiata L.)是亚洲国家,特别是中国大多数家庭经常食用的一种豆类。绿豆种子主要由胚(子叶和胚轴)和种皮组成,根据之前的研究,大多数酚类物质和膳食纤维被证明存在于种皮中[6]。本实验室研究人员先前开展的动物实验,通过比较全绿豆和去皮绿豆对高脂喂养诱导的肥胖小鼠糖脂代谢的研究表明,相比去皮绿豆,全绿豆可有效缓解肥胖小鼠的体重,并且显著的改善肥胖小鼠的糖脂代谢和肠道菌群紊乱[7]。在相同添加量的条件下,通过比较全绿豆和去皮绿豆干预效果,说明绿豆皮在其中发挥着重要的作用。另外,除诸多研究表明膳食纤维在糖尿病的治疗中发挥着巨大的作用外[8-9],富含多酚的绿豆皮提取物通过体内外实验也证实其对糖脂代谢具有显著的健康益处[10-11]。然而,去除豆皮是生产豆类淀粉、分离豆类蛋白以及改善一些特殊食品风味的必要工序[12]。如果在确定绿豆皮对糖脂代谢改善作用的基础上,将其应用到新颖、营养和健康功能食品的开发上,就会增加豆类的附加值,并避免原料浪费。目前,一些豆类种皮,例如:豌豆种皮和羽扇豆种皮,已被用于高纤维面包和肉制品的加工[13-14]。
本研究通过评估绿豆种皮对高脂饲料联合链脲佐菌素诱导的糖尿病小鼠的生理、组织学和生化参数的变化,确定绿豆种皮对糖尿病小鼠糖脂代谢紊乱的改善作用,旨在为绿豆皮健康价值的开发及其在功能食品中的应用提供理论依据。
1 材料和方法
1.1 材料与试剂
明绿豆,山西东方物华农业科技有限责任公司。
4 周龄雄性C57/BL6J 小鼠,体重(16±2)g,北京维通利华实验动物技术有限公司。高脂饲料(D12492,60%的能量来自脂肪,提供5.24 kcal/g能量) 和低脂饲料(D12450J,10%的能量来自脂肪,提供3.85 kcal/g 能量),美国Research Diets 公司。
链脲佐菌素(STZ),美国Sigma 公司;无菌生理盐水,上海源叶生物科技有限公司;血糖、总胆固醇(TC)、总甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、血糖、谷草转氨酶(AST)和谷丙转氨酶(ALT)检测标准试剂,北京周天华枫医疗仪器有限公司;胰岛素超敏试剂盒,美国ALPCO 公司;糖化血清蛋白(GSP)测定试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
高速多功能食品粉碎机,南京科益机械设备有限公司;超低温冰箱,青岛海尔特种冰柜有限公司;低速离心机,美国Eppendorf 公司。电子天平,常熟市双杰测试仪器厂;拜耳血糖试纸及血糖仪,上海健臻医疗科技有限责任公司;血生化仪,日立3100 自动血生化仪;酶标仪,美国Thermo Fisher科技公司。
1.3 方法
1.3.1 绿豆皮的制备及特种饲料加工 将绿豆种子于室温下蒸馏水中浸泡8 h,手动揉搓并收集种皮,然后冷冻干燥。使用研磨机将干燥的绿豆种皮研磨成细粉(80 目),于-20 ℃条件下保存备用。
参照高脂饲料配方,将6%的绿豆皮(水分10.27%,灰分2.1%,脂肪0.6%,蛋白质8.01%,膳食纤维79.03%)以等宏量营养素和等热量的形式配比到高脂饲料中。具体的配比由饲料公司专业技术人员和本单位研究人员结合专业知识,参考相关文献共同商议完成。特种饲料的加工委托常州鼠一鼠二生物科技有限公司完成。
1.3.2 模型建立与分组 将C57/BL6J 小鼠以低脂饲料进行环境适应性喂养1 周后,随机选取8只小鼠作对照实验组(NC),继续以低脂饲料饲养。其余小鼠经4 周的纯高脂饲料饲养后,经隔夜禁食,注射100 mg/kg 的STZ[15]。在第5 周和第6周通过尾静脉取血测定小鼠的空腹血糖。将2 次空腹血糖水平均不低于11.1 mmol/L 的小鼠视为造模成功的糖尿病小鼠。再根据空腹血糖水平将其随机分为模型组(n=8,DC)和干预组(n=8,MBC)。模型组继续纯高脂饲养,干预组改为含绿豆皮的高脂饲料饲养,连续干预8 周。整个饲养环境为SPF 级,温度控制20~25 ℃,相对湿度45%~65%,12 h 光照交替,4 只小鼠1 笼,可自由取食和取水。每周测定小鼠体重1 次。
1.3.3 口服葡萄糖耐受实验(OGTT) 参考实验室前期的研究方法[7],在实验结束的最后1 周,6 h禁食后,灌胃小鼠25%葡萄糖溶液(2 g/kg 体重),用血糖仪测定小鼠尾尖0,30,60,90,120 min 时的血糖水平。本研究中,通过计算血糖曲线下面积(AUC)来表征葡萄糖耐受量的变化。
1.3.4 血生化、胰岛素及糖化血清蛋白的测定小鼠干预实验完成后,隔夜禁食,由专业技术人员对小鼠进行摘眼球取血,收集小鼠血液样品。待血样凝固,3 000 r/min 4 ℃离心10 min 得小鼠血清样品。采用自动血生化仪对小鼠的空腹血糖、总胆固醇(TC)、总甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)以及谷草转氨酶(AST)、谷丙转氨酶(ALT)进行检测。胰岛素和糖化血清蛋白的测定按照试剂盒说明书操作步骤进行。
1.3.5 肝组织的病理切片观察 将麻醉处死后的小鼠进行解剖处理,得到的肝和胰腺组织迅速固定在4%的多聚甲醛中,石蜡包埋,稳定后切片,厚度5~7 μm,用苏木精-伊红染色后在显微镜下观察胰腺和肝组织病理形态。
1.4 数据统计分析
试验数据用SPSS 22.0 和GraphPad Prism 6.0 统计软件分析处理和绘图,采用单因素方差分析及Tukey 事后检验,对2 组及2 组以上的数据进行比较和分析。实验数据以“平均值±标准偏差”(±s)表示,以P <0.05 表示差异显著,以P <0.01表示差异极显著。
2 结果与分析
2.1 绿豆皮对糖尿病小鼠体重的影响
由图1可知,干预实验开始后,持续的高脂饲料饲养使得模型组(DC)小鼠的体重显著高于对照组(NC)。对于干预组(MBC)小鼠,虽然在1~6周与对照组(NC)相比表现出显著的差异,但是在第7 周和第8 周无显著性差异。整个干预阶段,干预组(MBC)小鼠的体重与模型组(DC)不存在显著性差异,体重增加速度相对缓慢,表明绿豆皮在抑制小鼠体重的增加方面有积极的作用。
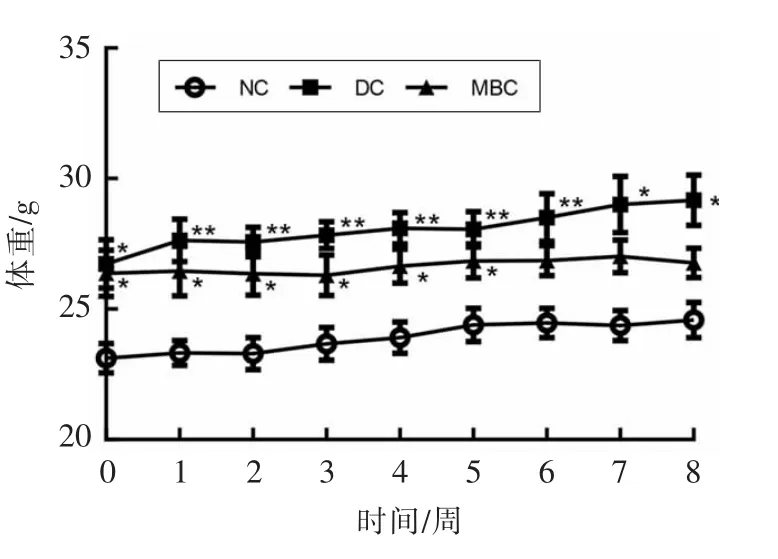
图1 绿豆皮对糖尿病小鼠体重的影响(n=8)Fig.1 Effects of mung bean seed-coat on body weight of diabetic mice(n=8)
2.2 绿豆皮对糖尿病小鼠空腹血糖、胰岛素和糖化血清蛋白的影响
如图2a 所示,持续的高脂饲养以及STZ 诱导致模型小鼠(DC)的空腹血糖显著高于正常对照组(NC)小鼠。经过8 周的干预实验发现,与模型组(DC)小鼠相比,干预组(MBC)小鼠的空腹血糖水平显著降低。STZ 注射会导致小鼠胰岛β 细胞损伤,甚至凋亡,进而出现胰岛素分泌不足的现象。由图2b 可看出经STZ 处理,模型组(DC)小鼠和干预组(MBC)小鼠的空腹胰岛素分泌量均显著低于正常对照组(NC)小鼠。然而,绿豆皮的干预却使糖尿病小鼠的空腹胰岛素水平显著上升。糖化血清蛋白作为糖尿病干预效果的一个评价指标,可有效反映糖尿病小鼠短期内血糖水平的变化。图2c 显示,模型组(DC)小鼠的糖化血清蛋白水平显著高于正常对照组(NC)小鼠,提示模型组小鼠的血糖水平始终处于高水平状态。绿豆皮的干预使糖尿病小鼠的糖化血清蛋白水平显著降低,提示干预组(MBC)小鼠的血糖在短期内相比于模型组处于显著降低的状态,这与空腹血糖水平的变化相一致。

图2 绿豆皮对糖尿病小鼠空腹血糖(a),胰岛素(b)和糖化血清蛋白(c)的影响(n=8)Fig.2 Effects of mung bean seed-coat on fasting blood glucose(a),insulin(b) and glycated serum protein(c) in diabetic mice(n=8)
2.3 绿豆皮对糖尿病小鼠口服糖耐量的影响
如图3a 所示,与正常对照组(NC)小鼠相比,模型组(DC)和干预组(MBC)小鼠在给予葡萄糖后血糖浓度迅速上升,并均在给予葡萄糖30 min后升至最大值,随后缓慢降低。与模型组(DC)小鼠相比,干预组(MBC) 小鼠的血糖浓度在120 min 内各时间点均表现出下降趋势,并在0 min 和60 min 时显示出显著差异。图3b 的糖耐量曲线下面积(AUC)结果显示,干预组(MBC)小鼠的AUC显著低于模型组(DC)小鼠,表明绿豆皮可有效减缓糖尿病小鼠餐后血糖水平的迅速升高。

图3 绿豆皮对糖尿病小鼠口服糖耐量(a)和糖耐受量曲下面积(b)的影响(n=8)Fig.3 Effects of mung bean seed-coat on oral glucose tolerance(a) and AUC(b) of diabetic mice(n=8)
2.4 绿豆皮对糖尿病小鼠血脂水平的影响
糖尿病由于长期处于高血糖状态,往往伴随着血脂代谢异常。TC、TG、HDL-C 和LDL-C 是评价血脂水平的重要指标。结果显示,模型组(DC)和干预组(MBC)小鼠的血脂4 项水平均显著高于正常对照组(NC)。与模型组(DC)相比,绿豆皮的补充显著降低了糖尿病小鼠的血清TC、TG 和LDL-C 水平。

图4 绿豆皮对糖尿病小鼠TC(a),TG(b),HDL-C(c)和LDL-C(d)的影响(n=8)Fig.4 Effects of mung bean seed-coat on TC(a),TG(b),HDL-C(c) and LDL-C(d) in diabetic mice(n=8)
2.5 绿豆皮对糖尿病小鼠肝和胰腺组织的影响
由图5a 可见,正常组(NC)小鼠肝组织的肝小叶结构完整,肝窦无病理性缺损,细胞核形态正常。然而模型组(DC)小鼠的肝细胞缝隙接连通道变宽、胞质空泡化,肝细胞出现坏死和自溶现象。经绿豆皮干预后,糖尿病小鼠的肝组织空泡化数量明显减少,肝细胞损伤明显降低,肝核消失症状减弱,肝细胞形态较完整。小鼠血清中AST 和ALT 的水平也证实了这一点。从图5c 和5d 可以看出,干预组(MBC)小鼠血清的AST 和ALT 水平显著低于模型组(DC)小鼠。另外,如图5b 所示,正常对照组(NC)小鼠的胰岛结构保持完整,胰岛β 细胞数量丰富且清晰可见。对于模型组(DC)小鼠,STZ 注射直接导致糖尿病小鼠胰岛出现明显萎缩,胰岛细胞严重坏死,β 细胞数量显著减少。绿豆皮干预使糖尿病小鼠胰岛坏死的情况得到明显减轻,胰岛β 细胞损伤显著降低,且数量有所增加。
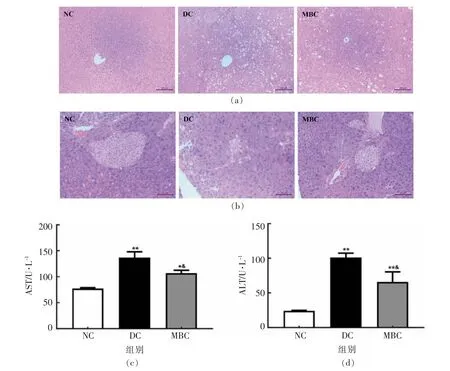
图5 绿豆皮对糖尿病小鼠肝组织(a),胰腺组织(b),血清AST(c)和ATL(d)的影响(n=8)Fig.5 Effects of mung bean seed-coat on liver tissue(a),pancreatic tissue(b),serum AST(c)and ATL(d) in diabetic mice(n=8)
3 结论与讨论
糖尿病是一种严重威胁人类健康的代谢性疾病。从膳食角度,探究功能性食品对糖尿病的预防和治疗具有重要意义。尽管绿豆皮中富含丰富的多酚类物质和膳食纤维,然而在淀粉、蛋白质以及一些特殊食品的制备过程中经常被丢弃。为了避免功能成分的浪费,扩大绿豆皮的应用价值,本研究以高脂饲料联合STZ 诱导的糖尿病小鼠为模型,研究绿豆皮对糖尿病小鼠糖脂代谢的改善作用。结果显示,绿豆皮干预显著降低了糖尿病小鼠的血糖浓度,增加了胰岛素分泌,更重要的是有效减缓了糖尿病小鼠餐后血糖水平的迅速升高。糖尿病小鼠的血脂异常和肝组织病理情况也得到了显著改善。先前的研究报道显示,通过连续灌胃4周的绿豆皮乙醇提取物(3 g/kg),可显著降低糖尿病KK-Ay小鼠的血糖和血脂水平,改善其糖耐量和胰岛素免疫反应的能力[10]。相似的实验结果也在其它研究中证实,绿豆皮乙醇提取物不仅可有效抑制α-葡萄糖苷酶的活性,而且可显著降低糖尿病db/db 小鼠血糖水平,提高其胰岛素敏感性[11]。这些也是与本实验的研究结果相一致的。除了绿豆皮中的多酚物质,其丰富的膳食纤维也发挥着重要的功效。膳食纤维对人体健康有重要作用,其在调节餐后血糖,升高血清胰岛素水平以及维持血糖平衡和功能方面得到诸多研究的证实[16-17]。佐兆杭等[18]的研究发现,通过连续灌胃42 d的杂豆纤维(绿豆、黑豆和芸豆混合膳食纤维),高脂饲养联合STZ 诱导的糖尿病大鼠的血糖水平得到显著控制,并且这种机制可能与修复胰岛组织细胞氧化损伤有关。除此之外,也有研究表明通过在高脂饲料中添加一定比例的豌豆种皮,可以通过增加胰岛细胞敏感性和改变肝脏脂质代谢来逆转高脂诱导肥胖小鼠的高血糖状态,其中豌豆纤维被认为在其中发挥着重要的作用[19-20]。综合来看,绿豆皮功效的发挥可能是其含有的膳食纤维和多酚等成分通过不同的机制共同作用的结果。
综上所述,绿豆皮可显著改善高脂饲料联合链脲佐菌素诱导的糖尿病小鼠的血糖和血脂水平,降低其糖化血清蛋白水平,增加其胰岛素分泌,同时其缓解肝和胰岛损伤。绿豆皮的有效利用不仅避免了副产物的浪费,而且为辅助降血糖功能性食品的开发提供了理论依据,其具体作用机理还有待深入研究。

