紫果西番莲子叶再生植株体系的建立*
朱雅静,王亚楠,赵李姗,余俊玲,王雪,许玉兰,蔡年辉,唐军荣
(1.西南林业大学 西南地区生物多样性保育国家林业和草原局重点实验室,云南 昆明 650224;2.西南林业大学 云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224)
紫果西番莲(Passifloraedulis)为西番莲科(Passifloraceae)西番莲属(Passiflora)植物。西番莲属植物大约有400余种,多产于热带美洲,在我国有19种,2变种[1]。其中紫果西番莲因其芳香物质含量多、营养价值丰富、药用价值高等特点[2-4],是该属植物中主要被开发利用的一种[5]。紫果西番莲在西双版纳傣族自治州种植面积达2 333.3 hm2,其生产的西番莲浓缩汁全部出口。紫果西番莲虽速生、丰产,但仍供不应求,市场需求量以每年15%~20%的速度增长,在国际市场热带水果中紫果西番莲占据重要地位[6-8]。但由于紫果西番莲易感染茎基腐病且抗寒性差[9],导致其产量及质量受到影响。而开展紫果西番莲的植物组织培养研究,对于紫果西番莲进行种质创新、优良材料的快速繁殖具有重要的实际应用价值[10]。
当前,利用植物组织培养技术通过不同操作、添加不同激素诱导紫果西番莲的叶、芽、茎、根、下胚轴均成功获得无菌苗[11-12]。由于紫果西番莲种子细小,在其植物组织培养过程中子叶被认为是更好的培养起始材料。此外,无菌苗的子叶经过了一定的时间发育,与子叶最初时的原始状态相比,材料更多,取材的准确性更高,且子叶与成熟的植株相比再生能力更强[8,13]。因此,本研究以紫果西番莲的子叶为材料,开展子叶再生不定芽的诱导,及其诱导后的不定芽生根和移栽炼苗研究,以期为紫果西番莲的离体快繁,以及基于植物组织培养的种质创新、遗传转化奠定基础。
1 材料与方法
1.1 材料
以紫果西番莲的种子经无菌萌发后小苗上的子叶为外植体。
1.2 间接器官发生途径诱导不定芽
将紫果西番莲无菌子叶切出伤口后放入1 mg/L 2,4-D+0.5 mg/LTDZ 的MS培养基中诱导出愈伤组织[14],将愈伤组织切成小块,于超净工作台上接入添加TDZ(0.5、1.0 mg/L)和2,4-D(1.0、1.5、2.0 mg/L)的MS培养基中,共6个处理(表1),每个处理接5瓶,设置3个重复。暗培养7 d后转到光培养,培养室的温度为(25±2)℃,光照时间为12 h/d,光照强度1 000~1 500 Lx。30 d后统计分化结果。
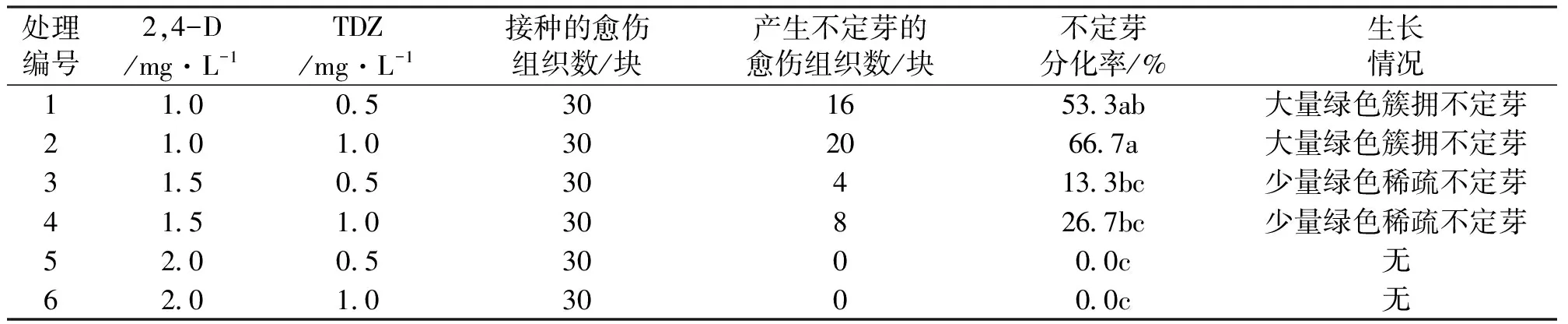
表1 不同激素浓度对愈伤组织分化芽的影响
1.3 直接器官发生途径诱导不定芽
将紫果西番莲无菌子叶切出伤口后于超净工作台上接入添加6-BA(1.0、2.0 mg/L)与IBA(0.5、1.0 mg/L)的MS培养基中,共4个处理(表2),每个处理接5瓶,设置3个重复。培养温度为(25±2)℃,光照时间为12 h/d,光照强度1 000~1 500 Lx。30 d后统计分化结果。
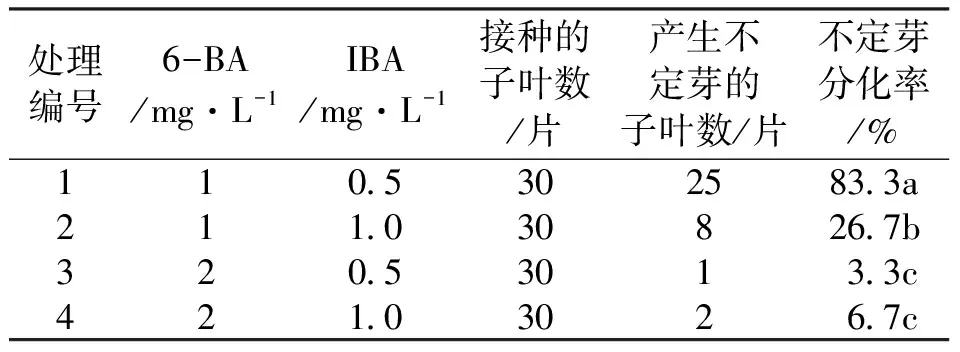
表2 不同浓度激素对子叶直接分化不定芽的影响
1.4 生根培养基筛选
使用1 mg/L6-BA+ 0.3 mg/LIAA的MS培养基进行不定芽增殖培养[14]。将长至2 cm左右的不定芽转入以1/2 MS为基本培养基,并添加IBA(0.1、0.2、0.3 mg/L)、NAA(0.3、0.5 mg/L)与0.2 g/L碳粉的培养基中进行生根培养,共6个处理(表3),设对照与重复,30 d后统计生根情况。

表3 不同浓度激素对生根苗的影响
1.5 移栽基质的筛选
将生根无菌苗移至室内自然光下进行炼苗,将盖子逐渐打开直到15 d后完全打开,将生根苗取出浸泡于0.1%的多菌灵中10 min后移至不同配比的基质中。土壤基质为红土、腐殖土、珍珠岩的不同比例混合(表4)。

表4 不同土壤基质对组培苗的成活率影响
1.6 数据处理与分析
统计分化出不定芽的愈伤组织与子叶数量及植株的生根数。用直尺(cm)测量植株的生根长度,记录不同土壤中植株的成活数。计算不同诱导途径不定芽的分化率、生根率和成活率。数据采用Excel 2011和SPSS 18.0软件进行整理和分析。
其中:在器官间接发生途径中,不定芽分化率=分化出不定芽的愈伤组织块数/接种的愈伤组织块数×100%;
在器官直接发生途径中,不定芽分化率=分化出不定芽的子叶数/接种的子叶数×100%;
生根率=生根数/接种数×100%;
成活率=成活数/接种数×100%。
2 结果与分析
2.1 器官间接发生途径诱导不定芽
植物外源激素具有双重作用,浓度过高将抑制或杀死植物,浓度过低对植物的诱导生长不能起到最好的作用,对不同的植物组织选择合适的浓度才能使其得到较好的生长。在对紫果西番莲子叶愈伤组织进行分化不定芽的试验中(图1),如表1所示,2,4-D浓度为1 mg/L和1.5 mg/L时均有不定芽产生,不定芽分化率随2,4-D浓度的增加而下降,当2,4-D浓度达到2 mg/L时,分化不定芽数为0,说明高浓度的2,4-D反而不利于不定芽的分化。在1 mg/L 2,4-D+1 mg/L TDZ+MS这一配方下分化出不定芽的愈伤组织数量最多,分化率达66.7%。

图1 愈伤组织分化不定芽
2.2 器官直接发生途径诱导不定芽
6-BA是一种高效、稳定的细胞分裂素,IBA是一种常用于离体快繁的生长素,二者配合使用可促进外植体分化不定芽。在通过无菌子叶直接分化不定芽的试验中,如表2所示,培养30 d后发现4个处理均能直接分化出不定芽,在6-BA浓度为1 mg/L时诱导不定芽数量较多,浓度为2 mg/L时诱导出的不定芽长势较高,说明高浓度的6-BA利于不定芽的生长,低浓度6-BA利于不定芽的分化。在不同激素作用下能分化出不定芽的子叶较能分化出不定芽的愈伤组织数量多。如图2所示,在1 mg/L 6-BA+0.5 mg/L IBA的MS培养基中通过诱导直接分化出不定芽的子叶数量最多,分化率达83.3%。当不定芽长至1.5~2.0 cm时可切下进行增殖培养。

图2 子叶直接分化不定芽
2.3 生根培养基筛选
将不定芽移至1 mg/L 6-BA+0.3 mg/LIAA的MS培养基中培养30 d后统计其增殖倍数与平均苗高,增值倍数为2.6,苗高达2.7 cm,不定芽长势良好,如图3所示。将长至2.0 cm左右的植株,移至含不同激素配比的生根培养基中培养,并在生根培养基中加入0.2 g/L的碳粉。适量的碳粉能提供暗环境利于根的形成与生长。培养30 d后,由表3可知当NAA为0.3 mg/L时,生根率随着IBA浓度的增加开始增加,但当IBA达到0.3 mg/L时生根率不再增加;当NAA为0.5 mg/L时,生根率随着IBA浓度的增加呈现下降趋势,在0.5 mg/L NAA+0.1 mg/L IBA+0.2 g/L碳粉的1/2 MS培养基中,紫果西番莲植株生根率最高,达83.3%,且在该配比下植株的根系生长情况最佳,见图4。

图3 不定芽增殖Fig.3 Adventitious bud multiplication

图4 紫果西番莲生根
2.4 移栽基质的筛选
将培养基盖逐渐打开在室内适应15 d后,移至不同的基质中,30 d后观察并记录植株生长情况。由表4可知,仅用红土栽培的植株表现出黄化、枯萎死亡、植株矮化的现象,相比较之下仅用腐殖土栽种的植株成活率稍高,但仍不适宜紫果西番莲植株的生长。红土有保水的作用,腐殖土能提供较多的营养,当红土与腐殖土、珍珠岩配合使用时较利于植株生长,且配比为1︰2︰1时植株长势好,成活率最高,达93.3%,移栽后紫果西番莲无菌苗长势良好(图5)。

图5 紫果西番莲移栽
3 讨论与结论
植物组织培养中不定芽的发生方式可以分为2种,即直接发生型和间接发生型。其中直接发生型中常采用芽、茎和下胚轴作为外植体通过激素直接诱导器官得到不定芽[11,15]。在本研究中,采用紫果西番莲子叶在1.0 mg/L 6-BA+0.5 mg/L IBA的MS培养基中通过直接器官发生途径分化出不定芽,其分化率为 83.3%。这一结果与张琴等[16]对紫果西番莲子叶进行分化的结果相似,都选用了6-BA这一细胞分裂素,其主要作用是促进不定芽的萌发,其中6-BA浓度过高或过低都会抑制不定芽的形成[17]。在间接发生型中常采用叶、子叶为外植体经脱分化得到愈伤组织再分化得到不定芽[18-19]。在本研究中,紫果西番莲子叶经脱分化得到的愈伤组织在1 mg/L 2,4-D+1 mg/L TDZ的MS培养基中通过器官间接发生途径也分化出不定芽,其分化率为66.7%。这一分化率高于王亚楠等[14]的研究,虽都采用同类型的激素,但激素浓度不同,导致分化结果不同。结果表明,同一器官在不同的激素浓度与培养条件下其分化能力有较大差异[20-21]。其中在器官直接发生型中选择合适的激素种类及浓度不仅能将操作过程简化还能缩短育种周期,此途径无需通过脱分化即可获得不定芽,在需要快速得到大量无菌苗的工作中适用。同样,器官间接发生型中激素的选择也至关重要,2,4-D与TDZ共同作用可促使愈伤组织分化出不定芽,2,4-D在分化过程中起到脱分化的作用[22],但2,4-D浓度过高对植物有很大的毒害作用[23]。此方式经过脱分化再分化,先形成愈伤组织后才萌发出不定芽,而脱分化细胞易于诱导变异,所以该方式适用于突变育种及基因转化系统的建立[24-25]。
此外,本研究中,通过直接发生型或间接发生型得到的紫果西番莲不定芽在0.5 mg/L NAA +0.1 mg/L IBA+0.2 g/L碳粉的1/2 MS培养基中生根状况均较好,生根率可达83.3%。生根苗在不同基质配比的土壤中呈现不同的生长状态[26],在仅用红土栽培时无菌苗成活率最低,大部分枯萎死亡。由于红土比较板结不利于植物根系呼吸,易积水导致根系腐烂[27],但其有保水的优势与珍珠岩一起使用能够中和其缺点,而加入腐殖土可以提高土壤的营养成分,使植株长得更好。所以本研究中筛选出红土︰腐殖土︰珍珠岩=1︰2︰1的土壤基质培育紫果西番莲无菌苗,成活率可达93.3%。且在移栽紫果西番莲无菌苗的过程中炼苗时间显得尤为重要,在室内炼苗15 d的无菌苗明显比直接移栽的苗长势好,成活率更高。
本研究利用紫果西番莲子叶通过2种器官发生途径成功建立了紫果西番莲的植株再生体系,并筛选出了适合紫果西番莲移栽炼苗的基质。研究结果进一步完善了紫果西番莲的植物组织培养技术,不仅为紫果西番莲倍性育种及转基因工程奠定了一定基础,也为紫果西番莲无菌苗的栽培提供了科学依据与技术支撑。

