一株烈性沙门氏菌噬菌体的生物学特性及基因组分析
黄景晓 尚俊康 陈慧敏 沈嘉旻 黎圆圆 喻玉立 倪进东 林伯坤
(广东医科大学公共卫生学院 东莞市环境医学重点实验室,东莞 523808)
随着经济全球化的深入和食品洲际运输的增加,食源性疾病的流行已成为一个严重的公共卫生问题[1]。根据世界卫生组织的估计,这些食源性病原体每年可能导致6亿人患病,42万人死亡,以及低收入和中等收入国家生产力和医疗成本的损失约1 100亿美元[2-4]。其中沙门氏菌是社会经济负担最重的食源性致病菌,在2017年引致全球约1 430万宗伤寒或副伤寒个案及53.5万宗非伤寒沙门氏 菌[5-6]。沙门氏菌的污染可发生在食物链的任何一个环节,包括收获、生产、加工、保存和其他从农场到消费者的过程[7]。沙门氏菌可隐藏在灌溉水和土壤中污染果蔬和农作物[8-9],也能以生物膜的形式覆盖在机器设备和保存用具的表面[10-11]。为了控制这种细菌感染,抗生素的使用逐年增加,这加速了抗生素在环境中的残留和耐药菌的出现[12-14]。如果不采取有效措施解决抗菌素耐药性问题,到2050年,将可能导致全球每年约1 000万人死亡和60-100万亿美元的生产力损失[15]。
噬菌体作为天然的细菌“杀手”,不受细菌耐药性的制约,能特异性识别并杀灭病原菌,不会破坏肠道菌群平衡和伤害人体健康[16]。同时,噬菌体具有分布广泛、自我繁殖能力强、杀灭能力强、不影响食物的感官性状等优点,使得噬菌体生物防治成为处理食品生产链中的病原菌污染的理想方法[17]。目前,噬菌体的应用已获得美国农业部食品及药物管理局(FDA)和食品安全与美国农业部(USDA)的批准,作为食品原料和加工产品的抗生素代替物,以保障食品安全和消费者健康[18-20]。烈性噬菌体分离鉴定是各种噬菌体剂研究的必要前提,同时针对其生物性状进行研究是优化噬菌体剂的生产条件和在不同环境中开发应用噬菌体的关键。本研究以肠炎沙门氏菌为宿主菌,从环境样品中分离出一种具有良好的裂解能力的噬菌体PSM6,并通过裂解谱、最佳感染复数、一步生长曲线、温度及pH稳定性、形态学、基因组核酸类型分析和基因组测序分析,展开其生物学特性研究,为后续噬菌体抗菌剂的生产应用奠定了基础。
1 材料与方法
1.1 材料
菌株和样品采集:肠炎沙门氏菌(GIM 1.1105)购自广东省微生物菌种保藏中心,裂解谱分析所用沙门氏菌来自深圳市疾病预防控制中心常规食品监测分离,河水样采自东莞市东江河段。
主要试剂及培养基:SM 缓冲液(NaCl 5.8 g/L,MgSO4·7H2O 2.0 g,1 mol/L pH为7.5的Tris-HCl 50 mL/L,2%明胶 5 mL/L)、LB液体培养基、2倍LB液体培养基、半固体LB培养基(添加琼脂粉含量0.75%)、固体LB培养基(琼脂含量1.5%)、pH3-13的0.05 mol/L Tris-HCl缓冲液、沙门氏菌显色培养基(广东环凯)、麦氏比色管、艾比根λ噬菌体基因组DNA提取试剂盒(柱型)NEB DNase I和Mung-Bean Nuclease、索来宝RNase A和SYBR Green Ⅰ。
主要仪器:台式电热恒温培养箱(上海博讯)、上海一恒恒温金属浴、湘仪H1850R、三孔电热恒温水槽(上海精宏)、恒温HY-5回旋式震荡器(金坛市城东新瑞仪器厂)、超净工作台(苏州智净)、琼脂糖水平电泳槽、FluorChem R 多功能成像分析系统(美国Protein Simple)、NANODROP 2000c(美国Thermo公司);超纯水仪(Millipore公司);FEITalosF200X透射电镜(美国FEI)。
1.2 方法
1.2.1 噬菌体的分离纯化 宿主菌复苏:将冻存的肠炎沙门氏菌菌液三区划线,接种于沙门氏菌显色培养基,置于37℃培养箱约12 h,取单菌落接种到LB液体培养基中,37℃、180 r/min振荡培养至对数期,得到新鲜菌液。
样品处理:使用经高压蒸汽灭菌后的塑料瓶采集污水样品。以8 000 r/min后离心水样15 min,取上清液用0.22 μm过滤注射器过滤。取滤液5 mL于20 mL LB液体培养基中,再加入500 μL菌液和2 mL SM缓冲液,混匀后220 r/min摇床培养12 h获得富集液。富集液重复离心过滤取噬菌体滤液,按上述步骤再处理2次。
噬菌体的分离纯化:分离步骤主要根据参考文献略加修改[21-22],噬菌体的分离纯化采用双层平板法分离噬菌体。用SM缓冲液对最后一次富集后的噬菌体滤液进行10倍稀释。取100 μL不同倍数的稀释液与100 μL菌液于灭菌好的96孔细胞培养板中,混合后静置反应15-20 min,吸入到45℃保温的10 mL LB半固体普通培养基混合均匀,迅速倒入准备好的普通固体平板上。将双层平板置于37℃培养箱中,8 h后观察有无噬菌斑。在15 h内,挑取双层平板上1个透亮、圆润的噬菌斑,置于含100 μL菌液和8 mL SM缓冲液的8 mL 2倍LB液体培养基的试管中,倾斜摇床12 h。摇床完毕后,重复上述方法,进行3-5次纯化,直到平板上所出现的噬菌斑的大小形态均匀一致为止。最后一次纯化,保存噬菌体滤液并计算噬菌体效价备用。取满板噬菌斑板的上层培养基于用15 mL SM缓冲液的15 mL 2倍LB液体培养基,过夜摇床扩增培养保存。
噬菌体效价(PFU/mL)=噬菌斑个数×稀释倍数×10
1.2.2 噬菌体裂解谱的测定 将所存的沙门氏菌分别培养至生长对数期,取200 μL菌液于1.5 mL的离心管,用高压灭菌好的棉拭子吸走所有菌液,涂抹于提前倒好的下层培养基,取3 μL噬菌体滤液滴于双层平板上,正置30 min后,倒置放入培养箱中培养8 h,观察观察有无裂解斑。
1.2.3 噬菌体的电镜观察 取10 μL扩增培养后的噬菌体滤液滴于铜网上,自然沉淀 10 min,用滤纸从侧面吸干多余的液体加1滴 2%磷钨酸到铜网上,染色10 min,待铜网干燥后用透射式电镜观察,采用ImageJ软件分析其大小。
1.2.4 最佳感染复数的测定 使用麦氏比色管法和涂布平板法确认菌液浓度,将菌液和噬菌体滤液以不同数量倍数混合于1.5 mL的EP管,用LB液体培养基将总体系补足1 mL,37℃ 200 r/min摇床培养3 h,以双层平板法测定噬菌体效价,重复3次,即可得出最佳感染复数。
1.2.5 噬菌体的热稳定性 取1 000 μL噬菌体滤液(约108PFU/mL)于1.5 mL EP管中,分别于 40、50、60、70、80℃的水浴中作用2 h,每隔20 min取样,并立即将样品置于冰上冷却,经过10倍梯度稀释后测定噬菌体的效价、分析噬菌体的存活情况、使用GraphPad Prism 8处理数据。
1.2.6 噬菌体的pH稳定性 取100 μL噬菌体滤液(约108PFU/mL)于1.5 mL EP管中,分别加入900 μL不同pH值(即pH为2、3、4、5、6、7、8、9、10、11、12、13)的Tris-HCl缓冲液中,37℃ 200 r/min摇床培养2 h后,取100 μL进行10倍梯度稀释,用双层平板法测定噬菌体效价,重复3次。通过计算效价,分析噬菌体的pH稳定性。
1.2.7 一步生长曲线的测定 取1 mL对数期肠炎沙门氏菌菌液(约108CFU/mL),按照最佳感染复数加入噬菌体,常温孵育15 min后,8 000 r/min离心2 min,弃上清,用LB液体培养基洗两次去除游离噬菌体,细菌沉淀加入37℃预热的LB液体培养基混匀,迅速置于37℃ 180 r/min的摇床振荡培养,并开始计时。每20 min取样,梯度稀释后用双层平板法测定噬菌体效价,重复3次。使用GraphPad Prism 8绘制一步生长曲线,算出噬菌体的潜伏期和爆发量。爆发量计算公式:爆发量=爆发末期噬菌体效价/感染初期宿主菌浓度。
1.2.8 噬菌体核酸的提取和核酸类型的判断 噬菌体核酸的提取按照艾比根λ噬菌体基因组DNA提取试剂盒说明书,略有所修改。取14 mL的新鲜噬菌体培养液加入140 μL氯仿,4 000 r/min离心10 min,取上清12 mL。再以10 000 r/min离心并用0.22 μm过滤器的注射器过滤,取10 mL/管。分别加入50 μL RnaseA和DNase I,37℃ 180 r/min的摇床1 h,加入预冷的噬菌体沉淀液2 mL,颠倒混匀,4℃过夜浓缩。之后按照说明书步骤进行,所得核酸浓度和纯度用NANODROP 2000c测定,浓度不够的样品需要重新进行噬菌体的富集和浓缩。将提取的核酸取适量按产品说明书进行核酸酶(DNase I、Mung-Bean Nuclease、RNase A)消化处理,制备0.8%的琼脂糖凝胶,电泳(90 V、40 min)以验证其核酸类型,使用SYBR Green Ⅰ染料代替EB进行核酸电泳并在紫外照射下观察核酸和染料的结合色。使用多功能成像分析系统进行曝光。
1.2.9 噬菌体基因组测定与分析 核酸提取后,由安诺优达公司负责进行基因组测定。采用Velvet组装软件对原始数据进行组装;采用augustus软件对组装序列进行基因预测;采用gapfilling进行软件补洞和sanger测序补洞;采用eggnog-mapper对编码基因进行COG和GO注释;通过CGView Server绘制PSM6基因组图谱;采用MCscanX软件进行近缘噬菌体基因组共线性分析并通过mauve软件比对分析PSM6和其同源性最高的噬菌体;采用Blast和Interpro程序对编码基因做进一步的功能预测。
2 结果
2.1 噬菌体的分离纯化
通过对河水中的噬菌体进行浓缩分离纯化,双层平板培养6-12 h可观察到噬菌斑慢慢出现,然后变大变清晰,最终在肠炎沙门氏菌菌苔上出现透亮、大小均匀的噬菌斑,噬菌斑大小约1.5 mm-2.0 mm(图1)。通过效价测定得到,所纯化保存的噬菌体滤液浓度均大于1012PFU/mL。扩增培养后的噬菌体稳定性良好,放置4℃保存半年仍可以活化成功。

图1 PSM6的噬菌斑Fig.1 Plaque of phage PSM6
2.2 噬菌体裂解谱的测定
通过点样法测定噬菌体PSM6的裂解范围,结果如表1所示,PSM6除了肠炎沙门氏菌之外,还可裂解鼠伤寒、彻斯特、伦敦、科瓦利斯、德尔卑等多种血清型沙门氏菌,表明该噬菌体的裂解谱较宽。同时,通过实验验证PSM6可裂解大肠杆菌ATCC25922、DH5α、BL21,且对宋内志贺氏菌CMCC(B)51592有较弱的裂解活性。

表1 噬菌体PSM6的裂解范围Table 1 Host range of phages PSM6
2.3 噬菌体的电镜观察
经磷钨酸负染后,可在透射电镜下清晰地观察到噬菌体PSM6由正二十面体的头部、含有短的末端纤维的细长尾部构成,详见图 2,可见头部直径约为 72 nm,尾部长度约为 122 nm,因此PSM6属于有尾噬菌体目(Caudovirales)。
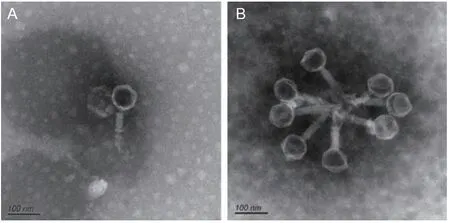
图2 电镜下PSM6的形态Fig.2 Morphology characterization of phage PSM6 under transmission electron microscopy
2.4 最佳感染复数的测定
将噬菌体和宿主菌按照不同比例摇床培养3 h后,测定噬菌体效价。结果表明当感染复数MOI=0.01时,产生的子代噬菌体量最多,详见表 2,因此最佳感染复数为0.01。
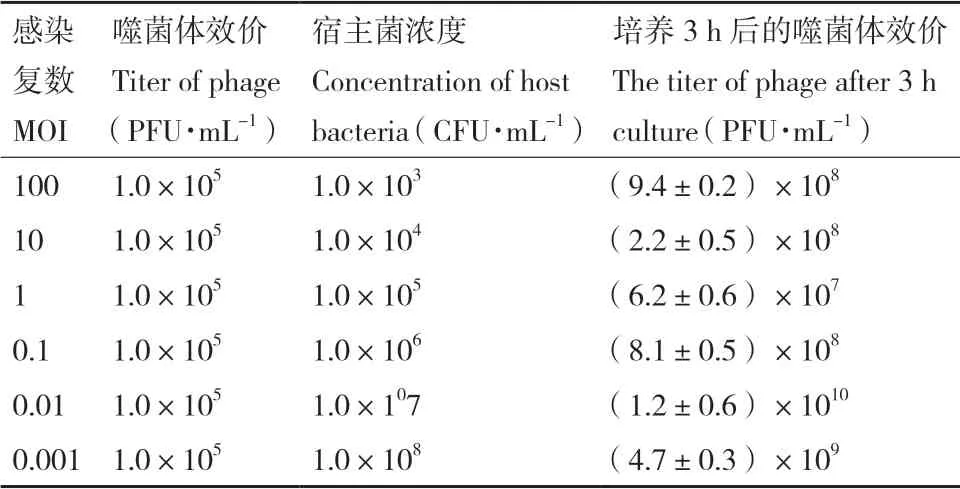
表2 噬菌体PSM6的最佳感染复数测定结果Table 2 Optimal multiplicity of infection(MOI)of phages PSM6
2.5 噬菌体的热稳定性
噬菌体在不同温度的效价变化和存活情况不同,具体结果如图3。在 40℃作用2 h,噬菌体PSM6维持原有活性,效价基本不变。在60℃作用2 h后,效价仍有107.4PFU/mL,存活率约25%;随着温度的升高,PSM6效价下降的速度越快。在80℃作用2 h,PSM6的效价最低,下降到106.2PFU/mL。总体上分析,PSM6的热稳定性较强。

图3 噬菌体PSM6的热稳定性Fig.3 Thermal stability of phages PSM6
2.6 噬菌体的pH稳定性
PSM6在pH为5-10的范围内效价稳定,活性较高,存活率大于80%;pH4时,效价下降明显,存活率约11.3%;在pH2、3、11、12、13的极端环境中,噬菌体效价降低到低于检出限(即存活率低于0.1%)(图4)。
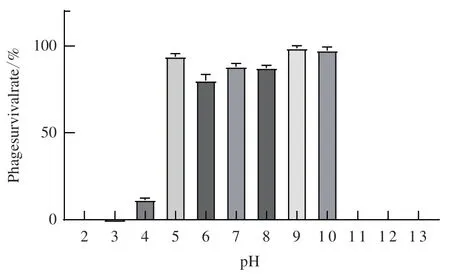
图4 噬菌体PSM6的pH稳定性Fig. 4 pH stability of phages PSM6
2.7 一步生长曲线的测定
根据PSM6的一步生长曲线显示(图5)。噬菌体效价在0-20 min时,变化不大,这一时期为潜伏期;而后在20-80 min时,急剧增加,可推断出这一时期为爆发期,爆发时间为60 min,爆发量为56 PFU/cell;之后曲线趋于平稳,PSM6进入稳定期。
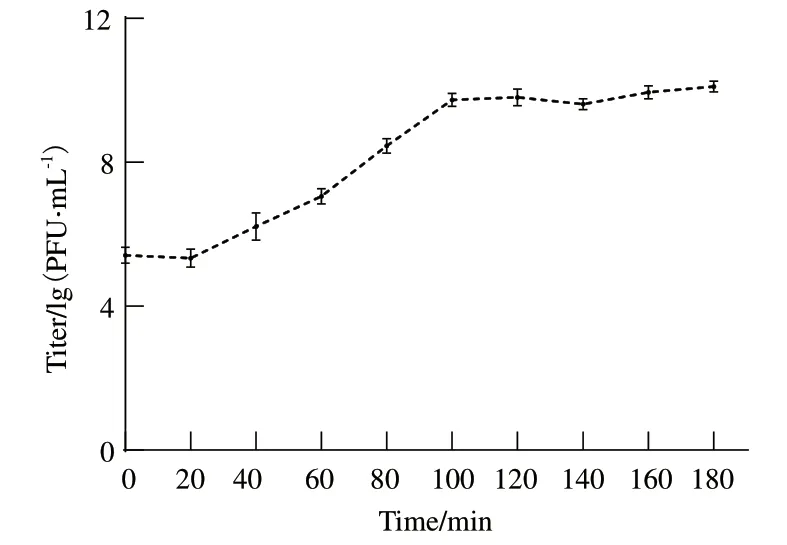
图5 噬菌体PSM6的一步生长曲线Fig.5 The One-step growth curve of the phage PSM6
2.8 噬菌体的核酸类型
PSM6的核酸可被DNase I消化,而不能被Mung-Bean Nuclease消化和RNase A消化,此外结合了SYBR Green Ⅰ染料的核酸在紫外下显示绿色,因而可判断PSM6的核酸是双链DNA(图6)。
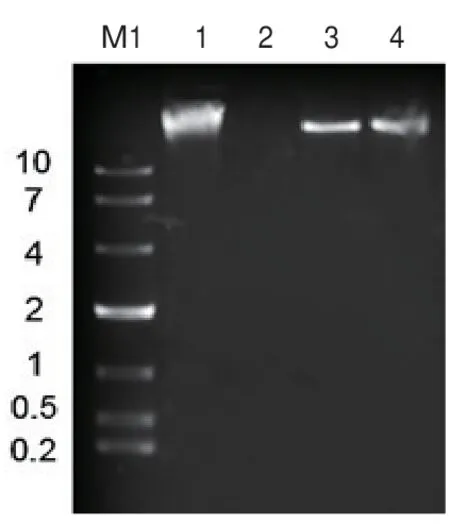
图6 噬菌体PSM6的核酸类型判断Fig.6 Nucleic acid type of phage PSM6
2.9 噬菌体基因组测定与分析
最终测得噬菌体PSM6的基因组大小为90 730 bp,G+C含量为39.57%,基因组图谱如图7。PSM6的基因组与沙门氏菌噬菌体vB_SPuM_SP116、大肠杆菌噬菌体vB_EcoM_AYO145A、志贺氏菌噬菌体Z31等6株肠杆菌科细菌噬菌体的基因组相似性较高,如表3,达92.55%-94.62%。采用MCscanX软件对这6株噬菌体基因组进行共线性分析(图8),发现6个噬菌体基因组之间存在良好的基因组共线性关系。为了更细微的了解PSM6与其它噬菌体之间的基因组结构差异,将PSM6与同源性最高的vB_SPuM_SP116噬菌体的基因组进行比较分析(图9),结果表明两个基因组之间存在如插入和缺失等变异,相同颜色的矩形块表示序列的共线区域,而部分区域长度和位置存在差异。几乎所有PSM6的基因均与来自肌尾噬菌体科(myoviridae)的噬菌体基因最为相似,结合电镜观察,因此判定噬菌体PSM6应属于肌尾噬菌体科。
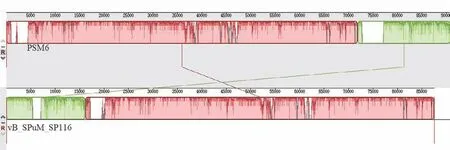
图9 PSM6和vB_SPuM_SP116的比较分析Fig.9 Comparative analysis of PSM6 and vB_SPuM_SP116
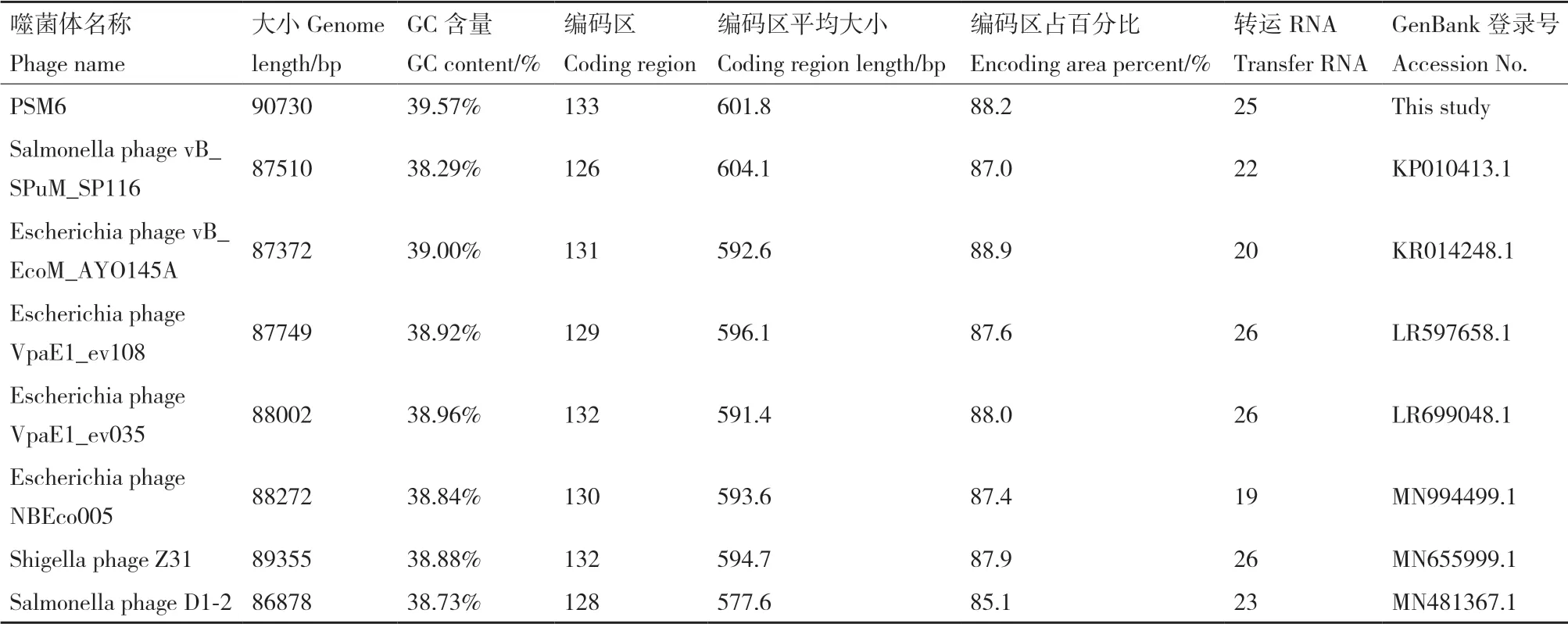
表3 噬菌体PSM6基因组和其近缘噬菌体的比较Table 3 Comparative analysis of PSM6 and its closely related phage
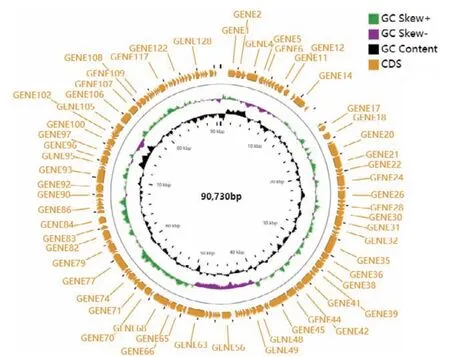
图7 SM6的基因组图谱Fig.7 Genomic organization of phage PSM6

图8 PSM6和其近缘噬菌体的共线性比较分析Fig.8 Collinearity analysis of PSM6 and its closely related phage
预测PSM6基因组编码133个蛋白,其中47个蛋白的功能预测见表4,主要属于结构蛋白、核酸复制调控蛋白、核酸组装和细菌裂解蛋白。其余蛋白的功能未能预测,均为hypothetical protein。基因组中未发现抗生素耐药基因及毒力因子基因,说明噬菌体PSM6是一种适合安全应用的噬菌体。存在与裂解细菌相关的holin-lysin系统,包括2个裂解酶(lysin,也称内溶素,编号GENE17和GENE108)、2个穿孔素(holin,编号GENE10和GENE47)和2个破坏细菌外膜的裂解辅助蛋白spanins(o-spanin,编号GENE113和i-spanin,编号GENE111)。其中裂解酶GENE17与大肠杆菌噬菌体vB_EcoM_Shy、沙门氏菌噬菌体vB_SPuM_SP116和志贺氏菌噬菌体Z31等的裂解酶(GenBank accession number分别 是QNR52107、YP_009146288和QHB48992)有达94.2%-95.4%的序列相似性。裂解酶GENE108则与大肠杆菌噬菌体pinkbiff和skuden的推测裂解酶(GenBank accession number分别是QHR70074和QHR67794)分别有98.9%和97.8%的序列相似性。穿孔素GENE10与沙门氏菌噬菌体Mushroom的穿孔 素(GenBank accession number = YP_009600453)有95.7%的序列相似性。穿孔素GENE47与肠杆菌科细菌噬菌体vB_EcoM_IME338、沙门氏菌噬菌体BPS15Q2的穿孔素(GenBank accession number分别是AWD91365和YP_009324630)分别有高达100%和99.2%的序列相似性。但是目前这些相似性较高的裂解酶、穿孔素和spanins均未得到研究,其特性未清楚。

表4 噬菌体PSM6编码蛋白功能预测Table 4 Prediction of PSM6 protein-coding regions
3 讨论
噬菌体是自然界中物种最丰富和最具生物多样性的生物实体,超过包括细菌在内的其他物种的总和,约1031种,然而现公开分离鉴定信息的噬菌体仅10 000种左右[23]。同时,并非所有的噬菌体都能符合生物抗菌剂的标准,比如温和噬菌体、不能感染目标细菌的噬菌体、不能承受食品加工过程中的物理化学条件等[24]。因此,烈性噬菌体的分离鉴定及其生物特性研究和基因组分析,对挖掘噬菌体这一抗菌资源库和了解其后续的开发应用条件具有不可代替的作用。
分离出烈性噬菌体的关键环节在于含有噬菌体环境样品的采集、富集和及时纯化。添加SM缓冲液和增加富集次数可以提高分离成功率[21]。同时,待噬菌体出斑,及时挑斑以确保噬菌体活性最强,双层平板上培养时间过久的噬菌体可能失活。
肠炎沙门氏菌和鼠伤寒沙门氏菌是人类感染病例中最常见的血清型[23]。近年来,多重耐药的沙门氏菌[25]和其他非常见沙门氏菌血清型的食物中毒事件频频发生[26-27],如多重耐药鼠伤寒沙门氏菌DT104菌株在全球迅速进化和传播[28]。动物类食品的污染是引发食物中毒的最常见原因[29-30]。长春的一项研究结果显示,93.75%的从猪肉或鸡肉中分离出的沙门氏菌对一种或多种抗生素耐药[31]。全球报告的沙门氏菌血清型约超过2 500种,其中确定以鸡为传播媒介的约2 000种血清型[32]。噬菌体的特异性对于种间而言意味着不干扰正常菌群,然而在种内特异性过强则代表其裂解谱过窄,也许不能作为所需宿主的生物防治剂[33]。通常,低宿主密度的环境样品所分离出的噬菌体裂解谱比高宿主密度的样品中所分离的更宽[34-35]。为了得到应用范围更广的噬菌体,本研究以肠炎沙门氏菌为宿主,从低宿主密度的河水中进行采样分离。同时,采用点样法研究噬菌体对从禽畜肉类分离出的沙门氏菌的裂解能力,结果表明PSM6可裂解肠炎、鼠伤寒、彻斯特、伦敦、科瓦利斯、德尔卑等多种血清型沙门氏菌,裂解谱较宽,具备成为抗生素代替物的潜力。
噬菌体的活性易受多种理化条件的影响,摸索和评估其在体外的适应条件是后期生物防治应用的基础[36-37]。PSM6的pH效价稳定范围与现已分离的大部分噬菌体相似[38-39]。目前报道的大多数噬菌体不耐高温,如在60℃处理100 min存活基本不超过1%[40-42]。而PSM6在60℃处理120 min后,存活超过25%,这意味着PSM6更耐高温,热稳定性更强。同时,PSM6在沙门氏菌噬菌体中,属于潜伏期短,爆发量大和最佳感染复数小的部分噬菌体[43-45],这表明PSM6的繁殖活性理想,可在短时间内杀灭更多的沙门氏菌。
根据国际病毒分类委员会(ICTV)的最新分类和命名及相关文献报道[46-48],现大多数已分离噬菌体都是有尾的,且核酸大都为双链DNA(dsDNA),且目前发现的基因组类型为单链DNA的噬菌体只有微小噬菌体科(Microviridae)和丝杆状噬菌体科(Inoviridae)。基于电镜的形态分析,PSM6属于有尾噬菌体,因此PSM6的核酸类型最有可能是dsDNA。Mung-Bean Nuclease是一种常用于消化单链DNA或RNA的核酸酶,但过量使用亦可降解双链DNA、RNA或者DNA-RNA杂交体。为了避免Mung-Bean Nuclease的使用过量,本研究使用了SYBR GreenⅠ染料进行核酸电泳,通过这种染料在紫外透射下与DNA单双链的结合颜色不同,减少了判断失误的可能性。
烈性噬菌体通过产生裂解酶溶解细菌细胞壁而入侵宿主细胞。通过测序分析发现,PSM6具有裂解酶,而不含整合酶、转座酶、抗生素抗性基因和毒力因子等相关基因,这支持了PSM6属于可安全应用的烈性噬菌体范围。目前发现的噬菌体多数是通过穿孔素-裂解酶(holin-lysin)系统来裂解细菌,穿孔素参与宿主细胞裂解的触发过程,穿孔素和裂解酶两者协同作用于细胞壁并裂解细菌[49]。在这些噬菌体基因组中,穿孔素基因通常位于裂解酶基因的上游,其编码蛋白含有跨膜区[50]。通过基因组测序发现,噬菌体PSM6基因组中存在各两个裂解酶和穿孔素基因,其中穿孔素GENE10正位于裂解酶GENE17基因的临近上游。Interpro在线程序分析发现穿孔素GENE10也拥有跨膜区。但也有一些噬菌体的穿孔素基因不在裂解酶基因上游[51],PSM6的另外一个穿孔素GENE47的基因就并不临近裂解酶基因。目前除了噬菌体本身,噬菌体产生的裂解酶也正趋于成为噬菌体应用于细菌感染治疗的一种有价值的形式[52]。但目前有关噬菌体裂解酶及其作用机制和结构的研究还不够丰富,比如与本研究噬菌体PSM6裂解酶序列相似性较高的这些裂解酶就还未得到特定研究。因此,未来需要加强这方面的深入研究。
随着沙门氏菌感染病例频发和细菌耐药问题的日益加重,噬菌体作为一种新型抗菌剂受到了越来越广泛的关注[17]。烈性噬菌体在致病菌的生物防治中具有独特的优势,如自然界中广泛存在、可自我繁殖、环境友好等[37,53]。本研究从环境样品中分离出一株具有较宽裂解谱的沙门氏菌噬菌体,它拥有潜伏期短、爆发量大、pH和温度稳定性佳的优点,基因组中也没有发现毒力因子相关基因和抗生素抗性基因,因此具有较好的应用于生物防治沙门氏菌的潜力。
4 结论
本研究分离并鉴定了一株新的肌尾噬菌体科沙门氏菌裂性噬菌体PSM6,可裂解鼠伤寒、彻斯特、伦敦、科瓦利斯、德尔卑等多种血清型沙门氏菌、部分大肠杆菌和宋内志贺氏菌,繁殖活性强,pH稳定良好,较耐高温。PSM6基因组含有裂解细菌的holin-lysin系统,未发现毒力因子相关基因和抗生素抗性基因。

