白芍多糖提取工艺优化、分子特性分析及其对巨噬细胞的增殖作用
曹荣安,张承泰,季瑞雪,张佳苗,贾 建,牛广财,王长远,李兴革,
(1.黑龙江八一农垦大学食品学院,黑龙江大庆163319;2.黑龙江省农产品加工工程技术研究中心,黑龙江大庆163319)
白芍(Radix Paeoniae Alba)是毛茛科植物芍药的干燥根,其敛阴收汗、养血调经、柔肝止痛的功效在《伤寒论》等药学著作中均有记载[1],此外,白芍还具有抗炎、抗抑郁及神经保护等功能[2−4]。白芍作为中医临床中的常见药物,伴随着科学和技术的发展,关于其有效成分的研究日益增多。白芍多糖是白芍中重要的活性成分之一,考虑到价格、毒害及操作安全性等方面,白芍多糖现行的提取工艺仍以传统的水提醇沉法为主,所以,此提取工艺的进一步优化是十分有必要的。而多糖作为一种广泛存在于动植物体及微生物中的高分子碳水化合物,能够参加生命体中的各项细胞活动。现代医学研究表明,多糖普遍具有抗炎、抗癌、抗肿瘤、抗氧化和降血糖等药理作用[4−7]。目前已有部分多糖被应用于临床医学当中,如香菇多糖已被应用于肺癌的辅助治疗及抗肿瘤治疗当中,黄芪多糖也已被应用于抗肿瘤治疗[8−10]。
目前,关于白芍多糖生物活性的现有文献报道大多集中在美白、抗氧化、抗抑郁等活性方面[11−13],为了未来能够将白芍多糖成功应用于保健食品及临床医药当中,其分子特性、免疫活性和抗癌活性等还需要进一步的研究。因此,本文对白芍多糖的分子特性和激活巨噬细胞能力进行研究,以期为白芍多糖后续的深入开发应用提供理论依据。
1 材料与方法
1.1 材料与仪器
白芍 购自大庆福瑞邦药房连锁有限公司,产地为四川省峨眉山;蛋白质定量试剂盒 美国Bio-Rad公司;WST-1试剂盒 碧云天生物制剂研究所;单糖标准品、牛血清蛋白、葡萄糖醛酸 美国Sigma-Aldrich公司;RAW264.7细胞 美国模式培养物集存库(ATCC);无水乙醇、丙酮 辽宁泉瑞股份有限公司,分析纯。
3802UV/VZS分光光度计 美国Unico公司;TSK Gel色谱柱 日本Tosoh公司;2487紫外检测器、2414示差折光检测器 美国Waters公司;DAWN HELEOS多角度激光光散射检测器 美国Wyatt公司;6890N/MSD5973气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪
美国Agilent公司;Excella ECO-170细胞培养箱
英国New Brunswick Scientific公司。
1.2 实验方法
1.2.1 白芍多糖的提取工艺 采用水提醇沉法提取白芍多糖:挑选除杂的白芍原料烘干粉碎,70 ℃下用85%乙醇回流搅拌2 h,冷却至室温后继续搅拌12 h,离心去上清液,残渣分别加入85%乙醇和无水丙酮搅拌,使用3000 r/min的转速离心5 min后,取沉淀自然干燥,得脱脂白芍原料。用蒸馏水对脱脂白芍原料进行加热回流搅拌两次,合并上清液并浓缩后加入无水乙醇,使最终溶液的乙醇体积分数为80%,4 ℃静置12 h。离心(3000 r/min, 5 min)后收集沉淀,用无水乙醇和丙酮洗涤沉淀,自然干燥得白芍多糖。称重后按照公式计算白芍多糖得率,计算公式:多糖得率(%)=(提取得到的白芍多糖质量/脱脂原料质量)×100。
1.2.2 白芍多糖的提取参数优化 本研究以白芍多糖得率为指标,分析液料比、提取温度和提取时间三个因素对白芍多糖得率的影响,对应的各因素水平参数 如 下:液 料 比 为10:1、15:1、20:1、25:1、30:1(mL/g)时,对应的提取温度和提取时间分别为80 ℃和2 h。提取温度为75、80、85、90、95 ℃时,对应的液料比和提取时间分别为10:1 mL/g和2 h。提取时间为1.5、2.0、2.5、3.0、3.5 h时,对应的液料比和提取温度分别为10:1 mL/g和80 ℃。根据单因素结果进行正交试验,从而确定白芍多糖的最佳提取工艺参数。
1.2.3 白芍多糖的化学成分分析 分析白芍多糖的化学组成,采用苯酚-硫酸法[14]测定总糖含量,福林-酚法[15]测定蛋白质含量,氯化钡-明胶浑浊法[16]测定硫酸根含量,间羟基联苯法[17]测定糖醛酸含量。
1.2.4 白芍多糖的相对分子质量测定 将白芍多糖水溶液膜过滤后注入高效尺寸排阻色谱-紫外检测器-多角度激光光散射仪-示差折光检测器联机系统(HPSEC-UV-MALLS-RI),并设置测定参数如下:采用添加了0.02%NaN3、浓度为0.15 mol/L的NaNO3溶液作为流动相,流速为0.4 mL/min,UV的检测波长设定为280 nm,检测结果采用ASTRA 6.1软件进行结果分析[15],计算公式为:
其中,N为阿伏伽德罗数(6.02×1023/mol),旋转比体积(SVg)、重均分子量(Mw)、回转半径(Rg)的单位分别为cm3/g、g/mol、nm。
1.2.5 白芍多糖的单糖组成和链接方式分析 采用作者适当改动后的Ciucanu等[18]的方法,对白芍多糖进行相应衍生化处理后,通过GC-MS检测得到单糖[15]及其链接方式[19]的相应气谱出峰时间和质谱离子峰,将其与单糖标准品和不同链接方式的多糖分别进行比较分析,得到白芍多糖的单糖组成和链接方式。
1.2.6 白芍多糖对巨噬细胞增殖率的影响 本研究采用WST-1细胞增殖及细胞毒性检测试剂盒测定白芍多糖对小鼠巨噬细胞RAW264.7增殖的影响。向96孔平板中加入细胞浓度为1×106cells/mL的RAW264.7细胞,于37 ℃、5% CO2的培养箱中培养24 h。弃去上清液,空白组添加培养液,试验组中分别加入2、5、10 μg/mL的白芍多糖溶液,继续培养24 h。弃去上清液,每孔加入体积分数10% WST-1溶液后再培养1 h,用酶标仪测定吸光度(450 nm),公式计算细胞增殖率。细胞增殖率(%)=(试验组的吸光度值/空白组的吸光度值)×100。
1.3 数据分析
以上实验重复三次,数据采用M±SD表示,使用Sigmaplot 12.0作图。应用SAS 8.2软件对数据进行统计分析,各实验组之间的显著性差异分析采用单因素方差分析(one-way ANOVA)和邓肯氏复极差法。
2 结果与分析
2.1 白芍多糖提取工艺优化
2.1.1 单因素实验结果 液料比、提取温度和提取时间是白芍多糖得率的重要影响因素,各项单因素实验结果见图1。在液料比单因素实验中,白芍多糖得率随液料比的增加呈现先升高后降低的趋势,当液料比为25:1 mL/g时多糖得率达到最大值(10.18%),当液料比为30:1 mL/g时,白芍多糖得率大幅减少。分析其原因在于,适当增大浸提溶剂体积可以促进多糖的溶出,但过量的溶剂存在则会影响整个体系的传热和传质,导致多糖得率降低[20]。而在提取温度单因素实验中,80~85 ℃区间范围内的白芍多糖得率升高,85 ℃时多糖得率达到峰值,可能是由于高温使多糖中的部分糖苷键被破坏,使得多糖发生降解,从而造成白芍多糖得率减少。随着提取时间的增加白芍多糖得率呈现出先增加后降低的趋势,提取时间3.0 h时白芍多糖得率最高,为9.86%。因此,最终选定用于正交试验的各因素水平分别为:液料比20:1、25:1、30:1(mL/g),提取温度80、85、90 ℃,提取时间2.5、3.0、3.5 h。
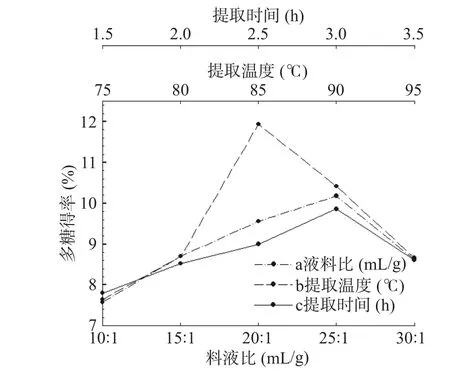
图1 不同因素水平对白芍多糖得率的影响Fig.1 Effect of different factors on the extraction rate of the polysaccharides from Radix Paeoniae Alba
2.1.2 正交试验结果 根据单因素结果确定的液料比(A)、提取温度(B)、提取时间(C)水平,进行正交试验,正交试验安排和结果见表1。以多糖得率为指标,直观分析各因素对多糖得率的影响顺序为:B>A>C,最佳工艺参数为A2B2C2,即液料比为25:1 mL/g,提取温度85 ℃,提取时间3.0 h,经验证此时白芍多糖的得率为12.40%±0.04%。实验得到的白芍多糖最高提取率的值与麦韵炫[21]的实验结果相近(12.65%),该实验虽然也是使用水提醇沉法对白芍多糖进行提取,但是其获得最高得率时的提取工艺在液料比为15:1 (V/V)的情况下沸水浸提2 h,重复提取三次并收集药渣润洗液,这与本方法有所不同,而且多糖得率也同原料来源和前处理方式有关。
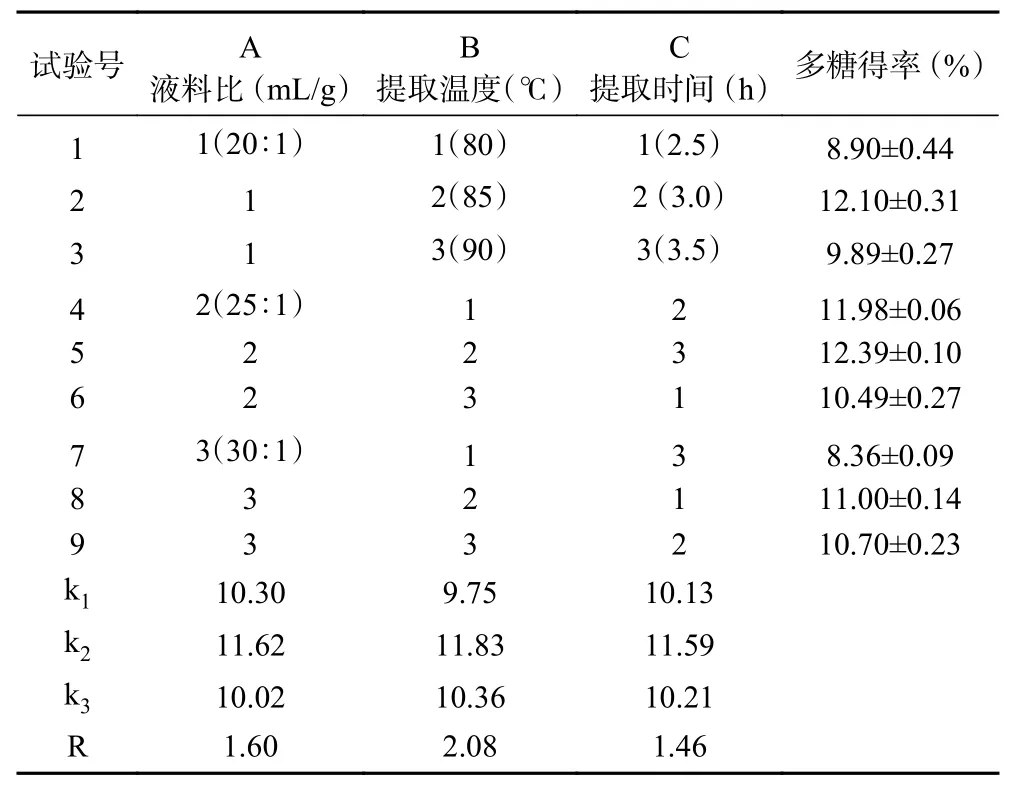
表1 正交试验安排和结果Table 1 The plan and results of the orthogonal experiment
2.2 白芍多糖的化学成分和单糖组成
白芍多糖的化学成分组成结果见表2。白芍多糖主要由96.2%±1.2%总糖和5.5%±0.6%蛋白质组成,未检出硫酸根和糖醛酸,有文献报道白芍多糖中含有糖醛酸(3.3%)[22]。糖醛酸检测结果出现差别的原因可能有两方面,首先是白芍多糖的提取方法存在明显差异,其次可能与原料产地不同有关。
采用GC-MS对白芍多糖的单糖组成进行分析,结果见表2。发现白芍多糖中主要的单糖为葡萄糖(96.8%±0.8%),还含有少量的阿拉伯糖(2.4%±0.1%),而半乳糖、鼠李糖、木糖和甘露糖的含量较低。汪芸等报道称白芍多糖由六种单糖(葡萄糖、鼠李糖、甘露糖、阿拉伯糖、半乳糖、木糖)组成,其中主要的单糖为葡萄糖[22]。相似的是,在秦亚东等人对白芍多糖单糖组成的研究中,提取得到的几种白芍多糖中葡萄糖的摩尔比均超过92.0%,同时还含有少量的鼠李糖、甘露糖、阿拉伯糖、半乳糖和木糖[23]。虽然单糖组成分析结果在各种单糖的含量上存在着细微区别,但是从白芍多糖的单糖组成成分和单糖比例角度分析,这些报道的结果与本文检测结果是一致的。

表2 白芍多糖的化学成分和单糖组成Table 2 Chemical and monosaccharide compositions of the polysaccharide from Radix Paeoniae Alba
2.3 白芍多糖的相对分子质量
白芍多糖的示差折光检测曲线和紫外色谱图见图2。白芍多糖在RI检测曲线上出现了一个单一吸收峰,同时在UV检测曲线上也存在一个明显的蛋白吸收峰,证明白芍多糖样品中含有一定含量的蛋白质,这与前面化学组成分析是相一致的。相对分子质量及支化度不仅是鉴定多糖结构时的重要数据支撑,还是影响多糖生物活性的两个重要因素。利用ASTRA 6.1软件进行分析计算后得到白芍多糖的分子质量(Mw)为2.3×106u和回转半径(Rg)为234.9 nm。
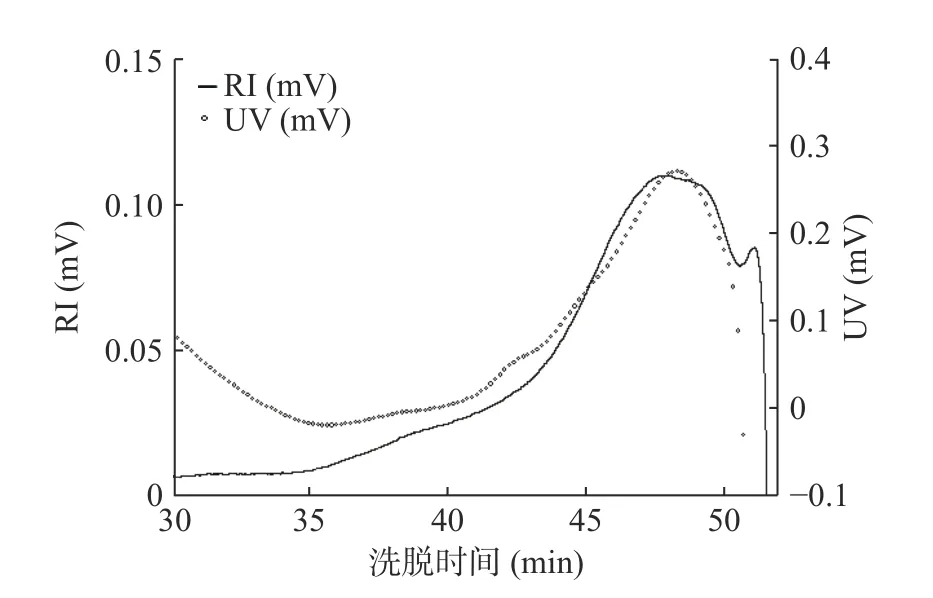
图2 白芍多糖示差折光检测曲线和紫外色谱图Fig.2 RI and UV chromatograms of the polysaccharide from Radix Paeoniae Alba
2.4 白芍多糖的链接方式
白芍多糖经衍生化处理后得到的部分甲基化糖醇乙酸酯衍生物的总离子流色谱图和三个主峰质谱图见图3,检测得到的6个碎片离子峰的质谱图与标准质谱NIST库比对分析结果见表3。相对峰面积最大的残基(峰2)对应的是2,3,6-tri-O-甲基吡喃葡萄糖醇乙酸酯(87.0%±2.5%),峰1对应的是2,3,4,6-tetra-O-甲基吡喃葡萄糖醇乙酸酯(6.8%±0.8%),峰6对应的是2-mono-O-甲基吡喃阿拉伯糖醇乙酸(3.7%±0.6%),由此说明白芍多糖是以(1→4)葡萄糖为主链。在甲基化分析结果中,除葡萄糖外只检测到了少量的阿拉伯糖以(1→3,4)阿拉伯糖连接方式存在。
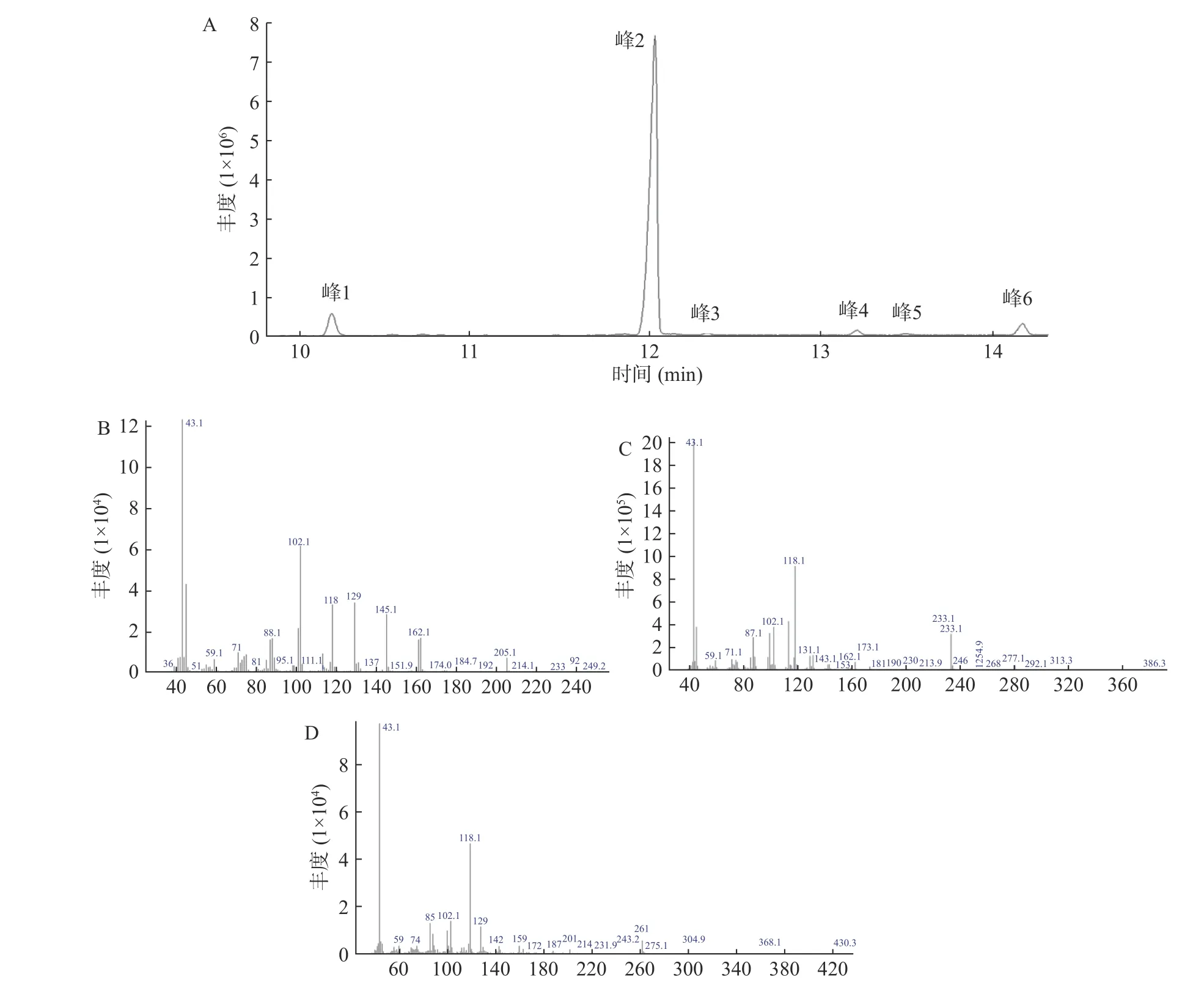
图3 白芍多糖部分甲基化糖醇乙酸酯衍生物的总离子流色谱图和质谱图Fig.3 Total ion current chromatograms and mass spectra of partially methylated alditol acetates derivatives of the polysaccharides from Radix Paeoniae Alba

表3 白芍多糖的甲基化分析结果Table 3 Methylation analysis of the polysaccharide from Radix Paeoniae Alba
2.5 白芍多糖对巨噬细胞增殖率的影响
白芍多糖对小鼠巨噬细胞RAW264.7增殖活性的影响见图4。随着白芍多糖浓度增加,巨噬细胞的增殖率呈上升趋势,而且具有一定的浓度依赖性。白芍多糖浓度2 μg/mL与5 μg/mL处理导致的巨噬细胞增殖率无显著差异(P>0.05),白芍多糖浓度为10 μg/mL时的细胞增殖率与两个低浓度处理的细胞增殖率存在显著性差异(P<0.05),结果表明白芍多糖在一定浓度范围内能够促进巨噬细胞增殖。由于多糖普遍对巨噬细胞有免疫调节作用,结合现有数据可知,白芍多糖存在潜在的免疫调节能力,因此有必要开展对白芍多糖免疫活性的研究。有研究发现白芍多糖具有抗糖尿病的作用,并且其能够有效抑制路易斯肺癌细胞和S180细胞瘤的生长[24−25]。目前,众多研究表明,调控糖尿病和癌细胞凋亡的信号通路都与免疫系统和免疫因子有着密不可分的关系,已发表的文献中白芍多糖对糖尿病和癌细胞发挥作用的调控机制是否与其可以促进免疫细胞增殖有关十分值得探究。因此,本论文有望为后续有关于白芍多糖发挥其生物活性的作用机制以及分子结构对其生物活性的影响的研究奠定理论基础。

图4 白芍多糖对小鼠巨噬细胞增殖的影响Fig.4 Effect of the polysaccharides from Radix Paeoniae Alba on the proliferation of RAW264.7 cells
3 结论
研究发现,在液料比为25:1 mL/g、提取温度为85 ℃、提取时间为3.0 h的提取条件下时,白芍多糖的提取率最高,达12.40%。提取得到的白芍多糖是一种糖含量高达96.2%的中性均一多糖,含有少量的蛋白质。其主要的单糖组成成分为鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖。体外细胞实验证明,白芍多糖能够有效地促进小鼠巨噬细胞RAW264.7的增殖。因此,该结果可以为白芍多糖作为一种新型的天然免疫调节剂应用于食品和医药行业提供技术支持和理论依据。

