褪黑素通过PPARγ-LXRα调控THP-1巨噬细胞ABCA1表达
王 雨 陈连凤 王 伟 宋 玮 严晓伟
褪黑素(melatonin)是脊椎动物的松果体合成的一种吲哚类激素,对机体胆固醇代谢具有调节作用[1]。胆固醇外流是将细胞内游离胆固醇(free cholesterol,FC)等转运到胞外HDL颗粒的过程,是胆固醇逆转运的第一步,也是机体调控动脉粥样硬化(atherosclerosis)发生、发展的关键步骤[2]。其中,三磷酸腺苷结合盒转运子A1(ATP-binding cassette transporter A1,ABCA1)在此过程中起重要作用[3]。研究发现,褪黑素缺乏可导致大鼠巨噬细胞ABCA1介导的胆固醇外流功能降低,并导致ABCA1受体表达下降,但机制尚不明确[4]。笔者通过THP-1来源巨噬细胞体外培养,并用褪黑素溶液及相应受体拮抗剂干预巨噬细胞,探讨褪黑素调控巨噬细胞ABCA1表达的作用机制。
材料与方法
1.主要试剂:褪黑素干粉购自美国Sigma 公司。THP-1细胞购自北京中国医学科学院基础医学研究所细胞中心。RPMI-1640培养基购自英国Gibco-BRL公司。胎牛血清(fetal bovine serum,FBS)、牛血清白蛋白(bovineserum albumin,BSA)购自美国Hyclone公司。佛波醇肉豆蔻酸乙酸酯(phorbol 12-myristate 13-acetate,PMA)购自美国Sigma 公司。Trizol、总RNA 抽提试剂盒、cDNA合成试剂盒购自大连宝生物有限公司。ABCA1、LXRα和GAPDH引物购自上海生工生物工程股份有限公司。全蛋白提取试剂盒购自北京普利莱生物技术公司。兔抗人ABCA1 多克隆抗体、兔抗人LXRα多克隆抗体、兔抗人GAPDH 多克隆抗体购自英国Abcam公司。HRP 标记山羊抗兔IgG二抗购自北京中杉金桥生物技术有限公司。PPARγ抑制剂GW9662、非选择性MT1/MT2受体拮抗剂Luzindole、选择性MT2受体拮抗剂K185购自美国Sigma公司。LXRα抑制剂GSK2033购自美国Glaxo Smith Kline公司。
2.THP-1细胞的培养和巨噬细胞的分化:THP-1细胞在RPMI-1640培养基和10%胎牛血清中培养,37℃、5%CO2-95%空气的恒温培养箱中。THP-1细胞生长至对数期时接种于6孔板,在培养液中加入终浓度为100nmol/L的PMA诱导THP-1细胞向巨噬细胞分化24h。通过倒置显微镜观察细胞形态变化,流式细胞术检测细胞表面特异性抗原CD14表达量的变化,鉴定THP-1细胞是否分化为巨噬细胞。
3.不同浓度褪黑素溶液对THP-1来源巨噬细胞ABCA1和LXRα的mRNA及蛋白表达的作用:将THP-1巨噬细胞分为对照组(阴性对照组)和褪黑素干预组。其中褪黑素干预组根据浓度又分为:50nmol/L浓度褪黑素干预组(褪黑素50nmol/L组)、100nmol/L浓度褪黑素干预组(褪黑素100nmol/L组)、500nmol/L浓度褪黑素干预组(褪黑素500nmol/L组)、1μmol/L浓度褪黑素干预组(褪黑素1μmol/L组)。对照组给予不含褪黑素的RPMI-1640培养基预处理24h,而褪黑素干预组分别给予50nmol/L、100nmol/L、500nmol/L和1μmol/L的褪黑素溶液预处理24h。
实时荧光定量PCR检测:提取各组THP-1来源巨噬细胞的总RNA,反转录得到cDNA。PCR引物用Primer 5.0软件设计:ABCA1 基因上游引物: 5′-TACAGCCAGAAAGACACCAG-3′,下游引物:5′-CACAGTAGACTTTGGGAGAG-3′。LXRα基因上游引物:5′-TCAGCCGGGAGGACCAGATTG-3′,下游引物:5′-TCCGGAGGCTCACCAGTTTCATTA-3′。内参基因GAPDH上游引物:5′-CTCTGCTCCTCCTGTTCGAC-3′,下游引物:5′-ACGACCAAATCCGTTGACTC-3′。实时荧光定量PCR实验在ABI7500 RT-PCR仪上进行,通过各孔样品的Ct值计算样品mRNA相对内参基因GAPDH的表达量。
蛋白免疫印迹实验(Western blot)法分析:提取各组THP-1来源巨噬细胞胞质蛋白,BCA蛋白定量后取50μg样品进行SDS-PAGE凝胶电泳分离和转膜,用含5%脱脂牛奶溶液室温封闭60min,分别加入ABCA1、LXRα和GAPDH的一抗(稀释比1∶500~1∶800),4℃孵育过夜。TBST洗膜15min×3次后,加入1∶2000稀释的相应二抗室温孵育60min。再次用TBST洗膜15min×3次,ECL发光试剂盒显色,X光片感光显影,用Image J软件分析各组ABCA1、LXRα和GAPDH的灰度值,将各组的ABCA1、LXRα分别与内参GAPDH的灰度值进行比值化处理,并比较各组ABCA1和LXRα蛋白的相对表达量。
4.褪黑素调控THP-1来源巨噬细胞ABCA1表达的信号调控机制:通过上述浓度梯度实验获得的结果,后续实验均采用浓度为1μmol/L的褪黑素溶液进行。
为明确褪黑素是否通过激活LXRα来调节ABCA1的表达,笔者应用了LXRα拮抗剂GSK2033和PPARγ拮抗剂GW9662 进行后续实验。THP -1来源巨噬细胞与10μmol/L的GSK2003(GSK组)或GW9662(GW组)溶液预孵育6h,然后与1μmol/L的褪黑素溶液干预24h。以未使用褪黑素的RPMI-1640培养基处理的细胞作为阴性对照(对照组),以仅使用1μmol/L褪黑素处理的细胞作为阳性对照(褪黑素组)。24h后弃去干预溶液,然后收集细胞,进行蛋白质印迹(Western blot)法分析ABCA1和LXRα的蛋白表达情况。
为明确褪黑素是否通过褪黑素膜受体1型(MT1)或2型(MT2)介导的途径调节ABCA1的表达,笔者使用了两种拮抗剂:①非选择性MT1/MT2拮抗剂luzindole (LUZ);②选择性MT2拮抗剂K185。THP-1来源巨噬细胞用10μmol/L LUZ(LUZ组)或K185(K185组)预孵育6h,然后用1μmol/L褪黑素处理24h,以未使用褪黑素的RPMI-1640培养基处理的细胞作为阴性对照(对照组),以仅使用1μmol/L褪黑素处理的细胞作为阳性对照(褪黑素组)。24h后弃去干预溶液,然后收集细胞,进行Western blot法分析ABCA1蛋白表达情况。
结 果
1.不同浓度褪黑素溶液对THP-1来源巨噬细胞ABCA1和LXRα的mRNA及蛋白表达的作用:与对照组比较,随着褪黑素浓度的增加,巨噬细胞ABCA1 mRNA和蛋白表达均显著升高,且呈剂量依赖性(P<0.05,图1A、图2中A和C)。与对照组比较,褪黑素干预组LXRα mRNA和蛋白水平显著升高,且呈剂量依赖性(P<0.05,图1B及图2中B、D)。
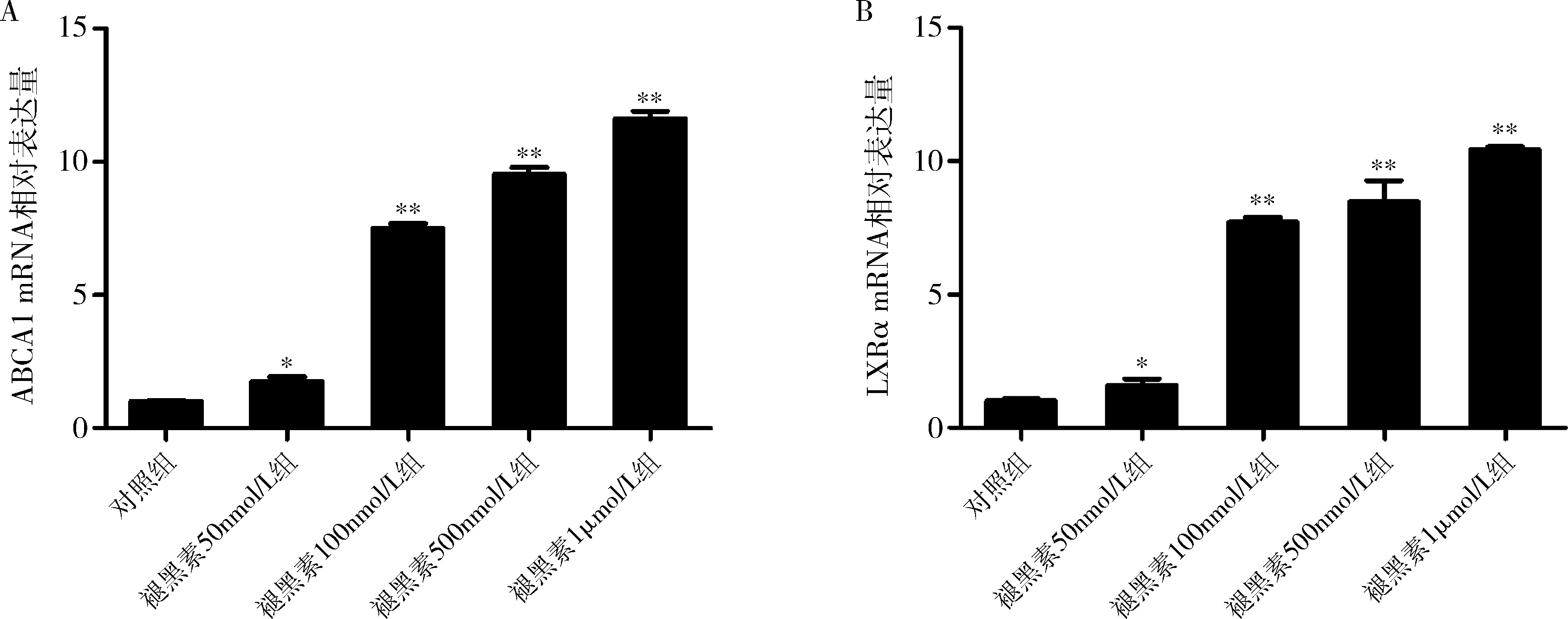
图1 不同浓度褪黑素溶液干预体外培养THP-1来源巨噬细胞后ABCA1及LXRα mRNA相对表达量A.巨噬细胞ABCA1 mRNA相对表达量;B.巨噬细胞LXRα mRNA相对表达量;与对照组比较,*P<0.05,**P<0.01
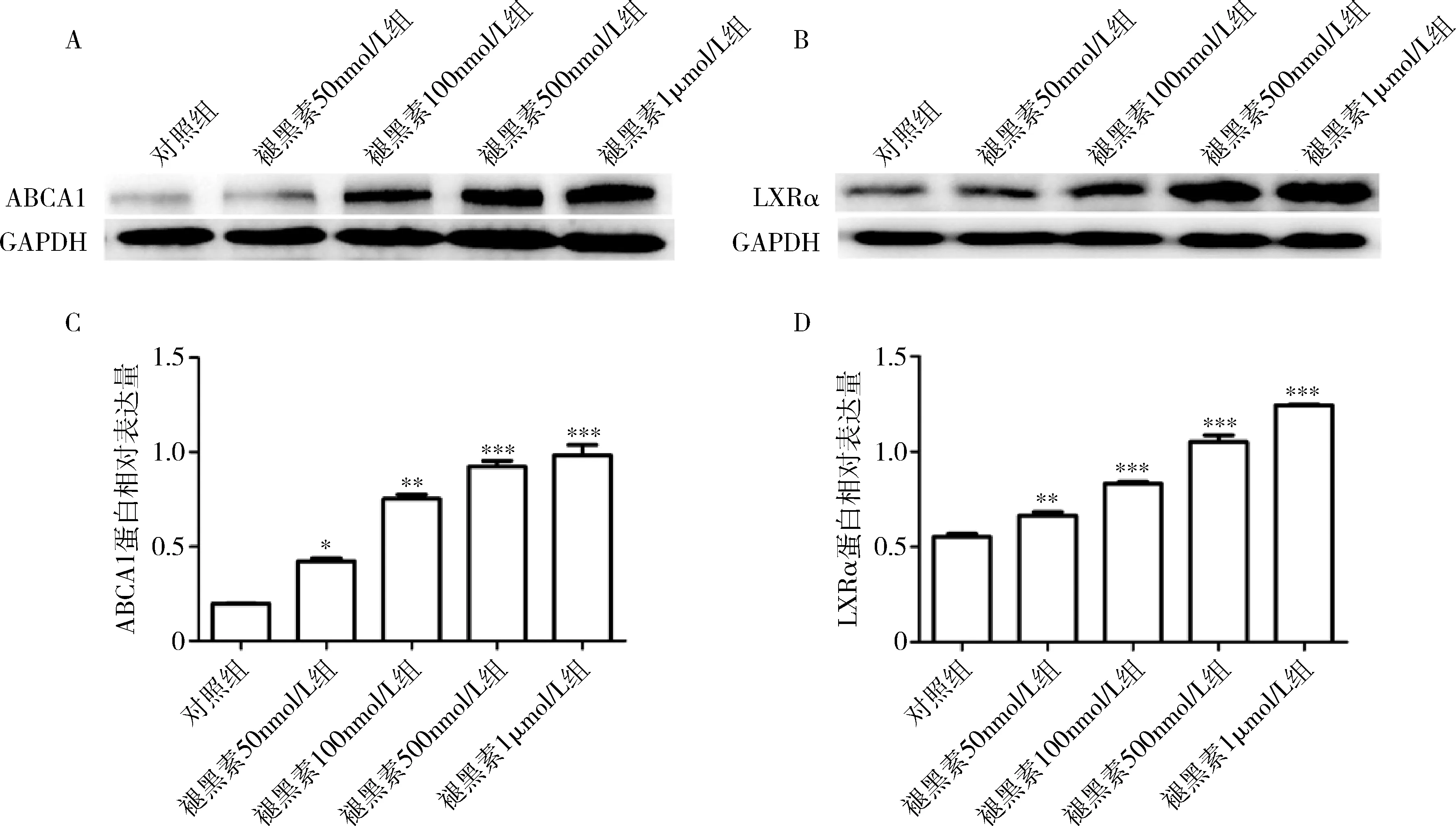
图2 不同浓度褪黑素溶液干预体外培养THP-1来源巨噬细胞后ABCA1及LXRα蛋白表达A.ABCA1蛋白Western blot法条带图;B.LXRα蛋白Western blot法条带图;C.ABCA1蛋白相对表达量柱形图;D.LXRα蛋白相对表达量柱形图;与对照组比较,*P<0.05,**P<0.01,***P=0.000
2.GSK2033或GW9662对经褪黑素处理的THP-1来源巨噬细胞ABCA1和LXRα蛋白表达的影响:与对照组比较,褪黑素组的ABCA1蛋白表达水平显著升高(P=0.000,图3中A和C)。然而,GSK组的ABCA1蛋白表达水平显著低于褪黑素组(P=0.000,图3中A和C)。与上述结果类似,GW组对ABCA1表达相对褪黑素组存在显著的抑制作用(P=0.000,图3中A和C)。与对照组比较,褪黑素组的LXRα蛋白表达水平显著升高(P=0.000,图3中B和D)。然而,与褪黑素组比较,GSK组的LXRα蛋白表达保持不变(图3中B和D)。GW组的LXRα蛋白表达相比褪黑素组显著下降(P=0.000,图3中B和D)。
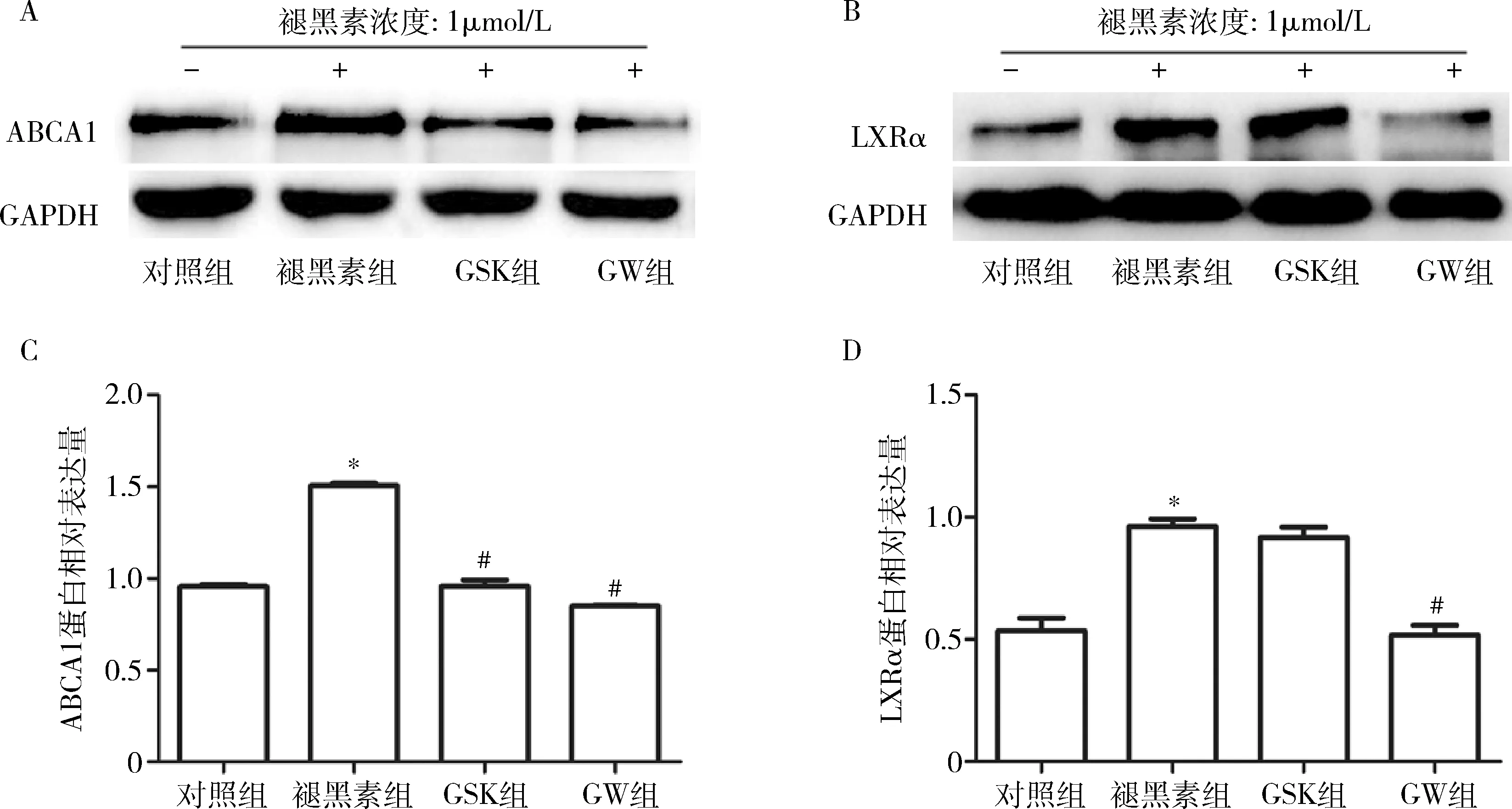
图3 经褪黑素处理和GSK2033或GW9662预处理的THP-1来源巨噬细胞ABCA1和LXRα的蛋白表达A.ABCA1蛋白Western blot法条带图;B.LXRα蛋白Western blot法条带图;C.ABCA1蛋白相对表达量柱形图;D.LXRα蛋白相对表达量柱形图;与对照组比较,*P=0.000;与褪黑素组比较,#P=0.000
3.LUZ或K185对经褪黑素处理的THP -1来源巨噬细胞ABCA1蛋白表达的影响:与对照组比较,褪黑素组的ABCA1蛋白表达水平显著升高(P=0.000,图4)。然而,与褪黑素组比较,LUZ组或K185组中褪黑素上调的ABCA1蛋白表达均未被抑制(图4)。
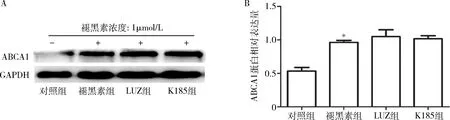
图4 经褪黑素处理和LUZ或 K185预处理的THP-1来源巨噬细胞ABCA1和LXRα的蛋白表达A.ABCA1蛋白Western blot法条带图;B.ABCA1蛋白相对表达量柱形图;与对照组比较,*P=0.000
讨 论
ABCA1在预防动脉粥样硬化疾病的发生中发挥重要作用[5]。Matsunaga等[6]早期研究发现,人类ABCA1表达缺陷可导致Tangier病,其特征是患者血浆高密度脂蛋白胆固醇水平大幅降低,其胆固醇外排功能受损,细胞内胆固醇酯积聚。因此,Tangier病患者往往比正常人更早发生冠状动脉性心脏病和外周动脉粥样硬化性疾病[7]。而上调ABCA1的表达及其胆固醇外排功能均能发挥抗动脉粥样硬化作用[8]。为明确褪黑素对ABCA1 表达的直接影响作用,笔者用不同浓度的褪黑素体外干预THP-1 来源的巨噬细胞,发现褪黑素可同时上调ABCA1 转录和蛋白水平,表明一定药理剂量浓度的褪黑素可以直接影响ABCA1 的表达水平,尤其以1μmol/L浓度的褪黑素干预组最为显著。
研究表明,ABCA1的表达可能受到多种核转录因子的调控,包括肝X受体(LXR)、视黄素X受体(RXR)和过氧化物酶体增殖激活受体(PPAR),而PPAR被认为是LXR的上游转录调控因子[9~12]。其中,PPARγ-LXRα通路是目前研究最深入的调控ABCA1表达和功能的信号转导通路,其与动脉粥样硬化发生过程密切相关[13]。本研究结果表明,作为PPARγ拮抗剂,GW9662显著抑制了褪黑素对ABCA1和LXRα表达的促进作用,表明PPARγ参与了褪黑素对ABCA1促表达作用,并同时影响了LXRα的表达。这与之前报道的PPARγ对LXRα存在调控作用的结果一致[14]。而GSK2033 显著抵消了褪黑素上调ABCA1作用,但其并不影响LXRα 的蛋白表达。这一方面表明,LXRα拮抗剂可能对LXRα仅发挥功能性阻断作用;另一方面表明,LXRα 也参与了褪黑素对ABCA1 表达的调控。因此笔者推测褪黑素通过PPARγ-LXRα-ABCA1参与的途径调节巨噬细胞ABCA1的表达。
既往研究发现,褪黑素通过与其膜受体MT1和MT2或核受体相互作用,从而调节哺乳动物的一些生理功能[15]。而本研究结果表明,褪黑素膜受体MT1和MT2都不参与褪黑素诱导的ABCA1表达。Cecon等[16]研究认为,褪黑素作为亲脂性激素,可以进入细胞直接与核转录因子相互作用,而不经过细胞的膜受体。Zhang等[17]研究表明,褪黑素核受体与PPAR γ交互作用可能影响体外培养细胞的部分功能表达。因此笔者推测,褪黑素可能通过核受体而非膜受体参与调节ABCA1的表达。
综上所述,褪黑素可剂量依赖性的上调巨噬细胞ABCA1的表达,PPARγ-LXRα通路参与了褪黑素对ABCA1表达的调节作用,且该调节作用不依赖褪黑素膜受体。

