牛黄体细胞与卵泡颗粒细胞差异基因的筛选
孟金柱,吴震洋,安清明,赵园园
(铜仁学院,贵州 铜仁 554300)
雌性动物卵泡颗粒细胞(GCs)通过特异表达细胞色素P450芳构化酶(CYP19A1),将膜细胞(TCs)分泌的雄激素转化为雌激素(E2),从而促进优势卵泡发育成为排卵卵泡[1]。排卵卵泡在促黄体素(LH)峰的作用下发生破裂,卵丘-卵母细胞复合体得以释放,而卵泡壁上的GCs和TCs分别分化成为大黄体细胞(LLCs,直径大于25 μm)和小黄体细胞(SLCs,直径12~25 μm)[2]。在牛和羊卵巢上,LLCs和SLCs都可以分泌孕激素(P4),但LLCs由于对LH有一定的类固醇生成反应,因此其分泌P4的能力是SLCs的20倍[3-4]。
通过高通量测序技术对牛不同大小卵泡中GCs和TCs进行基因表达谱分析,发现GLDC、MGARP、GPX3、CHST8等细胞外基质基因是GCs的潜在标记物[5]。对不同品种的牛在不同温度应激下的卵母细胞和卵丘细胞进行高通量测序表明,不同牛品种的卵母细胞在组织和细胞死亡方面存在很大差异;在卵丘细胞中,品种和温度都会影响mRNA的丰度,涉及细胞组织和氧化应激[6]。目前,有文献报道了牛GCs和TCs在黄体生成素(LH)峰和卵泡内前列腺素峰出现时的短期变化[7],但从卵泡到黄体的转变机制尚不明晰。本研究通过筛选GEO数据库GSE83524 RNA-seq表达谱中LLCs和GCs之间的差异表达基因,应用生物信息学分析结合实时荧光定量PCR验证,为详述这2种细胞在卵巢生理学中的功能、深入研究细胞特异性及GCs细胞向LLCs的分化机制奠定基础。
1 材料与方法
1.1 试验材料在贵州省铜仁市万山区肉牛屠宰场选取10头健康思南黄牛,屠宰后摘除卵巢,迅速置于4℃灭菌杜氏磷酸缓冲液(DPBS)中并运回实验室。采集每头牛卵巢上的最大卵泡(直径8~10 mm),参照课题组前期研究方法筛选优势卵泡[8],用眼科剪刀将优势卵泡剪开,通过细胞刮刀刮取卵泡内壁上的颗粒细胞(GCs);使用淘洗法[9]从卵巢黄体中分离出黄体细胞,并通过500目细胞筛筛选其中的大黄体细胞(LLCs,直径>30 μm);-80℃ 冰箱中保存用于实时荧光定量PCR试验。
1.2 芯片数据在GEO数据库(www.ncbi.nlm.nih.gov/geo)筛选牛卵泡发育相关表达谱数据,并下载GSE83524 RNA-seq芯片数据,其中包含4头牛优势卵泡GCs样本和3头牛卵巢黄体 LLCs样本。
1.3 差异表达基因筛选及数据分析使用R软件limma包中的DESeq2来筛选牛优势卵泡GCs和卵巢黄体LLCs中的差异表达基因,其阈值设定为FPKM≥2,| log2(fold change) |≥2,校正后的P<0.01;通过DAVID软件对获得的差异表达基因进行GO功能富集分析和KEGG信号通路分析;使用String软件构建差异表达基因之间的蛋白互作网络(PPI);将互作数据导入Cytoscape软件对差异表达基因进行可视化分析,同时利用软件自带Cyto-Hubba插件的MCC算法筛选连通度最大的前10位的关键(Hub)基因。
1.4 总RNA提取、反转录及引物合成将存放于-80℃冰箱中的GCs和LLCs样品取出并解冻,分别加入1 mL TRIzol抽提总RNA。用NanoDrop 2000检测其浓度和纯度后,按照EasyScript®One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒反转录合成cDNA,合成体系20 μL:总RNA 4 μL;Anchored Oligo(dT) Primer 1 μL;2×ES Reaction Mix 10 μL;EasyScript RT/RI Enzyme Mix 1 μL;RNase free ddH2O 4 μL。反应条件设定:42℃ 15 min,85℃ 5 s。以GenBank中牛(Bostaurus)属各目的基因和RPLP0(内参基因)序列作为模板,在线NCBI软件设计引物(表1),送交上海生工生物工程股份有限公司合成。

表1 供试引物序列
1.5 实时荧光定量PCR实时荧光定量PCR扩增采用SYBR Green Ⅰ法建立20.0 μL PCR反应体系:cDNA模板 4.0 μL,上、下游引物各0.5 μL,SYBR Mix 10.0 μL,加ddH2O至20.0 μL。反应条件:94℃预变性30 s;94℃变性5 s,60℃退火15 s,72℃延伸10 s,40个循环。溶解曲线条件:94℃ 30 s,60℃ 30 s,72℃ 30 s。反应设置3个样本重复,4个技术重复,通过LightCycler 480平台运行。各目的基因的相对表达量采用2-ΔΔCt来计算,并使用SPSS17.0软件进行差异显著性分析。
2 结果
2.1 差异表达基因的筛选通过R软件limma包中的DESeq2分析后,在2种细胞中共获得242个差异表达基因,其中上调表达基因156个,下调表达基因86个(图1)。表2列出了10个差异倍数最高的基因及其功能(上、下调各5个)。
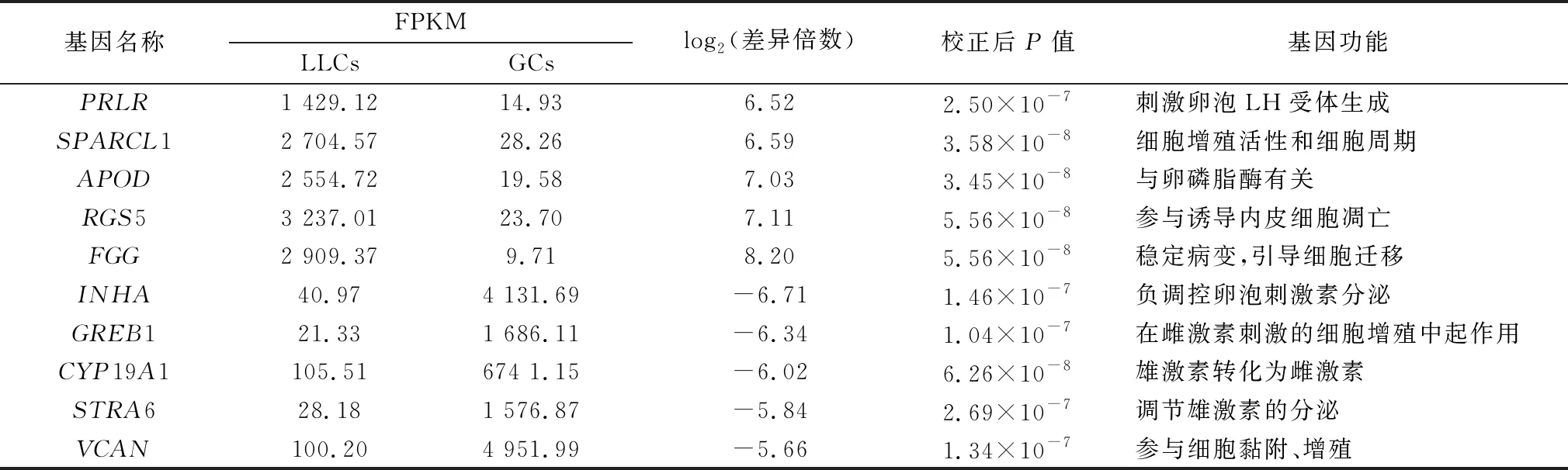
表2 牛卵巢LLCs与GCs中差异倍数最高的10个基因及其功能

图1 牛卵巢LLCs和GCs差异表达基因火山图
2.2 差异表达基因GO功能富集分析通过DAVID软件对242个差异表达基因进行GO功能富集分析显示,生物学过程(biological process)占46.97%,主要包括了血管生成、细胞黏附及细胞增殖调节;细胞组分(cellular component)占31.82%,主要富集在细胞质、细胞核及细胞外外泌体;分子功能(molecular function)占21.21%,主要参与了以下功能,即ATP结合、蛋白激酶活性和受体结合(图2)。
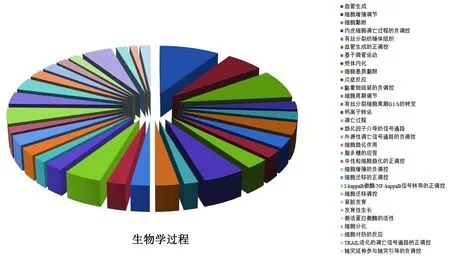
图2 牛卵巢LLCs与GCs差异表达基因GO分析
2.3 差异表达基因KEGG信号通路分析为了获得与卵泡GCs增殖和黄体化相关的信号通路,通过DAVID软件对所获得的差异表达基因进行KEGG信号通路分析,共发现16条通路(图3),在这些通路中,FoxO信号通路与GCs的增殖、卵泡的发育、闭锁和黄体化密切相关,共有7个基因在此通路中扮演了重要角色(图4)。

图3 牛卵巢LLCs与GCs差异表达基因KEGG通路分析

图4 FOXO信号通路
2.4 PPI网络互作分析通过String软件对242个差异表达基因进行PPI网络互作分析(图5),同时使用Cytoscape软件对得到的互作数据进行互作可视化分析,并通过其自带Cyto-Hubba插件的MCC算法筛选连通度最大的前10位的关键基因,分别是KIF11、KIF15、CENPE、ASPM、NCA-PG、MELK、TPX2、NDC80、ECT2、PBK(图6)。

图5 牛卵巢LLCs与GCs差异表达基因的PPI网络互作分析
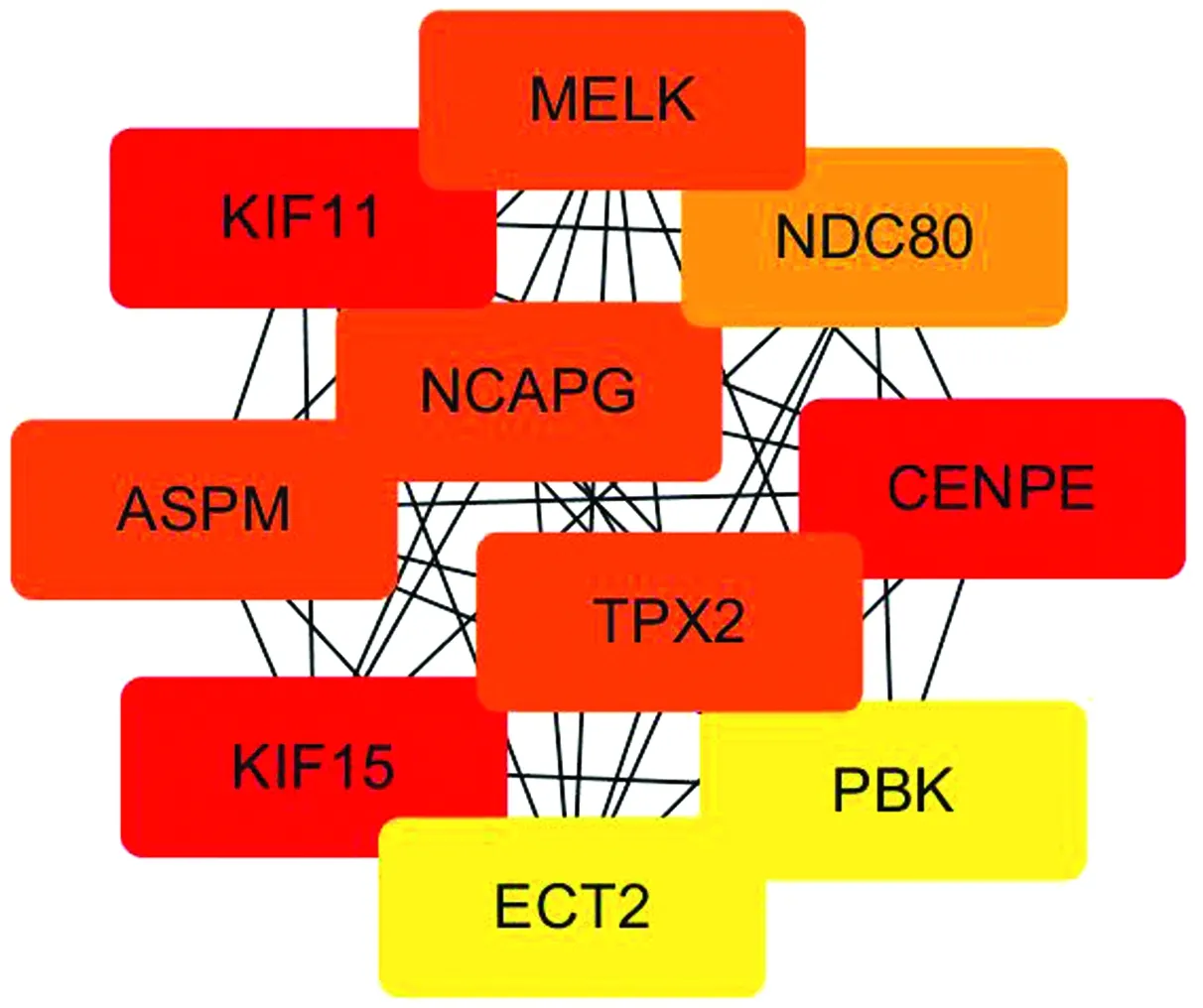
图6 牛卵巢LLCs与GCs中关键基因的PPI网络互作分析
2.5 实时荧光定量PCR验证分析通过功能筛选,选取与卵泡颗粒细胞黄体化相关的5个差异表达基因(PRLR、SPARCL1、INHA、GREB1、CYP-19A1)进行实时荧光定量PCR验证分析。结果显示,PRLR、SPARCL1、INHA、GREB1、CYP19A1在LLCs和GCs中的表达趋势与GEO芯片数据结果一致,且PRLR在LLCs中的表达量极显著地高于GCs(P<0.01),SPARCL1在LLCs中的表达量显著高于GCs(P<0.05);GREB1、CYP19A1在GCs中的表达量极显著地高于LLCs (P<0.01),INHA在GCs中的表达量显著高于LLCs(P<0.05)(图7)。
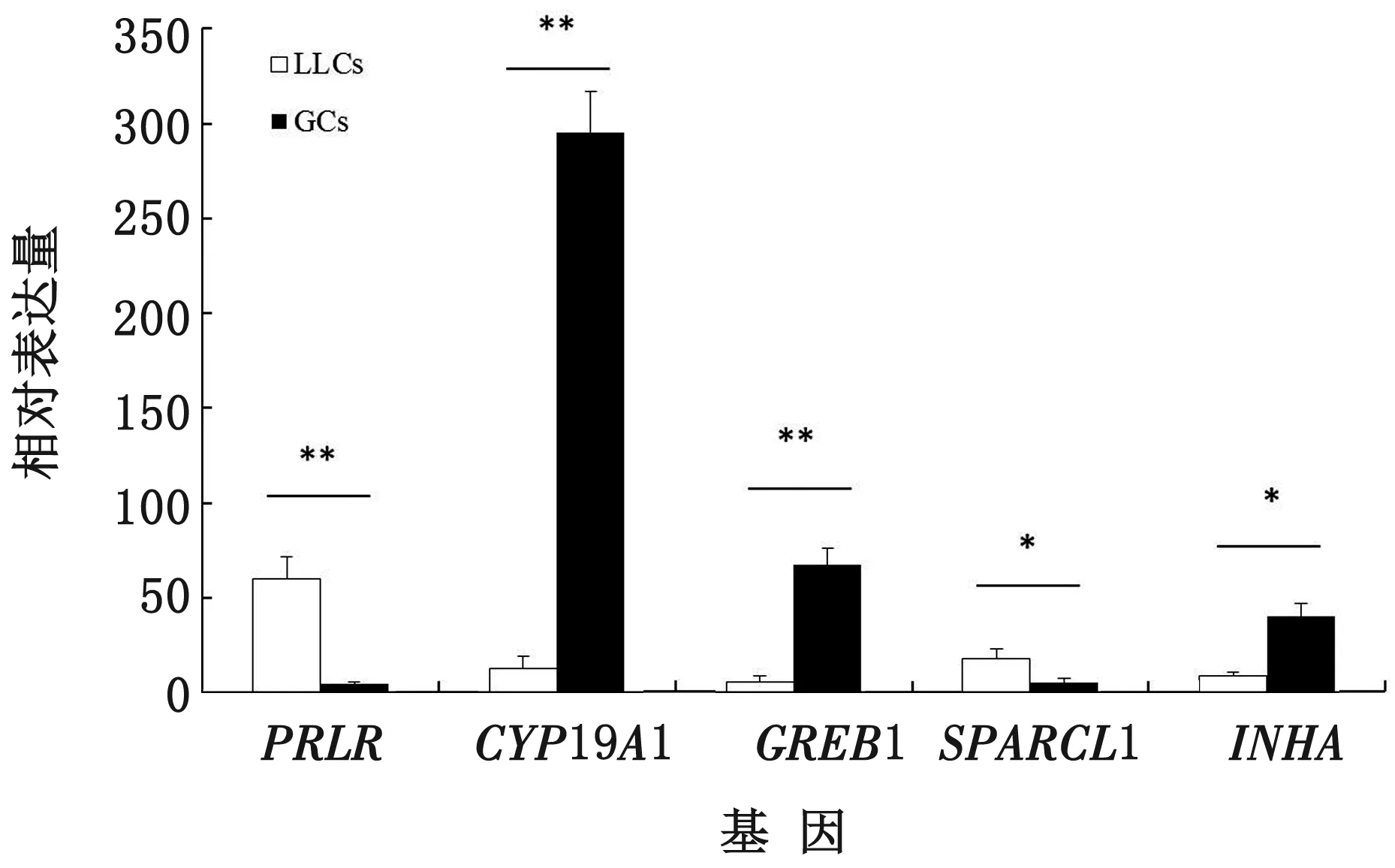
注:**和*分别表示在 P <0.01和 P <0.05水平上差异显著
3 讨论
雌性动物的卵巢是一个快速生长和周期性退化的动态组织[10]。在卵巢周期中,细胞增殖、分化和转化的重复模式发生在卵泡发育和黄体形成及退化的过程[11]。卵泡在排卵前,位于其内的GCs可以分泌一系列的激活素、抑制素和胰岛素样生长因子Ⅰ(IGF-Ⅰ),通过自分泌/旁分泌作用于卵巢,从而保持卵巢功能的动态性[12]。GCs合成的E2经血液循环到达垂体,促进垂体释放LH,LH又与GCs上的受体结合,最终通过缝隙连接传递到卵母细胞,促使卵母细胞减数分裂,排出第1极体,静止在第2次减数分裂的中期[13]。排卵后的卵泡转化为黄体,GCs分化为LLCs,其中大量前列腺素F2α受体(PTGFR)得以表达,抑制垂体分泌LH,导致排卵不能发生,如果排出的卵子不能正常受精,前列腺素F2α就会与LLCs中PTGFR结合触发黄体溶解、退化,卵泡的发育得以继续[14];相反,当卵母细胞的受精和着床成功时,母体对妊娠的认知导致黄体的维持,而黄体反过来又起着支持胚胎发育的作用[15]。
在E2作用下GCs产生更多的FSH受体和LH受体,导致芳香化酶活性增强,进一步促进E2的分泌,使卵泡迅速生长,在这个过程中CYP19A1起了关键作用[16]。E2对哺乳动物的卵泡发育及排卵至关重要,CYP19A1通过将来自TCs的雄激素转化为E2,敲除CYP19A1的小鼠则不能排卵[17]。本研究通过生物信息学分析并通过实时荧光定量PCR发现CYP19A1在GCs中的表达量极显著地高于LLCs(P<0.01),证实CYP19A1在GCs中发挥了重要作用。在妊娠绵羊体内通过释放干扰素T(IFNT)与子宫内膜中的受体结合,激活抗黄体溶解反应,使黄体持续产生P4来维持妊娠[18]。基于对子宫静脉血液中IFNT的检测,进一步证实IFNT通过诱导IFN刺激基因(ISGs)的表达对黄体起作用,例如IFN刺激基因15(ISG15)[19]。本研究通过对GEO数据库GSE83524 LLCs与GCs转录组数据进行分析,在2种细胞中获得242个差异表达基因,其中上调表达基因156个,下调表达基因86个。FoxO 信号通路在细胞凋亡、代谢、周期阻滞、分化、自噬及氧化应激等方面都起着关键作用[20]。在猪和牛等哺乳动物中,FoxO 通过负调控作用来抑制卵泡GCs的增殖[21]。本试验通过对获得的差异表达基因进行GO、KEGG信号通路及PPI网络互作分析,发现FoxO信号通路与GCs的增殖、卵泡的发育、闭锁和黄体化密切相关,共有7个基因在此通路中扮演了重要角色。实时荧光定量PCR验证结果显示,PRLR、SPARCL1、INHA、GREB1、CYP19A1在LLCs和GCs中的表达趋势与GEO芯片数据结果完全一致。
促乳素受体(PRLR)对反刍动物P4的分泌以及黄体的维持起着至关重要的作用[22]。由垂体分泌的PRL经血液循环直接作用于子宫内膜在动物妊娠过程中产生作用[23],且PRL还在动物排卵、着床及胎盘发育的过程中起促进作用[24],敲除小鼠卵泡中的PRL,使得卵母细胞释放延迟,成熟受损进而导致排卵减少[25]。本研究结果得出,PRLR在LLCs中的表达量极显著地高于GCs(P<0.01),也进一步验证了PRLR在黄体细胞中发挥了关键作用。研究表明,GREB1通过与染色质结合进而激活E2与其受体的结合,这种功能来源于其稳定E2受体与其他辅助因子之间的相互作用[26]。GREB1在E2受体介导的转录过程中也起着至关重要的作用[27]。SPARCL1通过抑制细胞从G1期进入到S期从而导致细胞凋亡[28]。研究发现,SPARCL1具有抗黏附作用,在肿瘤细胞的增殖过程中起抑制作用,而SPARCL1作为下调表达基因在卵巢上表达,能够诱导肿瘤细胞的凋亡[29]。
综上所述,本研究通过生物信息学方法筛选出了5个与卵泡GCs增殖和黄体化相关的差异表达基因,推测这些基因在牛卵巢中对GCs黄体化起了重要作用,为深入研究细胞特异性及GCs向LLCs的分化机制奠定基础。

