静电纺PU纳米纤维膜及其固定化酶的研究
张群华,范小平,刘媛,袁文波,周爱梅,王国庆,陈赣
(1.华南农业大学 食品学院,广东 广州 510642;2.吉安井冈农业生物科技有限公司,江西 吉安 343000)
柚苷酶(Naringinase)是一种由α-L-鼠李糖苷酶以及β-D-葡萄糖苷酶两种酶组合而成的复合酶[1],其不仅在柚柑类水果加工以及给食品增添香味中发挥作用,还可以用于生产抗生素、生物转化类固醇和皂苷等[2-3]。然而游离柚苷酶对周围环境敏感,在极端pH值、温度等因素的作用下容易失活。为解决这一问题,将游离酶固定在非溶性载体上来提高酶的稳定性和重复利用率成为了一种简便经济的方法[4]。
本研究选用生物相容性和机械性能俱佳的聚氨酯(PU)材料,采用电纺技术制备PU纳米纤维膜(PUNF),并用壳聚糖(CTS)对纤维膜表面进行亲水改性,引入功能性基团,有效固定柚苷酶,提高酶的负载量和增强酶的稳定性。
1 实验部分
1.1 试剂与仪器
聚氨酯(PU),工业塑料;柚苷酶制剂(酶活 10 000 U/g),食品级;丙酮(含量≥99.5%)、N,N-二甲基甲酰胺(DMF,含量≥99.5%)、柚皮苷(纯度≥99%)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC,含量≥98.5%)、N-羟基珀酰亚胺(NHS,含量≥98%)、壳聚糖(CTS,脱乙酰化≥95%)、氢氧化钠、乙酸、磷酸氢二钠、磷酸二氢钾均为分析纯;所用蒸馏水为一级水。
E02型静电纺丝机;BS1240S型电子天平;HJ-4A型数控恒温多头磁力搅拌器;KQ-100DE型数控超声波清洗机;Sdc-100接触角测量仪;Vertex 70型傅里叶变换红外光谱仪;Tescan Vega 3 S型扫描电镜;T6型新世纪紫外可见分光光度计。
1.2 酶膜的制备
1.2.1 PUNF制备 用电子天平称取12 g的PU颗粒,加入到体积比为67∶33的丙酮和DMF溶剂中[5],在室温下用磁力搅拌器隔夜搅拌12 h,至完全溶解,获得聚合物溶液。在室温条件下,用注射器吸取5 mL的纺丝液,置于纺丝机的注射泵上,调节接收距离为22 cm,设置纺丝电压为22 kV,注射的速率为0.5 mL/h,接收器滚轮转速为300 r/h,待接收装置上收集到一定厚度的PU膜,即停止纺丝。将膜放置到恒温干燥箱中,烘30~45 min,待溶剂完全挥发后密封保存。
1.2.2 PUNF活化 将PU膜剪切成4 cm×4 cm的膜,用滴管吸取磷酸缓冲液(PBS)冲洗膜的表面,去除膜的表面杂质。配制摩尔比为1∶2的EDC/NHS溶液,放入清洗过的PU纳米纤维膜,于25 ℃恒温水浴中反应2 h后拿出。
1.2.3 PUNF改性 活化的PU纳米纤维膜,用大量去离子水多次冲洗,除去膜表面附着的活化剂。配制一定浓度的CTS溶液(CTS用2%的乙酸溶解),将活化后的膜浸泡在CTS溶液中,在25 ℃水浴下振荡。以不同的CTS浓度为梯度,探究最佳改性参数。取出膜,用去离子水多次冲洗附着的CTS,将膜晾干,保存备用。
1.2.4 酶膜制备 准备洁净烧杯,电子天平精确称量一定质量的柚苷酶制剂放入其中,加入去离子水至溶解完全,于4 ℃下保存。量取30 mL柚苷酶溶液,将PU纳米纤维膜浸泡在其中,置于4 ℃下反应12 h。取出已固定柚苷酶的PU纳米纤维膜,用去离子水多次洗涤,保存好原酶液、固定化后酶液以及清洗液。将冲洗后的纤维膜晾干,并保存在4 ℃的环境下。
1.3 测试与表征
1.3.1 静电纺PU纳米纤维膜的表征 采用扫描电子显微镜对静电纺纳米纤维膜的形貌进行观察,并用Nano measurer软件测量纤维的平均直径。使用接触角测量仪对纳米纤维膜进行接触角的测量。对静电纺纳米纤维膜进行傅里叶变换红外光谱分析,设置扫描范围为500~4 000 cm-1,判断改性后纳米纤维膜上基团的情况。
1.3.2 载酶量测定 取洁净试管,分别取1 mL固定前的酶溶液、固定化酶后的溶液以及清洗固定化酶膜所用的溶液于试管中,加入4 mL考马斯亮蓝G-250染料试剂,轻摇混匀,分别取三组平行试样,在分光光度计595 nm 的波长处检测对应的吸光值,代入蛋白标准曲线中,得到固定前后酶溶液以及清洗酶膜液的相应浓度[6]。以下式计算纳米纤维膜上柚苷酶的负载量。
式中G——纳米纤维膜上的酶固定量,mg/g;
C0,C1——分别表示固定化酶前后酶溶液中酶含量,mg/mL;
C2——冲洗固定化酶膜的去离子水中酶的含量,mg/mL;
V0——原始酶溶液的体积,mL;
V2——清洗酶膜所用的去离子水的体积,mL;
M——聚氨酯纳米纤维膜的质量,g(干重)。
1.3.3 柚苷酶酶活力的测定 参考Davis法[7],用pH为 4.5的缓冲液配制浓度0.8 g/L的柚皮苷溶液。试剂瓶中放入酶膜,加入0.8 mL柚皮苷溶液,在50 ℃的恒温水浴中反应30 min。量取0.1 mL反应后的酶解液于试管中,加入0.1 mL浓度4 mol/L的 NaOH溶液以及5 mL体积分数为90%的一缩二乙二醇溶液,充分混合均匀后静置10 min。用分光光度计在波长420 nm处测定吸光值。
柚苷酶酶活力(U)的定义:在 pH 4.5,50 ℃条件下,每分钟降解1 μg柚皮苷所需的酶量为一个酶活力单位。酶比活力(U/g或U/mL)的定义:在pH 4.5、50 ℃条件下,1 g固定化柚苷酶(或 1 mL 游离柚苷酶)所表现出的酶活力。相对酶活力(%)按下式计算。
相对酶活力=(酶活力/最高酶活力)×100%
2 结果与讨论
2.1 扫描电镜表征
图1是质量分数为12%的PU纺丝液在接收距离为22 cm,纺丝电压为22 kV,注射速率为 0.5 mL/h,接收器滚轮转速为300 r/h的纺丝参数下制得的纤维膜的微观结构。

图1 PU纳米纤维膜扫描电镜图Fig.1 SEM of PU nanofilm
由图1可知,纺得的PU纳米纤维膜的纤维表面无串珠状结构,纤维不粗糙,整体较为光滑,说明喷丝头处的液滴在电场作用下能够很好地被拉伸成丝,通过静电纺丝获得了具有较好纤维样貌的纳米纤维膜。由图2可知,纤维丝直径主要分布在450~500 nm范围内,纤维丝较细。
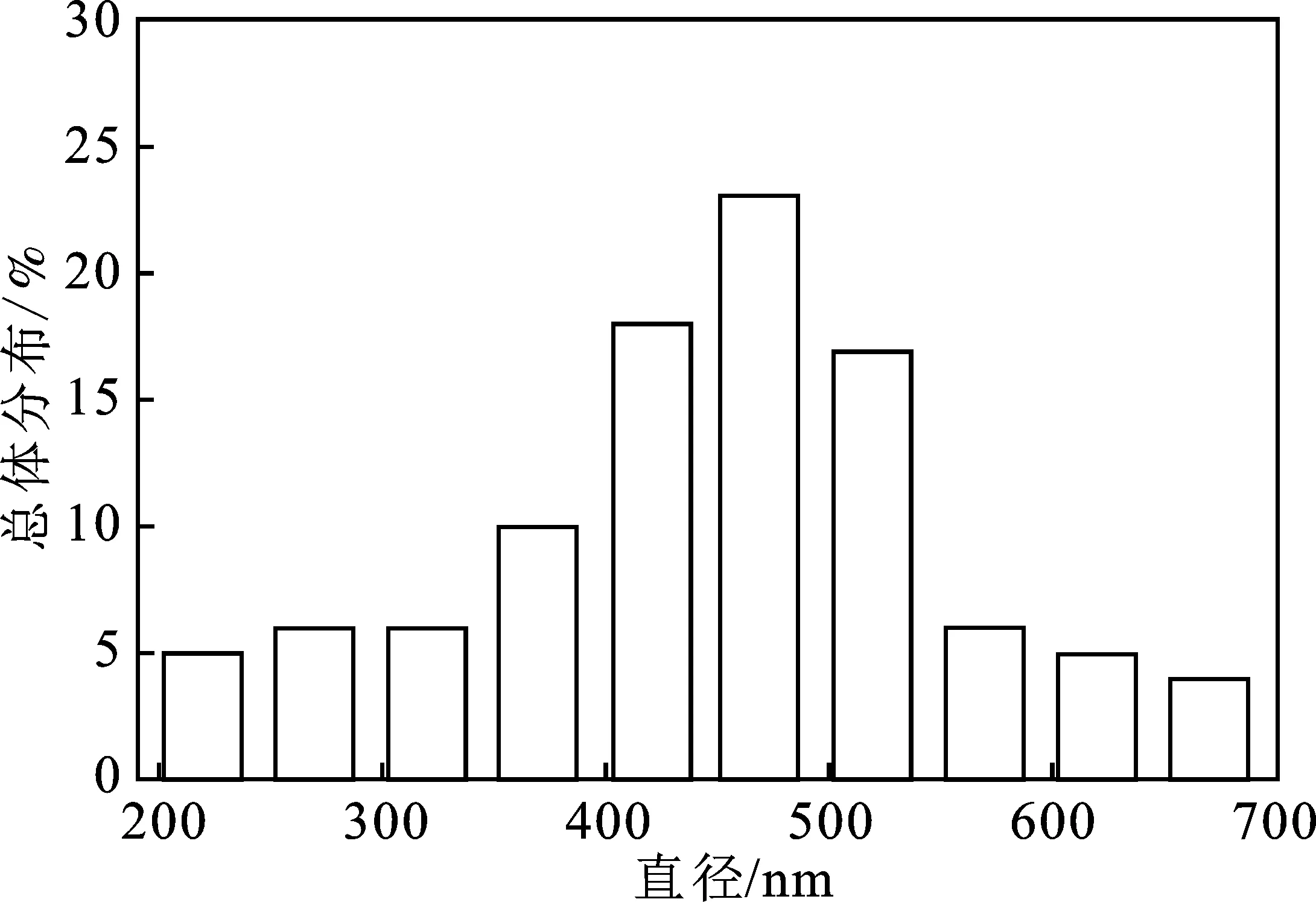
图2 纳米纤维膜直径分布图Fig.2 Distribution of nanofilm diameter
2.2 接触角测量
测量CTS亲水改性前后PUNF的接触角,结果见图3。
由图3可知,CTS改性前,PU纳米纤维膜的接触角为124.5°,即纳米纤维膜表现为疏水性;CTS亲水改性后,PU纳米纤维膜的接触角为72.8°,表现为亲水性。这是因为CTS分子结构中含有大量的氨基和羟基亲水基团,使得纤维膜的亲水性得到良好的改善[8]。


图3 改性前后PUNF的接触角Fig.3 Measurement of contact angle before (a) and after (b) modification a.改性前;b.改性后
2.3 傅里叶变换红外光谱
图4是PU原膜、PU-CTS膜和PU-CTS-酶膜的红外吸收光谱图。
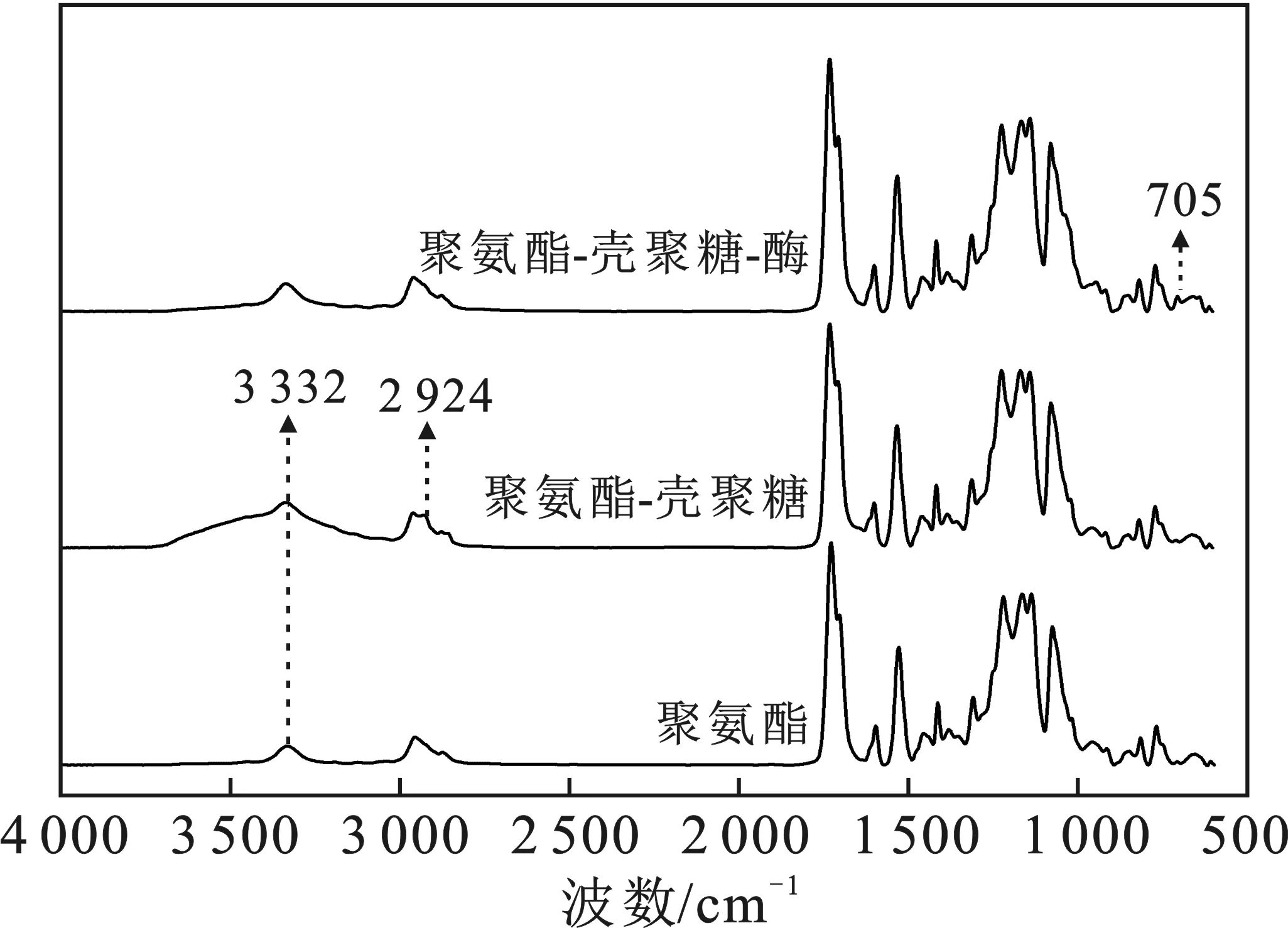
图4 傅里叶变换红外光谱图Fig.4 Fourier infrared spectrum
由图4可知,经接枝CTS后的膜相较于原膜,在2 924 cm-1增加了一个吸收峰,在3 332 cm-1处的吸收峰值增大,这可能是接枝CTS后引入的CH2—OH基团。酶膜在705 cm-1处出现了一个吸收峰,这可能是酶上的氨基酸的COO变角振动,因此可判断柚苷酶成功地固定在了PU纳米纤维膜上。
2.4 壳聚糖浓度对载酶量及其酶活力的影响
CTS质量浓度测试结果见图5。
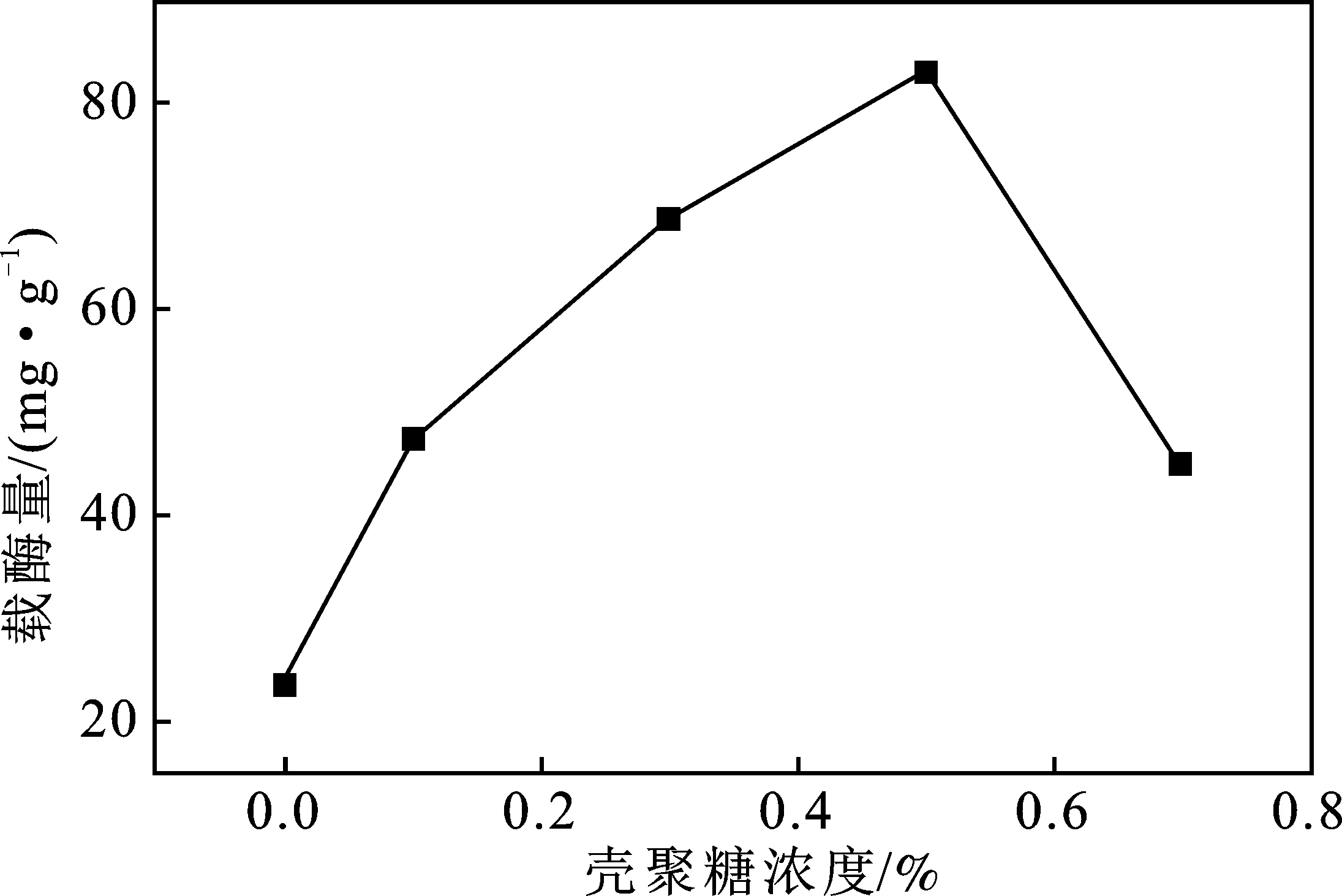
图5 壳聚糖浓度对膜上载酶量的影响Fig.5 Effect of CTS concentration on loading amount of PU nanofilm
由图5可知,当PU膜接枝了CTS后,使得膜的载酶量有了较大幅度的提升,可能是由于CTS上的亲水基团为柚苷酶提供了更多的接枝位点。载酶量随着CTS的浓度增大而增大,CTS浓度0.5%时,PU膜上的载酶量达到最大值,为83.2 mg/g。CTS浓度>0.5%时,载酶量下降,这可能是由于空间位阻的影响,在PU膜上的纤维表面所排列的CTS过于紧密,导致柚苷酶与膜之间的传质通道受到限制。
由图6可知,CTS浓度增加时,柚苷酶的相对酶活性随之增大,CTS浓度为0.5%时,柚苷酶酶活力达到最大值。随着CTS浓度的增加,对PU膜的亲水改性效果越好,良好的亲水性可以给柚苷酶提供一个微水环境,有利于酶活性的保持[9],所以柚苷酶的酶活力逐渐增加。而后随着浓度增大,酶活力呈现下降趋势,一方面可能由于在柚苷酶对柚皮苷进行分解作用的过程中,PU膜上固定的柚苷酶量出现了下降的趋势,载酶量的下降使得对柚皮苷的脱苦率有所下降;另一方面是CTS浓度的增加,导致纤维膜内部空间受影响,酶与底物催化的传质阻力增大。

图6 壳聚糖浓度对固定化酶的酶活力的影响Fig.6 Effect of CTS concentration on relative activity of immobilized enzyme
2.5 温度对酶活力的影响
一般情况下,酶催化底物的速率开始时随温度的增加而逐渐升高,待温度到达一定值,由于温度过高使得酶蛋白发生变性而抑制其活性,导致酶解反应速率降低[10]。因而探究了温度对柚苷酶活力的影响,情况见图7。
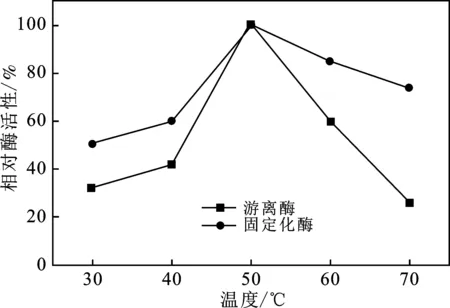
图7 酶解温度对固定化酶的酶活力的影响Fig.7 Effect of temperature on relative activity of immobilized enzyme
由图7可知,游离柚苷酶和固定化柚苷酶的酶活力均先上升后下降,在温度50 ℃时具有最高酶活力。在30~50 ℃和50~70 ℃时,固定化柚苷酶的酶活力均高于游离柚苷酶的酶活力,说明经固定化后,酶温度稳定性得到了提高。
2.6 酶解时间对酶活力的影响
图8是在不同的时间长度下分别用游离酶和固定化酶对柚皮苷进行脱苦,对比不同时间下柚苷酶的相对酶活性。
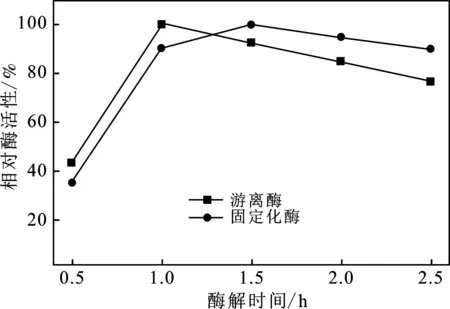
图8 酶解时间对固定化酶的酶活力的影响Fig.8 Effect of time on relative activity of immobilized enzyme
由图8可知,在脱苦时间为0.5 h时,固定化柚苷酶的酶活性反而比游离酶低,这可能是受载体影响,酶与底物接触需要经过一段传质通道,因而刚开始的时候固定化酶酶活性会低于游离酶。随着时间的增加,柚苷酶与柚皮苷越来越充分的接触,使得催化效果越好,因此固定化柚苷酶的酶活力也逐渐增加,直至催化反应时间为1.5 h时,酶活性达到最大值。而游离酶在催化时间为1 h时达到最大酶活力后,随着时间推移,酶活力逐渐下降,可能是因为游离状态的酶操作稳定性不佳,因而随时间的延长酶活性呈自然下降趋势。
2.7 pH值对酶活力的影响
用不同pH值的缓冲溶液配制柚皮苷溶液,向不同pH的底物中分别加入游离酶和固定化酶膜,50 ℃条件下反应1 h测定酶活力。
由图9可知,游离柚苷酶和固定化柚苷酶的酶活力均先上升后下降,且同时在pH为4~5之间时酶活力达到最大值。然而在pH为2~4和4~6之间时,固定化柚苷酶的酶活力均高于游离柚苷酶的酶活力,说明经固定化后的酶pH稳定性得到了提高。
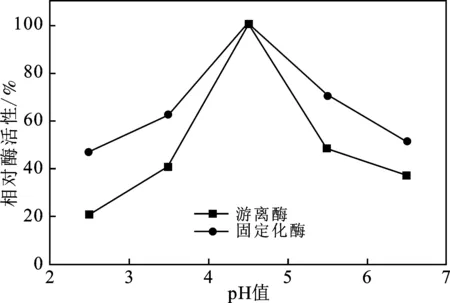
图9 酶解pH值对固定化酶的酶活力的影响Fig.9 Effect of pH on relative activity of immobilized enzyme
3 结论
(1)在PU纺丝液质量分数为12%,纺丝参数为:接收距离22 cm,纺丝电压22 kV,注射速率 0.5 mL/h,接收器滚轮转速300 r/h的条件下可获纤维形貌良好的纳米纤维膜。
(2)使用CTS对PU膜进行亲水改性,使得纳米纤维膜有亲水性,膜上接枝了作为亲水基团的羟基,当壳聚糖浓度为0.5%,聚氨酯膜有最佳的载酶量,为83.2 mg/g,对柚皮苷催化活力达到最大值。
(3)经过固定化的柚苷酶相较于游离酶,在一定的催化时间、pH和温度范围内均表现出更高的稳定性。

