CYP2C19基因多态性与不同年龄层大动脉粥样硬化型小卒中患者口服氯吡格雷治疗后临床预后的相关性研究
秦义人,王达鹏,赵红如,方琪
氯吡格雷是一种在冠心病和缺血性脑卒中发病过程中发挥重要作用的前体药物,其必须经人体中肝细胞色素P450(CYP)酶同工酶CYP2C19代谢生成活性产物,不可逆地阻断P2Y12受体,从而发挥抗血小板的生物学效应[1]。研究表明CYP2C19基因多态性(尤其是CYP2C19*2 和CYP2C19*3)在冠心病患者中与临床预后高度相关[2]。然而,CYP2C19基因多态性与缺血性脑血管病的相关性目前仍存在争议,尤其是在大动脉粥样硬化型脑卒中或小卒中人群中缺乏相关研究。以往研究认为,脑卒中患者的CYP2C19酶活性减少与卒中不良临床预后相关,亦有研究并未发现这种相关性[3-4],产生这种差异的机制解释为年龄可能在其中扮演了重要角色。既往研究表明,CYP酶活性在实验动物和人体中均呈年龄依赖性降低,从而影响其药物代谢效率[5-6]。因此,本研究通过分析不同年龄层大动脉粥样硬化型小卒中患者CYP2C19基因多态性与临床预后的相关性,为优化特定类型患者的二级预防策略提供参考依据。
1 对象与方法
1.1 研究对象 选取2015年4月—2018年4月在苏州大学附属第一医院神经内科住院治疗的大动脉粥样硬化型小卒中患者479例作为研究对象,年龄≤60岁169例,年龄>60岁310例。大动脉粥样硬化型卒中的诊断标准符合《中国急性缺血性脑卒中诊治指南2014》中缺血性脑卒中标准[7],小卒中定义为美国国立卫生研究院卒中量表(NIHSS)评分≤3分[8]。纳入标准:(1)48 h内首次发生的急性缺血性脑卒中;(2)年龄28~90岁;(3)入组时仅同意使用氯吡格雷单抗血小板而非早期双抗血小板治疗方案。排除标准:(1)在入院前1个月、住院和随访期间接受了溶栓、抗凝、其他抗血小板药物治疗方案;(2)对氯吡格雷过敏;(3)近6个月内有颅内出血史;(4)诊断为血小板减少症、恶性肿瘤、严重肝肾疾病、心功能不全;(5)有卒中或短暂性脑缺血发作病史;(6)住院和随访期间行颈动脉内膜切除手术或颈动脉支架成形术,中途改用其他抗血小板药物或停服氯吡格雷的患者。本研究经苏州大学附属第一医院伦理委员会审核批准〔(2020)伦研批第061号〕。患者或家属均签署知情同意书。
1.2 样本量计算 根据假定的不良预后率使用PASS 15.0统计软件进行样本量估算;根据以往中国人群中的报道,CYP2C19 功能变异型(loss of function,LOF)等位基因(*2、*3)携带者和非携带者脑卒中不良预后发生率分别为24%和12%,而CYP2C19 LOF等位基因(*2、*3)携带和非携带者的比例分别为60%和40%[9-10],计算得出需入组415例患者才能满足双侧检验、显著性为0.05、把握度90%的统计要求。
1.3 方法
1.3.1 治疗及资料收集 患者均接受氯吡格雷口服治疗75 mg/次、1次/d,为期1年。住院期间收集患者的基线资料,包括年龄、NIHSS评分、血糖水平、高密度脂蛋白(HDL)水平、低密度脂蛋白(LDL)水平、总胆固醇(TC)水平、三酰甘油(TG)水平、白细胞计数、糖尿病史、高血压史、CYP2C19 LOF等位基因、吸烟情况(连续或累积吸烟半年以上,每日超过1支,且仍然吸烟)、饮酒情况(男性平均每日大于4个标准单位,女性大于3个标准单位)、性别。患者在入院和出院时均接受2次常规心电图或Holter检查来排除心源性栓塞的可能。基因检测的血样均在患者入院当天采集,收集在EDTA管内,DNA提取使用商业化萃取试剂盒。根据CYP2C19 LOF等位基因携带状态将患者分为携带组和非携带组。由于样本量偏小,本研究中未将患者分为快代谢型、中间代谢型、慢代谢型。
1.3.2 随访 研究随访开始时间为2015年7月,最终截止时间为2019年5月。随访方法:通过门诊、电话随访等方式在患者出院后3个月和1年时进行随访,记录患者服药情况、出现缺血性脑卒中复发(包括短暂性脑缺血发作)和长期功能预后及其发生时间。在随访3个月和1年后,由专业的神经科医生通过随访记录每个患者的卒中复发情况,采用改良Rankin 评分量表(mRS)对患者的神经功能缺损及预后进行判定[11]:完全无症状者为0分;有症状,但无明显功能障碍,能完成所有日常职责和活动者1分;轻度残疾,不能完成病前所有活动,但不需要帮助,能自理者2分;中度残疾,要求部分帮助,但行走不需要帮助者3分;重度残疾,不能独立行走,无他人帮助不能满足自身需要者4分;严重残疾,卧床、失禁、需要持续护理及关注者5分;死亡者6分。mRS≤2分为临床预后良好(预后良好组),mRS>2分为临床预后不良(预后不良组)。
1.4 统计学方法 使用SPSS 22.0统计软件进行数据分析。正态分布的计量资料以(±s)表示,两组间比较采用成组t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验;计数资料以相对数表示,组间比较采用χ2检验;CYP2C19 LOF等位基因携带和临床预后的相关性与年龄间的交互效应采用Breslow-Day检验和Tarone's检验;采用二元Logistic回归法分析交互效应大小;采用多因素Logistic回归分析探讨临床预后及复发/死亡的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 不同年龄段不同预后患者基线资料比较 年龄≤60岁患者:预后良好组与预后不良组NIHSS评分、血糖水平、LDL水平、白细胞计数、糖尿病比例、高血压比例、CYP2C19 LOF等位基因、吸烟比例比较,差异有统计学意义(P<0.05);两组年龄、HDL水平、TC水平、TG水平、饮酒比例、性别比例比较,差异无统计学意义(P>0.05),见表1。年龄>60岁患者:预后良好组与预后不良组血糖水平、HDL水平、LDL水平、TG水平、糖尿病比例、高血压比例、性别比较,差异有统计学意义(P<0.05);两组年龄、NIHSS评分、TC水平、白细胞计数、CYP2C19 LOF等位基因、吸烟比例、饮酒比例比较,差异无统计学意义(P>0.05),见表2。
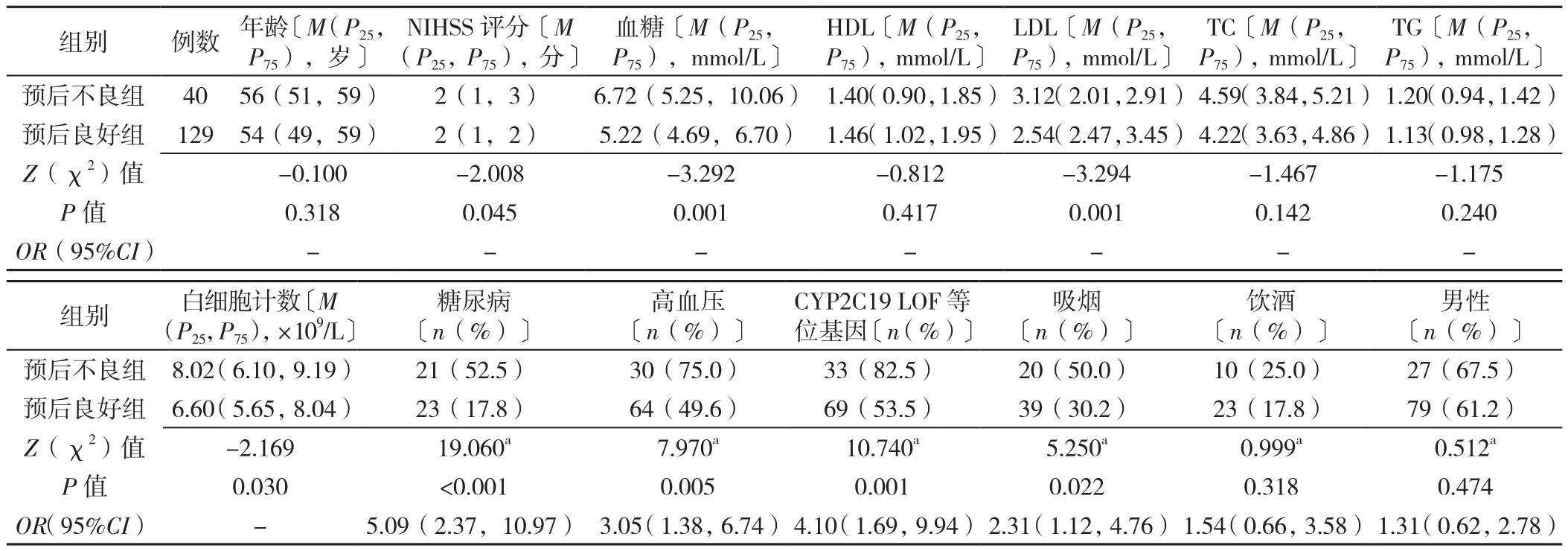
表1 年龄≤60岁的不同预后患者基线资料比较Table 1 Comparison of baseline data of patients aged ≤ 60 years with good and poor outcome
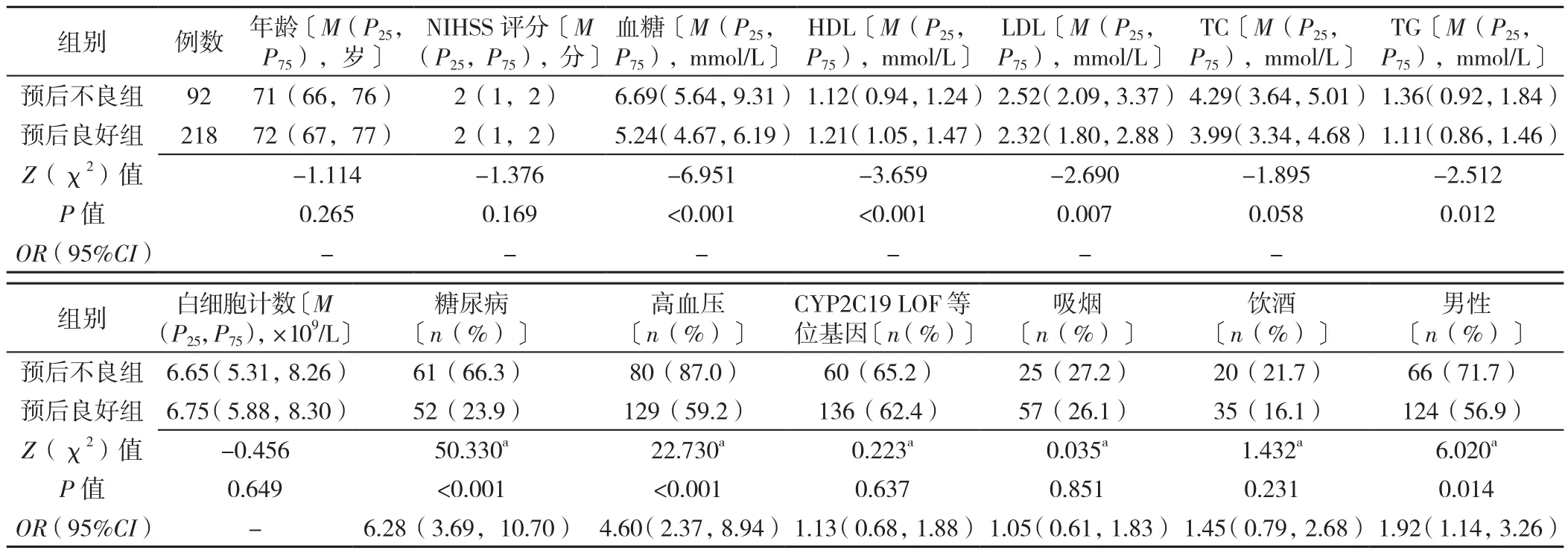
表2 年龄>60岁的不同预后患者基线资料比较Table 2 Comparison of baseline data of patients aged >60 years with good and poor outcome
2.2 不同年龄段不同CYP2C19 基因型患者基线资料的比较 年龄≤60岁和>60岁患者中,不同CYP2C19基因型患者年龄、NIHSS评分、血糖水平、LDL水平、HDL水平、TC水平、TG水平、白细胞计数、糖尿病比例、高血压比例、吸烟比例、饮酒比例、性别比较,差异无统计学意义(P>0.05),见表3~4。
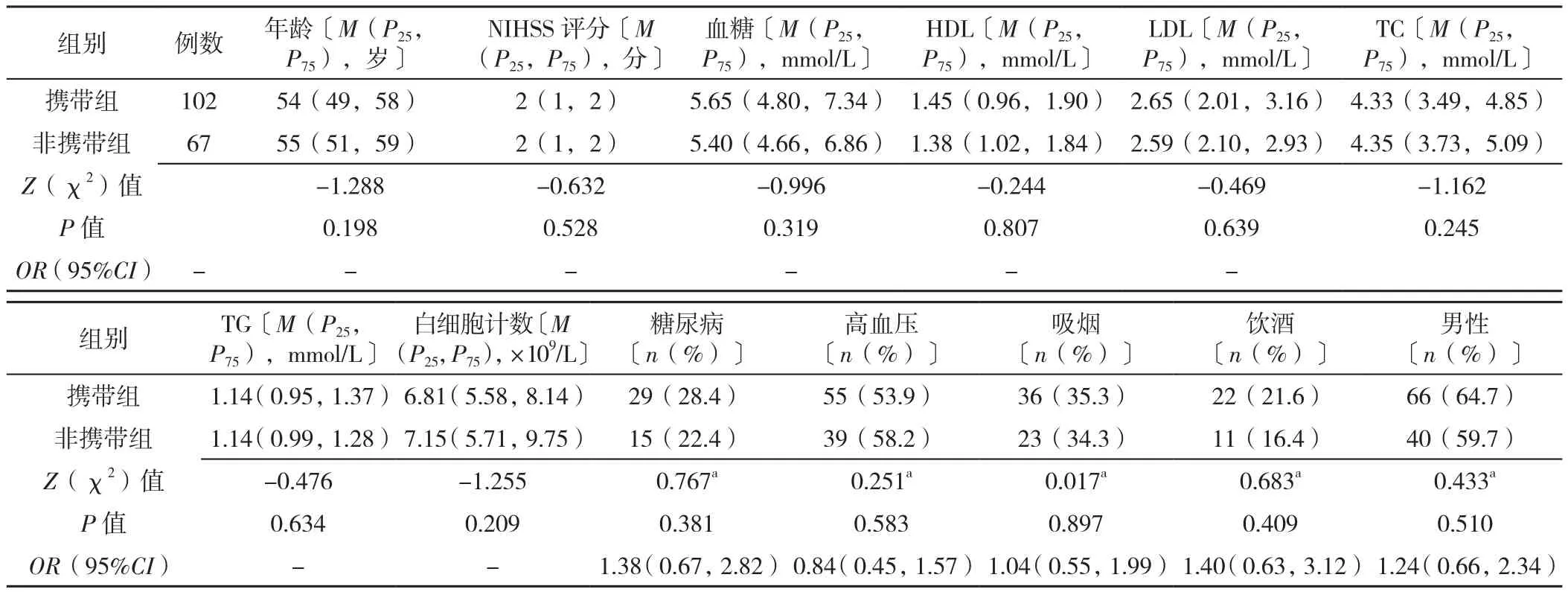
表3 年龄≤60岁的不同CYP2C19 LOF等位基因携带患者基线资料比较Table 3 Comparison of baseline data of CYP2C19 LOF allele carriers and non-carriers aged ≤ 60 years

表4 年龄>60岁的不同CYP2C19 LOF等位基因携带患者基线资料比较Table 4 Comparison of baseline data of CYP2C19 LOF allele carriers and non-carriers aged > 60 years
2.3 CYP2C19 LOF等位基因携带与年龄间的交互效应Breslow-Day检验:CYP2C19 LOF等位基因携带和临床预后的相关性与年龄间存在交互效应(χ2=6.352,P=0.012),Tarone's检验:CYP2C19 LOF等位基因携带和临床预后的相关性与年龄间存在交互效应(χ2=6.351,P=0.012)。使用二元Logistic回归法分析交互效应大小,以是否出现预后不良(赋值:无=0,有=1)为因变量,以CYP2C19 LOF等位基因携带情况(赋值:非携带=0,携带=1)、年龄(赋值:>60岁=0,≤60岁=1)为自变量,以CYP2C19 LOF等位基因×年龄分层为交互项,分析显示,交互效应的大小比较,差异有统计学意义〔P=0.013,OR=3.63,95%CI(1.31,10.07)〕, 见表5。此外,不同年龄层患者CYP2C19 LOF等位基因与卒中后3个月卒中复发/死亡相关性差异并无异质性,见表6。而在所有研究患者中,CYP2C19 LOF等位基因携带患者3个月卒中复发/死亡比例为9.7%,与非携带患者的比例3.9%相比,差异有统计学意义(χ2=5.151,P=0.023)。
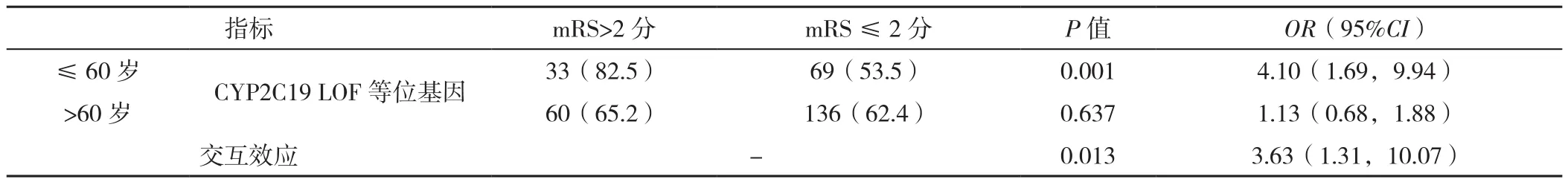
表5 不同年龄层的同质性检验和CYP2C19 LOF等位基因携带与年龄的交互效应分析Table 5 Test of homogeneity of the interaction effect between CYP2C19 LOF allele carriage and age in different age groups

表6 不同年龄层CYP2C19 LOF基因携带与卒中复发/死亡的相关性分析〔n(%)〕Table 6 Correlation analysis of CYP2C19 LOF gene carriage and stroke recurrence/death in different agegroups
2.4 不同年龄段患者预后的多因素Logistic回归分析分别以是否出现预后不良(赋值:无=0,有=1)、是否出现复发/死亡(赋值:无=0,有=1)为因变量,以CYP2C19 LOF等位基因携带情况(赋值:无=0,有=1)、高血压史(赋值:无=0,有=1)、糖尿病史(赋值:无=0,有=1)、吸烟(赋值:无=0,有=1)、饮酒(赋值:无=0,有=1)、性别(赋值:女=0,男=1)、NIHSS评分(赋值:实测值)、血糖(赋值:实测值)、TC(赋值:实测值)、TG(赋值:实测值)、LDL(赋值:实测值)、HDL(赋值:实测值)、白细胞计数(赋值:实测值)为自变量,进行多因素 Logistic回归分析,结果显示,年龄≤60岁的患者中,CYP2C19 LOF等位基因、高血压史、糖尿病史、吸烟、LDL水平可能是临床预后的独立预测因子(P<0.05),见表7;年龄>60岁的患者中,高血压史、糖尿病史、饮酒、男性、血糖水平、HDL水平可能是临床预后的独立预测因子(P<0.05),见表8。多因素Logistic回归模型分析显示,以是否出现3个月卒中复发/死亡为自变量(赋值:无=0,有=1),在控制CYP2C19 LOF等位基因、高血压史、糖尿病史、吸烟、饮酒、性别、NIHSS 评分、血糖水平、TC水平、TG水平、LDL水平、HDL水平、白细胞计数(赋值情况同2.4)上述临床混杂因素后,尚不能肯定CYP2C19 LOF是该类研究患者卒中后3个月卒中复发/死亡的独立预测因子(P>0.05),见表9。
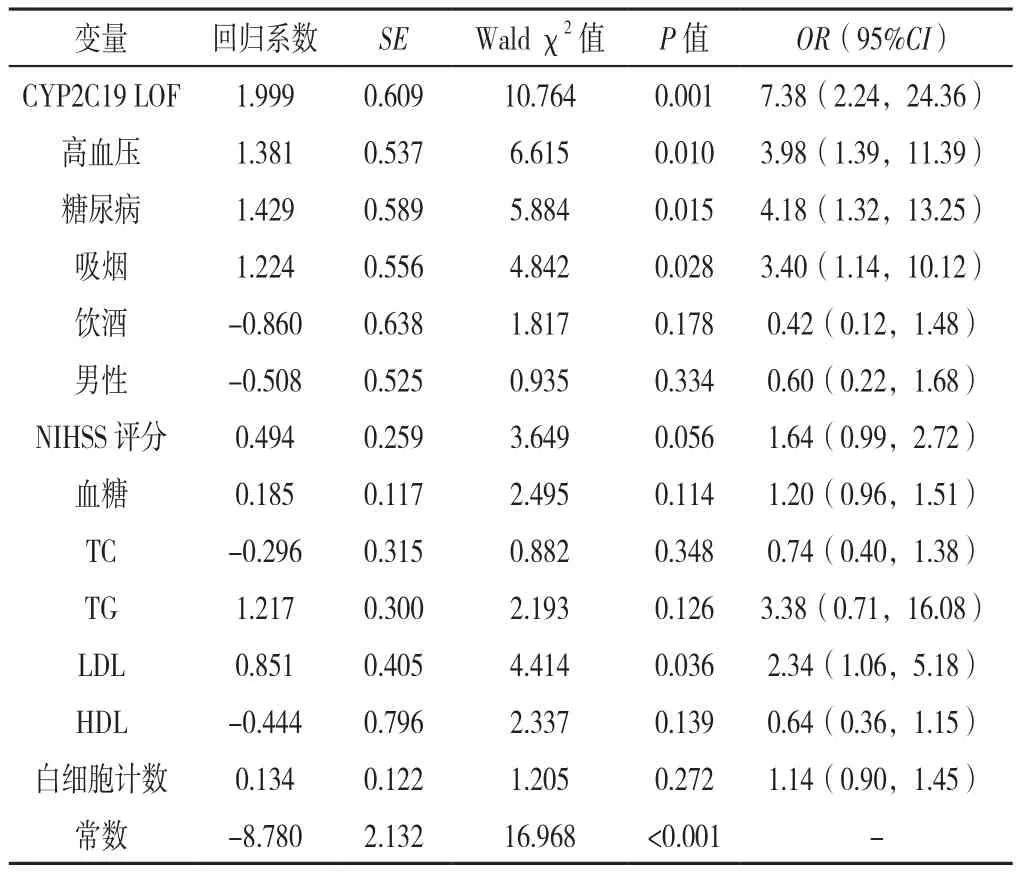
表7 年龄≤60岁患者预后的多因素Logistic回归分析Table 7 Multivariate Logistic regression analysis of factors possibly associated with the outcome in patients ≤ 60 years old
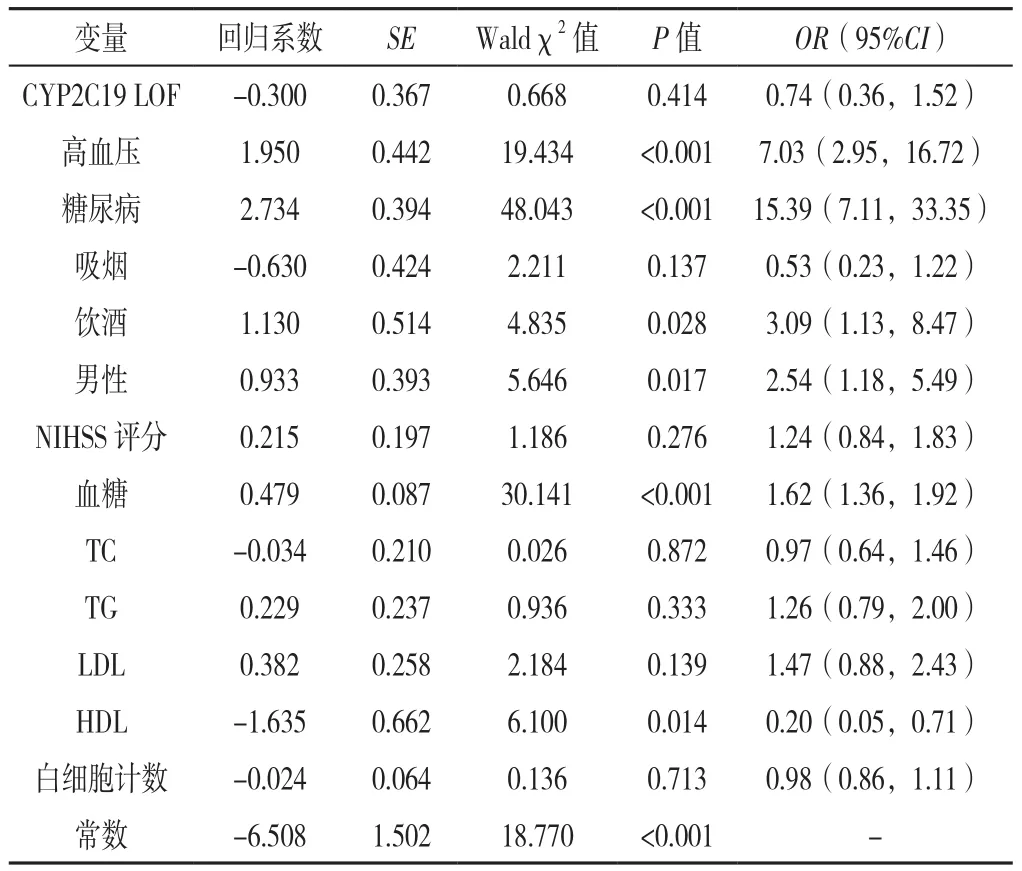
表8 年龄>60岁患者预后的多因素Logistic回归分析Table 8 Multivariate Logistic regression analysis of factors possibly associated with the outcome in patients aged >60 years

表9 患者卒中后3个月卒中复发/死亡多因素Logistic回归分析Table 9 Multivariate Logistic regression analysis of factors possibly associated with stroke recurrence or death in patients three months after stroke
3 讨论
氯吡格雷是一种噻吩并吡啶类前体药物,作为一种经典的抗血小板聚集药物,广泛应用在心脑血管疾病的治疗,且证实了其有效性和安全性。然而,在临床上有部分患者接受氯吡格雷治疗后仍发生缺血性卒中事件,考虑这些患者存在氯吡格雷抵抗(clopidogrelresistance,CR)。引起CR的原因众多,其中药物基因多态性被认为是CR最重要的内在因素[12]。CR的发生机制与氯吡格雷的代谢过程有关,氯吡格雷口服后约15%经两步代谢转化,由CYP2C19催化为具有抗血小板聚集效果的活性成分。既往国内外研究表明,*1型、*2型、*3型为氯吡格雷代谢相关CYP2C19酶的等位基因,其中,CYP2C19*2与*3变异型为功能变异型等位基因,该变异可降低CYP2C19酶活性,使其经肝脏代谢后的活性产物不足,从而出现CR[12-13]。在我国人群中,CYP2C19*2型、*3型的比例较国外人群高[14-15]。因此,CYP2C19基因多态性对我国急性缺血性脑卒中患者使用氯吡格雷治疗的效果可能存在较大影响。然而,目前研究表明,CYP2C19基因多态性与不同临床结局的相关性仍存在争议[3-4],同时,其在不同年龄人群或者不同脑卒中亚类中的作用尚不清楚。因此,本研究探讨在不同年龄层接受氯吡格雷治疗的大动脉粥样硬化型小卒中患者中CYP2C19基因多态性与临床预后的相关性。
卒中的临床结局首先与不同的评估手段相关。mRS被认为更适合评估患者的长期临床预后[16],尤其在首次发生卒中或小卒中患者的长期随访中,其具有较高的临床预测价值[17]。而且,该量表在不同测评者间的可靠性一致性较高,同时具有较高的临床评测敏感性,对得出阳性结果的样本量要求也较小[18]。因此,本研究使用mRS作为临床预后的评价工具。国内外研究表明,除了CYP2C19基因多态性,临床因素、细胞因素对缺血性脑卒中患者的临床结局也有重要影响[19]。临床因素包括患者并发症的多少和严重程度,例如糖尿病、高血压、高脂血症、血糖、NIHSS评分等。因此,本研究纳入临床常见的缺血性脑卒中危险因素来控制临床的混杂因素,结果显示,NIHSS评分、血糖水平、LDL水平、白细胞计数、糖尿病比例、高血压比例、CYP2C19基因多态性比例、吸烟比例在年龄≤60岁不同临床预后的患者中存在差异,在>60岁患者中,则在血糖水平、HDL水平、LDL水平、TG水平、糖尿病比例、高血压比例、性别的比例上存在差异。提示这些指标可能是影响临床结局的重要因素,与既往研究结论一致[20-21]。细胞因素方面主要包括血小板更新速度、肝脏代谢酶水平等。本研究结果同时显示,随着年龄分层的改变,CYP2C19基因多态性和长期功能预后的相关性在年龄层间存在异质性,提示在接受氯吡格雷治疗的大动脉粥样硬化型小卒中患者中,年轻患者的长期功能预后与CYP2C19功能变异型等位基因的相关性可能较年老患者更强。目前直接探索其相关机制的国内外研究尚无报道,推测其原因可能为肝脏代谢酶水平的高低在其中发挥了重要作用。国外研究发现,实验动物和人体中CYP的酶活性在年老组中均大幅下降[5-6],因而CYP2C19基因多态性对CYP2C19酶活性的影响在年轻患者中可能更明显。本研究结果还显示,在年龄≤60岁的患者中,CYP2C19 LOF等位基因、高血压史、糖尿病史、吸烟、LDL水平均可能是长期功能预后的独立危险因素。而在年龄>60岁的患者中,高血压史、糖尿病史、饮酒、男性、血糖水平、HDL水平可能是长期功能预后的预测因子。该结论与既往研究结果一致[22-23],表明临床的长期功能预后是多种因素协同作用的结果,在不同年龄层中的影响因素也不尽相同。推测其原因可能为年龄对动脉粥样硬化的形成存在一定的影响。颅内动脉粥样硬化发生的时间较颅外动脉更晚[24-25],且颅内动脉对高胆固醇血症诱发脂纹形成的耐受性更好,动脉粥样硬化斑块破裂等血栓诱导事件发生率更低[24,26]。因此,氯吡格雷的抗血小板治疗可能在年轻的大动脉粥样硬化型小卒中患者中更有效。最后,本研究结果显示,虽然在所有研究患者中,不同基因携带患者3个月卒中复发/死亡比例有差异,然而尚不能肯定CYP2C19 LOF等位基因是该类研究患者卒中后3个月卒中复发/死亡的独立预测因子。原因可能与研究人群样本过少,缺乏对研究人群服药依从性、影响氯吡格雷疗效的其他药物使用情况等记录有关。例如,质子泵抑制剂(PPIs)及钙离子拮抗剂(CCBs)可能会因共同竞争CYP2C19的同一结合位点而发生与氯吡格雷药物间的相互作用[27-28]。
综上所述,本研究发现CYP2C19 LOF等位基因是接受氯吡格雷治疗的大动脉粥样硬化型小卒中患者长期功能预后不良的危险因素,该因素的影响可能与年龄呈负相关。同时,不同年龄层该类患者长期功能预后的独立危险因素也不尽相同,对该类型患者提供的二级预防策略可能需要综合年龄方面考虑。本研究存在以下局限性:研究的样本量较少、选择偏倚及单中心住院患者。此外,血浆中的氯吡格雷活性代谢物浓度并未检测,在基线资料和后期的随访中,影响氯吡格雷药物活性的药物、其他基因携带信息未做记录和测试。最后,一些非基因相关因素如饮食习惯、环境因素等也未做相应的记录和校正。因此,未来还需扩大样本量,并通过多中心研究来进一步证实该结论,为临床提供更有力的数据支持。
作者贡献:秦义人进行论文构思撰写、设计和实施研究、数据采集、统计分析、经费支持;王达鹏采集分析数据、指导论文修改;赵红如、方琪进行研究指导、论文指导、额外绩效支出。
本文无利益冲突。

