肠道菌群代谢与血脂水平改变对不同时期精神分裂症患者的影响研究
姚理慧,孟小靖,王中娴,陈苑苑,程鹏,石丽,李经纬,苏虹,张许来,3*
精神分裂症(schizophrenia)是一种慢性重性精神疾病,约累及全球1%的人口[1],具有高致残率、高负担性、高自杀倾向[2],涉及幻觉、妄想、言语和行为异常。研究显示,心血管疾病是精神分裂症死亡的首要原因[3],代谢综合征是心血管疾病的主要预测因子[3-4],在精神分裂症患者中的发病率是普通人群的2~3倍[5],血脂异常一直被认为是引起代谢综合征的重要因素。近期有研究发现,首发精神分裂症患者中存在血脂代谢紊乱[6],进一步检测提示,其脑脊液及外周体液中存在膜脂及磷脂水平的异常[7],说明脂质生物学异常可能与精神分裂症的病理生理相关。也有研究表明,肠道菌群可影响宿主脂质代谢[8],可能在精神分裂症的发病中起到重要作用。因此,代谢组学为神经精神疾病的病因学研究提供一条新的途径[9],借助粪便代谢体可以进一步研究肠道菌群代谢与宿主的交互作用机制[10]。然而目前国内此类临床研究较少,因此,本研究以精神分裂症不同临床时期患者为研究对象并与健康对照相比较,探讨不同时期精神分裂症患者血脂水平和肠道菌群代谢的差异,分析其对疾病的影响,为精神分裂症的治疗提供帮助,进而改善预后。
1 对象与方法
1.1 研究对象 纳入2018年11月—2019年7月安徽省精神卫生中心住院的精神分裂症患者(病例组)急性期42例(急性期组)和缓解期41例(缓解期组),同时志愿招募匹配(性别、年龄、身高、体质量与病例组相当)的健康人40例(健康对照组)为研究对象。纳入标准为:(1)患者及家属知情同意;(2)符合《精神障碍诊断和统计手册》第五修订版(DSM-5)[11]中关于“精神分裂症”急性期、缓解期的相关诊断标准;(3)入院后采用阳性和阴性综合征量表[12](Positive and Negative Syndrome Scale,PANSS)评估,急性期:PANSS评分≥60分;缓解期:PANSS评分<60分;(4)应用对代谢影响较小的氨磺必利、阿立哌唑、舒必利等药物治疗[13]。排除标准:(1)存在脑及躯体器质性疾病病史或合并其他符合DSM-5诊断的精神障碍者;(2)存在酒精及其他精神活性物质依赖史;(3)妊娠、哺乳期或月经期女性;(4)专科医生诊断存在消化道疾病或近3个月内发生过肠道感染;(5)入组前接受过无抽搐电休克治疗;(6)近半年饮食结构明显改变;(7)近3个月服用过抗生素、糖皮质激素、益生菌制剂及其他影响肠道菌群制剂。健康对照组纳入标准:通过自愿招募原则匹配合适的健康人群(既往及目前不存在躯体疾病或其他神经精神疾病病史),排除标准与病例组一致。本研究经安徽医科大学附属心理医院医学伦理委员会批准(批准号:HSY-IRB-PJ-JZB-001),参与者均知情同意,并签署知情同意书。
本研究创新点与局限性:
创新点:(1)有研究已发现肠道菌群与精神分裂症病理生理存在关联,肠道内微生物及其代谢产物可影响宿主的神经发育、免疫及代谢等多方面功能。其中脂质代谢异常一直是影响精神分裂症的一个重要因素,有研究发现其与肠道菌群改变有关。但目前国内针对精神分裂症患者肠道菌群代谢与脂质代谢水平的相关研究仍较少。(2)本研究发现精神分裂症发展的不同阶段均存在血脂水平异常,并发现这种异常不仅与患者疾病本身存在关联,还可能增加其罹患代谢综合征的风险,是精神分裂症的高风险因素。(3)本研究同时以肠道菌群代谢为切入点,还发现精神分裂症患者存在肠道菌群脂质代谢的异常。与既往基因组学(16s测序、宏基因组学)从基因结构角度出发不同,本研究以粪便代谢体为研究对象,更直观地了解了不同阶段精神分裂症患者肠道菌群脂质代谢的差异及其对宿主代谢可能的影响。这些结果提示无论在下一步的研究还是疾病诊疗过程中,均要关注血脂水平及肠道菌群代谢对精神分裂症的影响。
局限性:(1)本研究为单中心临床研究,样本量及样本代表性可能不足。(2)本研究为粪便代谢体的非靶向代谢组学研究,缺乏定向性。(3)本研究为横断面研究,混杂因素较多。在后续的研究中,会进行多中心、大样本的数据收集,对部分患者进行干预,采取多组学技术联合应用的方法进一步分析肠道菌群及脂质代谢对精神分裂症的影响。
1.2 研究方法
1.2.1 一般资料收集和量表评定 收集受试者一般资料,包括性别、年龄、身高、体质量、体质指数(BMI)、病程。PANSS由经过一致性培训的精神科临床医师评定,采用PANSS的5-因子模型进行分析,包括认知因子(P2、N5、N7、G10、G11)、兴奋因子(P4、P7、G4、G8、G14)、抑郁因子(G2、G3、G6)、阳性因子(P1~P7)、阴性因子(N1-N7),评分越高,症状越严重。
1.2.2 血液标本 入组第2天收集血液标本并送至本单位检验科实验室检测总胆固醇(total cholesterol,TC)、 高 密 度 脂 蛋 白(high density lipoprotein,HDL)、三酰甘油(triglycerides,TG)、载脂蛋白A1(apolipoprotein A1,APOA1)、载脂蛋白B1(apolipoprotein B1,APOB1),采用深圳迈瑞生物医疗电子股份有限公司的全自动生化分析仪BS-2000M进行分析。
1.2.3 粪便标本采集 受试者在入组1周内采集粪便标本10 g左右,置于无菌粪便干燥盒内密封,并在1 h内运输至-80 ℃冰箱保存,直至送检。
1.2.4 代谢物提取 4 ℃条件下将粪便样本缓慢解冻,称取25 mg置于EP管中,加入800 μl提取液和内标后研磨(50 Hz,5 min),水浴超声(4 ℃,10 min)静置(-20 ℃冰箱,1 h)。4 ℃下低温高速离心(Centrifuge 5430,Eppendorf, 离 心 半 径 7.68 cm,25 000 rpm,15 min)后取600 μl离心后上清液,冷冻真空浓缩仪抽干后,加入复溶液复溶,涡旋震荡(1 min)水浴超声后再次离心,取上清液行液相色谱-质谱分析(liquid chromatography-mass spectrometry,LC-MS)。质控样本由每个样本上清液各取50 μl混合成。
1.2.5 LC-MS 采用 Waters 2D UPLC(waters,USA)串联 Q Exactive高分辨质谱仪(Thermo Fisher Scientific,USA)进行检测。仪器检测时,样本随机排序,穿插QC样本减少系统误差。
1.2.6 数据分析 将质谱原始数据导入Compound Discoverer 3.1(Thermo Fisher Scientific,USA) 进 行 数据处理,包括峰提取、组内及组间的保留时间校正、加合离子合并、缺失值填充、背景峰标记以及代谢物鉴定,样本质控。结合KEGG、mzCloud、Chemspider、HMDB、Lipidmaps、BGI Library数据库进行代谢物鉴定,单变量分析(差异变化倍数和 t 检验)与多元统计分析结合筛选组间差异代谢物。
1.3 统计学方法 采用SPSS 25.0软件进行数据分析。计量数据符合正态分布以(±s)表示,两组间比较采用两独立样本t检验;偏态分布以M(P25,P75)表示,两组比较采用Mean-whitney U 检验;3组间比较满足正态分布和方差齐性运用单因素方差分析,不满足运用非参数检验;计数资料用相对数表示,组间比较采用χ2检验;相关分析采用Pearson相关。采用多元统计分析对代谢物进行分类及功能预测,结合单变量分析和T检验筛选差异代谢物及通路。以P<0.05为差异有统计学意义。
2 结果
2.1 3组一般人口学资料比较 3组性别、年龄、BMI比较,差异均无统计学意义(P>0.05)。急性期组与缓解期组病程比较,差异无统计学意义(P>0.05),见表1。
2.2 急性期组与缓解期组PANSS评分比较 急性期组的认知因子、兴奋因子、抑郁因子、阳性因子、阴性因子评分及PANSS总分高于缓解期组,差异均有统计学意义(P<0.05),见表2。
表2 急性期组与缓解期组的PANSS评分比较(±s,分)Table 2 Comparison of PANSS scale scores between schizophrenic patients at acute and remission stages
注:PANSS=阳性和阴性综合征量表
组别 例数 认知因子 兴奋因子 抑郁因子 阳性因子 阴性因子 PANSS总分缓解期组 41 6.73±0.27 5.71±0.16 3.17±0.07 9.49±0.35 13.24±0.68 44.98±1.06急性期组 42 10.79±0.45 10.69±0.48 4.71±0.42 15.57±0.72 19.83±0.96 72.21±1.77 t值 6.22 7.42 4.52 6.15 5.58 7.81 P 值 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01
2.3 3组血清脂代谢指标比较 3组TC、APOB1比较,差异均无统计学意义(P>0.05)。3组患者HDL、TG、APOA1水平比较,差异均有统计学意义(P<0.05);其中缓解期组、急性期组的HDL、APOA1水平低于健康对照组,差异均有统计学意义(P<0.05);缓解期组TG水平高于急性期组、健康对照组,差异均有统计学意义(P<0.05),见表3。
表3 急性期组、缓解期组及健康对照组的血清脂代谢指标比较(±s)Table 3 Comparison of serum lipid levels in schizophrenic patients at acute and remission stages and healthy controls
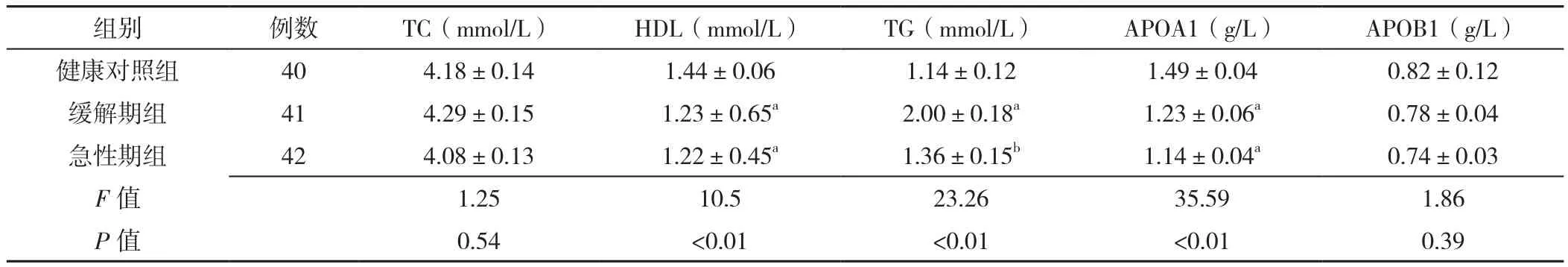
表3 急性期组、缓解期组及健康对照组的血清脂代谢指标比较(±s)Table 3 Comparison of serum lipid levels in schizophrenic patients at acute and remission stages and healthy controls
注:TC=总胆固醇,HDL=高密度脂蛋白,TG=三酰甘油,APOA1=载脂蛋白A1,APOB1=载脂蛋白B1;与健康对照组比较,aP<0.05;与缓解期组比较,bP<0.05
组别 例数 TC(mmol/L) HDL(mmol/L) TG(mmol/L) APOA1(g/L) APOB1(g/L)健康对照组 40 4.18±0.14 1.44±0.06 1.14±0.12 1.49±0.04 0.82±0.12缓解期组 41 4.29±0.15 1.23±0.65a 2.00±0.18a 1.23±0.06a 0.78±0.04急性期组 42 4.08±0.13 1.22±0.45a 1.36±0.15b 1.14±0.04a 0.74±0.03 F值 1.25 10.5 23.26 35.59 1.86 P 值 0.54 <0.01 <0.01 <0.01 0.39
2.4 急性期及缓解期精神分裂症患者血清脂代谢指标与PANSS评分的相关性分析 急性期精神分裂症患者TC水平与认知因子、兴奋因子、阳性因子、阴性因子无线性相关关系(P>0.05),与抑郁因子评分呈负相关(P<0.05);急性期精神分裂症患者HDL、TG、APOA1、APOB1水平与认知因子、兴奋因子、抑郁因子、阳性因子、阴性因子评分均无线性相关关系(P>0.05)。缓解期精神分裂症患者TC、TG、APOB1水平与认知因子、兴奋因子、抑郁因子、阳性因子、阴性因子评分均无线性相关关系(P>0.05);缓解期精神分裂症患者HDL水平与认知因子、兴奋因子、抑郁因子、阳性因子评分均无线性相关关系(P>0.05),与阴性因子评分呈负相关(P<0.05);缓解期精神分裂症患者APOA1水平与认知因子、兴奋因子、抑郁因子评分均无线性相关关系(P>0.05),与阳性因子评分呈正相关(P<0.05),与阴性因子评分呈负相关(P<0.05),见表4。
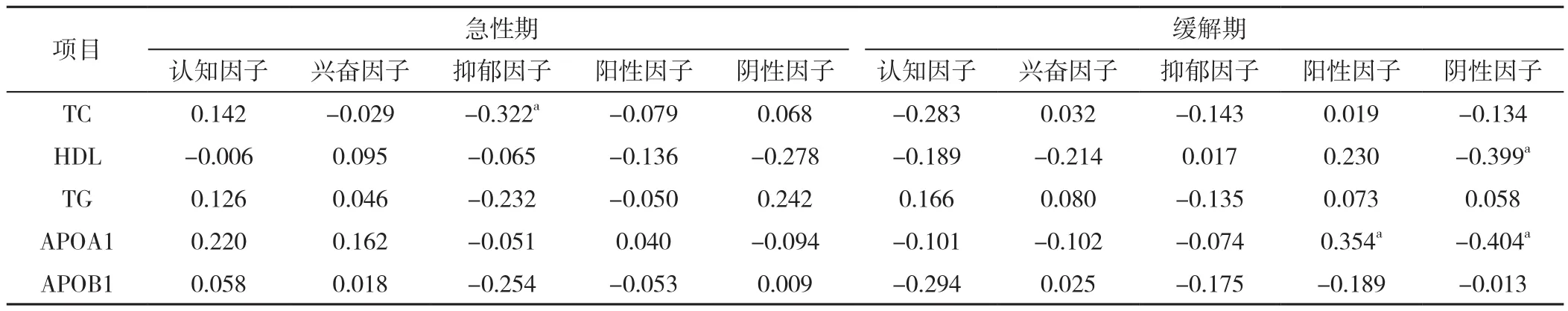
表4 急性期及缓解期精神分裂症患者血清脂代谢指标与PANSS评分的相关性分析(r值)Table 4 Correlation analysis of serum lipid levels and PANSS scale scores in schizophrenic patients at acute and remission stages
2.5 3组代谢组学分析结果
2.5.1 代谢物分布特征 LC-MS非靶向粪便样本代谢组学分析共测得化合物数量 24 536;PCA(Principle Component Analysis,主成分分析)显示,ABC 3组在主成分PC1和主成分PC2的组成上存在一定差异,可较好的在PCA得分图上进行分离,表明3组的肠道菌群代谢存在一定差异,提示急性期和缓解期精神分裂症患者的肠道菌群代谢与健康对照相比较发生了改变,见图1。
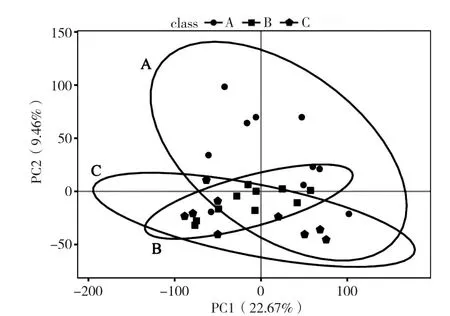
图1 主成分分析得分图Figure 1 Principal component analysis scores plot of the metabolic features in schizophrenic patients at acute and remission stages and healthy controls
2.5.2 代谢物组成和功能分析 将所得数据与KEGG、mzCloud、Chemspider、HMDB、Lipidmaps、BGI Library数据库进行匹配后共检测到标志性代谢物10 507种。菌群代谢物主要由具有生物作用的化合物(2 766种)、脂类(1 062种)、植物化学化合物(876种)及其他(794种)组成。与脂类代谢有关的包括脂肪酰基(454种)、聚酮化合物(189种)、甘油磷脂(157种)、甘油酯类(59种)、烯醇脂(27种)、鞘脂(27种)、甾醇脂类(14种)、糖脂代谢(2种),具体情况详见图2。
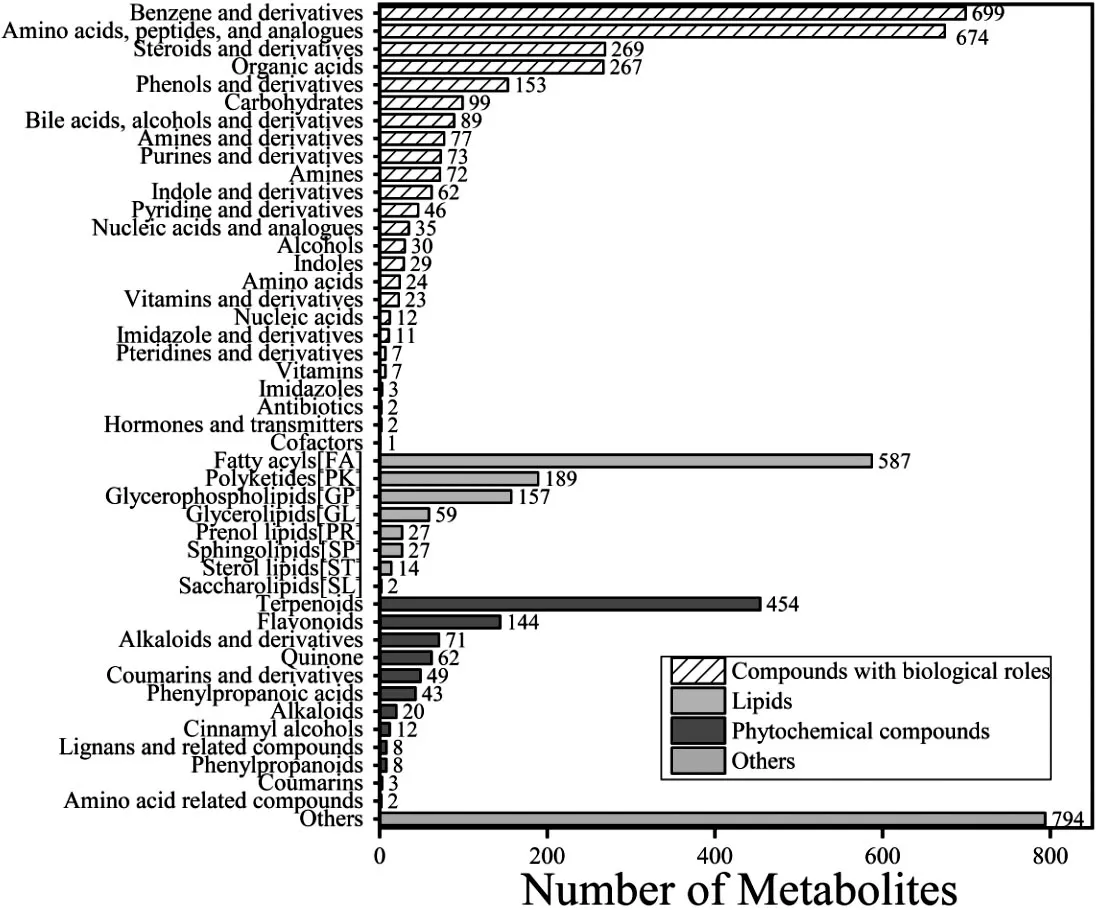
图2 代谢物分类条形图Figure 2 Bar chart of metabolite classification
2.5.3 差异代谢物分析 精神分裂症患者急性期(35条)、缓解期(52条)与健康对照组比较存在差异代谢通路。对与脂质代谢相关的通路进一步分析发现:精神分裂症患者与对照组相比在代谢途径、类固醇激素的合成、鞘脂代谢、皮质醇的合成与分泌、卵巢类固醇生成以及调节脂肪细胞中的脂肪代谢等脂质相关代谢通路存在差异(P<0.05);急性期精神分裂症患者肠道菌群代谢存在不饱和脂肪酸的生物合成(P<0.01)、亚油酸(P<0.01)和花生四烯酸(P<0.01)代谢通路异常,属于多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)代谢异常,见图3。
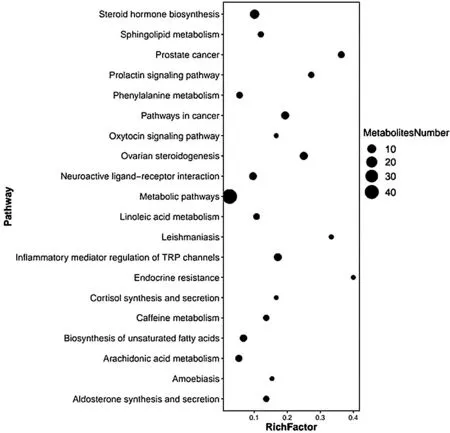
图3 代谢通路富集分析气泡图Figure 3 Bubble chart of enrichment analysis of metabolic pathway
3 讨论
精神分裂症沉重的疾病负担让无数患者和家庭不堪重负,积极寻求有效的治疗手段和改善患者预后显得尤为迫切。大量研究表明[14-15],脂质代谢异常是精神分裂症的一个重要特征,其不仅与疾病病理过程有关,也可能增加患者相关躯体疾病的发病风险。肠道菌群是宿主新陈代谢的中心调节因子,与多种神经精神疾病有关,可参与宿主的脂质代谢水平调节,有研究认为微生物对宿主脂质代谢的影响可能是通过肠道菌群的代谢产物所介导的[16]。本研究结果显示,健康人群HDL及APOA1水平高于精神分裂症急性期和缓解期患者,而缓解期患者TG水平高于急性期患者及健康人群。相关分析结果显示,急性期患者TC水平与PANSS的抑郁因子评分存在负相关,缓解期患者HDL及APOA1水平与PANSS的阴性症状评分存在负相关,且APOA1与缓解期PANSS的阳性症状评分存在正相关。进一步肠道菌群代谢组学分析结果提示,精神分裂症急性期及缓解期患者与健康人群相比,存在肠道菌群脂质代谢通路的改变,且急性期患者存在PUFA代谢途径的异常,该研究结果证实了精神分裂症患者不仅血清脂代谢水平存在异常,肠道菌群脂质代谢也存在异常。
既往研究发现,在精神分裂症患者中约有56.6%存在血脂水平异常[17],精神分裂症患者较正常人群TG水平升高,HDL和APOA1水平下降,TC水平则无显著变化[18-20],本研究结果与之相一致。国内学者李志君等[21]的研究发现,血清高TC水平可降低抑郁患者的抑郁情绪及其自杀风险,FANG等[22]的研究提示血清高TC水平和精神分裂症患者的抑郁症状存在相关性,本研究发现在精神分裂症急性期患者TC水平与PANSS的抑郁因子评分呈负相关。吴小立等[19]的研究发现早期精神分裂症患者就存在HDL和APOA1的代谢异常,VENKATASUBRAMANIAN等[23]的研究提示HDL和APOA1的代谢异常与精神分裂症的阴性因子评分呈负相关,本研究发现在精神分裂症缓解期患者中,HDL及APOA1水平与PANSS的阴性因子评分存在负相关的结果类似。进一步分析还发现APOA1与缓解期PANSS的阳性因子评分存在正相关。BOIKO等[24]的研究还发现精神分裂症患者载脂蛋白水平的异常与其代谢综合征发病机制密切相关。这些研究结果均高度提示血脂水平异常是精神分裂症患者的高危风险因素,在临床工作中要密切关注血脂水平的动态变化,及早进行干预。
大量的研究发现肠道菌群可借助微生物-宿主免疫轴的机制影响宿主脂质代谢水平[8,25-26],WANG等[26]的荟萃分析发现,有34种细菌与BMI及血脂水平显著相关,16S高通量测序检测中发现高TG和低HDL水平受试者的肠道菌群多样性降低,宏基因测序显示TG与66个基因簇相关,HDL与2个基因簇相关,其中梭状芽孢杆菌基因簇分别与血清HDL水平呈正相关、与TG水平呈负相关。本研究以肠道菌群代谢为切入点,不仅在PCA中显示精神分裂症急性期患者肠道菌群代谢物组分和其他两组存在差异,还发现急性期、缓解期患者与健康人群在类固醇激素的合成、鞘脂代谢、皮质醇的合成与分泌、卵巢类固醇生成以及调节脂肪细胞中的脂肪代谢等脂质代谢通路存在差异。近期的基础研究发现早期神经发育阶段PUFA缺乏会导致小鼠出现精神分裂症样表型[27],临床研究结果显示早期精神分裂症患者就存在脂质代谢紊乱,PUFA水平存在异常,并随着疾病病程波动[7,28-30],这些均提示PUFA与精神分裂症发病机制密切相关。同样本研究也发现在急性期不饱和脂肪酸生物合成、亚油酸和花生四烯酸代谢等PUFA代谢途径的异常。既往的大量研究均说明,PUFA不仅受饮食调控,还与炎性反应密切相关,可通过炎性机制调节脂肪因子从而介导血液中的TG、TC水平,在心血管疾病和代谢综合征等疾病的发病机制中具有重要作用[31]。因此,这些结果均为肠道菌群代谢和血脂代谢之间的联系提供了证据,也提示在今后的研究中要进一步关注两者间的交互作用。
综上所述,本研究发现不同时期精神分裂症患者存在部分血脂异常及肠道菌群脂质代谢异常,其中血脂水平的异常和疾病存在一定关联性。与正常对照组相比,急性期精神分裂症患者肠道菌群的PUFA代谢途径发生异常,这些结果提示血脂和肠道菌群代谢的异常可引起精神分裂症患者脂质代谢的紊乱,增加其代谢综合征的风险。因此,密切关注精神分裂症患者血脂水平及肠道菌群代谢状态对于精神分裂症患者的治疗和预后具有重要意义。
作者贡献:王中娴、苏虹、张许来进行文章的构思与设计;姚理慧、王中娴、张许来进行研究的实施与可行性分析;姚理慧、孟小靖、陈苑苑、程鹏、石丽、李经纬进行数据收集、整理;姚理慧进行统计学处理,结果的分析与解释,撰写论文,进行论文的修订;姚理慧、张许来负责文章的质量控制及审校;张许来对文章整体负责,监督管理。
本文无利益冲突。

