肝癌切除术后胸腔积液危险因素的Meta分析
罗林,陈浩,程永浪,高琳
[西南医科大学附属医院1.内镜医学部2.普通外科(肝胆)3.健康管理中心,四川泸州646000]
肝癌是全球第六大常见癌症,也是全球癌症相关死亡的第二大常见原因[1],且发病率仍然呈现上升趋势,到2030年将有超过100 万例死于原发性肝癌[2]。目前根治性肝切除术在肝癌的治疗中仍然占据首要地位[3]。胸腔积液作为一种常见的呼吸系统疾病,是肝切除术后常见并发症之一[4],发生率为18%~71%[5],严重影响患者呼吸、循环功能,增加患者痛苦,影响术后康复,降低生存质量。
目前,国内外对肝切除术后胸腔积液危险因素的研究中,术前、术中、术后危险因素均有报道,由于当前对肝切术后胸腔积液尚缺乏统一的认识以及系统的防治策略和标准。为有效预防肝切除术后胸腔积液,有必要针对其发生的危险因素进行具体分析。因此,本研究采用Meta 分析的方法,旨在评估肝切除术后并发胸腔积液与各种因素之间的关系,为临床识别高危人群,有效预防肝切除术后胸腔积液提供依据。
1 资料与方法
1.1 文献检索策略
参考从Pubmed、Web of Science、Cochrane Library、CNKI、万方数据库、VIP 数据库中以“肝切除术、肝癌、肝肿瘤、胸腔积液、胸水;Hepatectomy、Liver Resection、Hepatic Resection、Hepatocellular Carcinoma、Hepatic Carcinoma、Hepatic Cancer、Hepatic Tumor、Liver Carcinoma、Liver Cancer、Liver Tumor,Pleural Effusion、Hydrothorax、Pleural Fluid”为检索词,搜索已公开发表的中英文文献,检索时间为建库至2020年10月。
1.2 文献纳入排除标准
根据PEO-D 制定纳入标准,P(population):接受肝切除术的肝肿瘤患者;E(exposition):可能的危险因素;O(outcome):术后胸腔积液;D(design):病例对照研究。排除标准:⑴同时分析多种术后并发症但无法单独提取术后胸腔积液患者资料的研究;⑵重复发表的文献;⑶评论文章、Meta 分析、会议摘要等;⑷质量差可信度低的文献。
1.3 文献数据提取
由2 名研究人员独立提取所有纳入研究中的相关数据。包括以下信息:第一作者、发表年份、研究患者、研究地点、样本量、病例组和对照组人数。比较两次数据的结果,如有差异则再次核对并校正。
1.4 文献质量评价
由2 名评价者采用文献质量评价标准纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)[6]对文献从人群选择、可比性、暴露或结果评价等8 个条目进行独立评价,达成共识后纳入文献。
1.5 统计学处理
应用Cochrane Library 推荐的RevMan 5.3 软件进行统计分析。按要求进行数据整理,建立数据库。对符合纳入标准的文献进行异质性检验,可认为同质的情况:P>0.1 或I2≤50%,认为异质的情况:P≤0.1 或I2>50%,同质选择固定效应模型,异质选择随机效应模型。计算合并的OR/MD值及相应的95%CI。合并后P<0.05 为差异有统计学意义,该因素可考虑与术后发生胸腔积液相关。
2 结果
2.1 文献检索结果
共计检出相关文献1 227 篇。根据纳入和排除标准,通过阅读标题和摘要初步筛除后余下256 篇文献,进一步阅读全文,最终有13 篇文献[7-19],共5 422 例肝切除手术的肝肿瘤患者入选。其中胸腔积液1 262 例,对照组4 160 例(图1)。
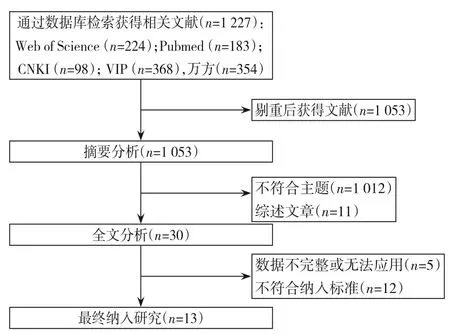
图1 文献筛选流程图Figure 1 Literature filtering process
2.2 纳入文献基本资料及质量评价
纳入文献的基本资料见表1。根据NOS 质量评价量表对纳入的13 篇文献进行质量评价。其中≥7 分的高质量文献有11 篇[8-9,11-19]。
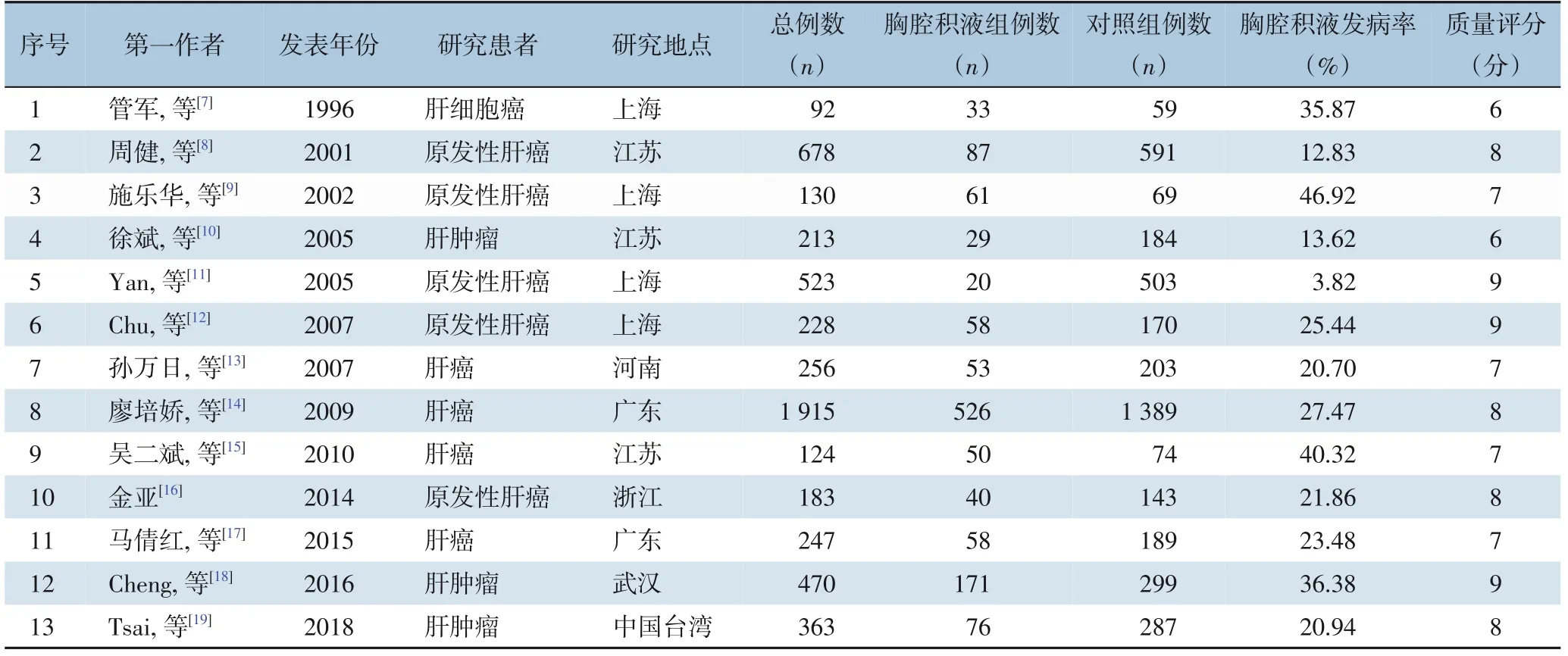
表1 纳入研究特征Table 1 Main characteristics of the included studies
2.3 纳入文献的研究因素及Meta分析结果
2.3.1 Meta 分析结果经过异质性检验,患者性别[13-15,18-19]、是否合并COPD[18-19]、是否合并HBV 感染[18-19]、是否合并HCV 感染[18-19]、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级[18-19]和是否饮酒[18-19]具有同质性,使用固定效应模型;年龄[7,14,19]、是否合并肝硬化[7,8,10-11,14,16,18-19]、是否合并糖尿病[18-19]、术前白蛋白[7,17,19],术前TBIL[14,17]、肝门阻断时间[7,9,12,16-18]、手术失血量[9,14,17-19]、肿瘤直径[12,17-18]、手术时间[14,17-19]、右肝肿瘤切除[8,10,14,16]、术后TBIL[14,16-17]、术后凝血酶原时间[16-17]、术后白蛋白[14,16-17]、是否合并术后腹水[7,11,13-14,16,18]具有异质性,使用随机效应模型(表2)。
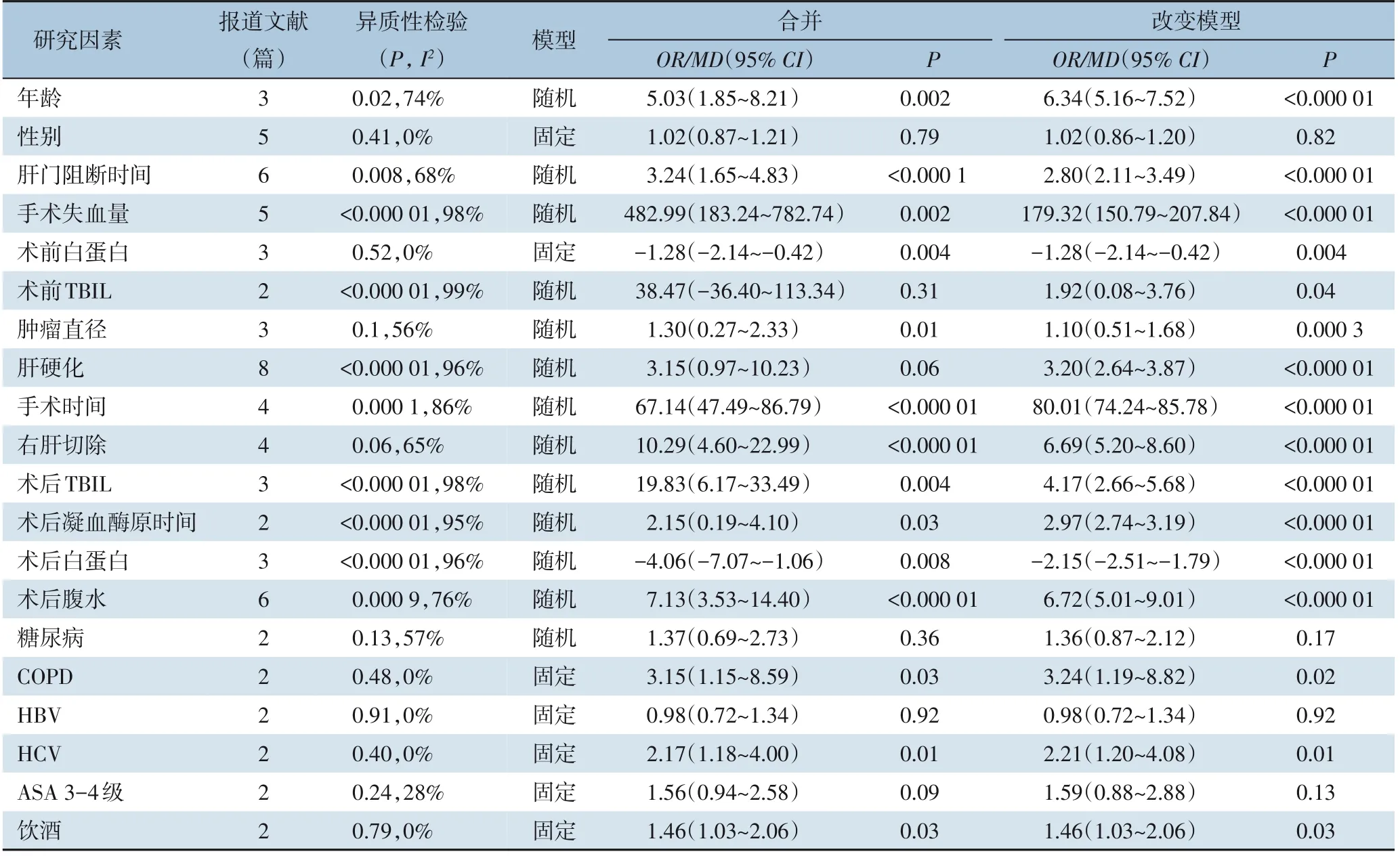
表2 肝切除术后胸腔积液危险因素Meta分析结果Table 2 Results of Meta-analysis on risk factors for pleural effusion after hepatectomy
2.3.2 各个因素对肝切除术后胸腔积液的影响⑴术前因素:Meta 分析结果表明,高龄[7,14,19]、术前血清白蛋白低[7,17,19]、肿瘤直径大[12,17-18]、有饮酒史[18-19]、合并COPD[18-19]和HCV 感染[18-19]的肝肿瘤患者术后胸腔积液的发病率高,差异均具有统计学意义(P<0.05)(图2)。不同性别[13-15,18-19]、不同术前TBIL[14,17]及有无合并肝硬化[7-8,10-11,14,16,18-19]、糖尿病[18-19]、HBV[18-19]患者肝切除术后胸腔积液发病率比较,差异均无统计学意义(P>0.05)。⑵术中因素:合并结果显示,除ASA 分级[18-19]外,肝门阻断时间[7,9,12,16-18]、失血量[9,14,17-19]、手术时间[14,17-19]、右肝肿瘤切除[8,10,14,16]等因素均影响肝肿瘤患者术后胸腔积液发病率,差异具有统计学意义(均P<0.05)(图3)。术后:术后TBIL[14,16-17]、术后凝血酶原时间长[16-17]、术后血清白蛋白水平低[14,16-17]、合并术后腹水[7,11,13-14,16,18]的肝肿瘤患者术后胸腔积液的发病率高,差异均具有统计学意义(P<0.05)(图4)。
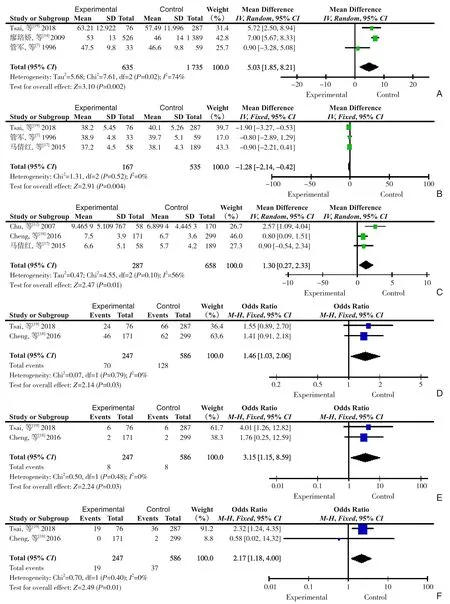
图2 术前因素与肝切除术后胸腔积液发生的Meta 分析森林图A:年龄;B:术前白蛋白;C:肿瘤直径;D:饮酒;E:慢性阻塞性肺疾病;F:丙型肝炎病毒Figure 2 Meta-analysis forest diagram of preoperative factors and occurrence of pleural effusion after hepatectomyA:Age;B:Preoperative albumin;C:Tumor diameter;D:Alcohol consumption;E:Chronic obstructive pulmonary disease;F:Hepatitis C virus
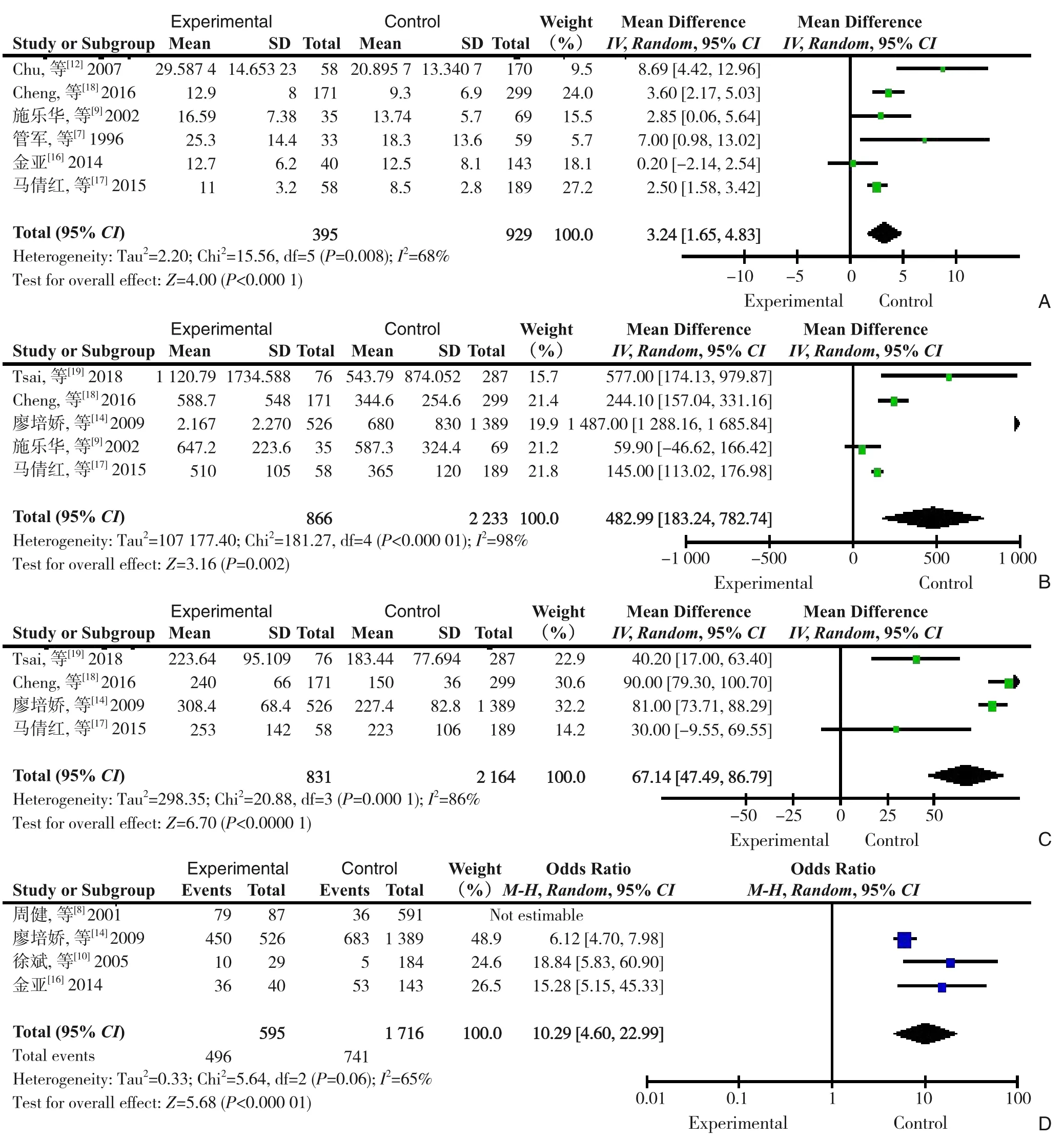
图3 术中因素与肝切除术后胸腔积液发生的Meta分析森林图A:肝门阻断时间;B:失血量;C:手术时间;D:右肝肿瘤切除Figure 3 Meta-analysis forest diagram of intraoperative factors and occurrence of pleural effusion after hepatectomyA:Hilar blockage time;B:Blood loss;C:Operative time;D:Right liver resection
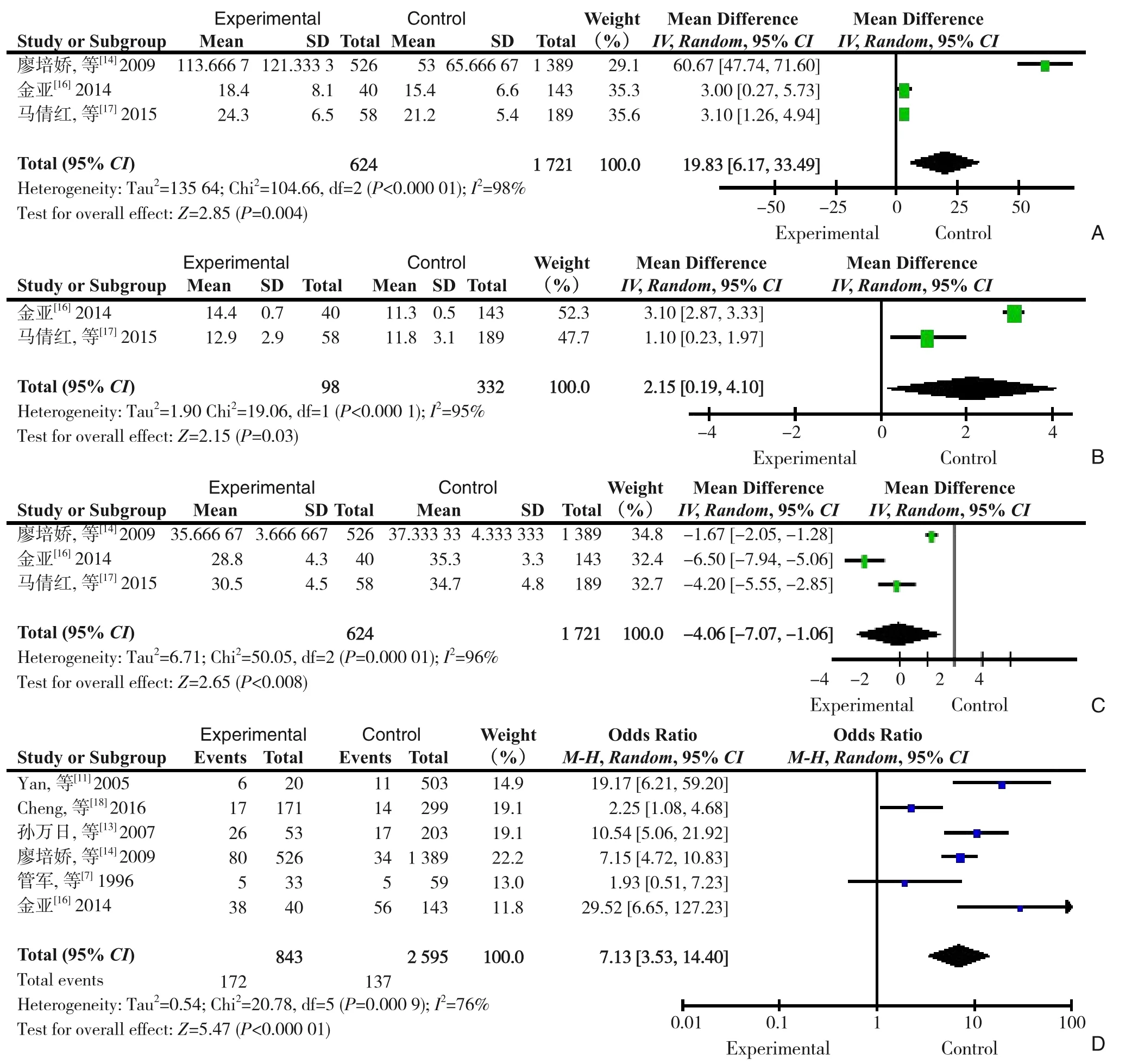
图4 术后因素与肝切除术后胸腔积液发生的Meta分析森林图A:术后TBIL;B:凝血酶原时间;C:术后白蛋白;D:腹水Figure 4 Meta-analysis forest diagram of postoperative factors and occurrence of pleural effusion after hepatectomy A:Postoperative TBIL;B:Prothrombin time;C:Postoperative albumin;D:Ascites
2.3.3 敏感度分析通过改变数据分析模型进行敏感度分析发现,术前TBIL[14,17]、是否合并肝硬化[7,8,10-11,14,16,18-19]、是否合并糖尿病[18-19]这3 个因素在变换模型后发生了实质性改变,说明分析结果不稳定。除此之外,其他因素的分析结果都较为稳定。
3 讨论
3.1 术前危险因素
结果显示高龄为肝切除术后并发胸腔积液的危险因素。随着年龄增长,人体对外界各种刺激因素的耐受力下降,在肝切除术后,胸腔中液体的渗出与感染、心功能不全、结核性胸膜炎、肿瘤等有关[20]。此外,存在COPD 基础疾病也是肝癌患者肝切术后胸腔积液的危险因素。研究发现饮酒与肝切除术后胸腔积液有关,与Sivanathan 等[21]的研究一致,肝硬化的主要病因是饮酒(52%),同时肝硬化并发症中,胸腔积液的发生率为14%,因此饮酒也会增加肝切除术后并发胸腔积液的风险。值得注意的是,本Meta 分析中HCV 作为肝切除术后胸腔积液的危险因素,与HBV 相比有明显差异(合并结果HCV:P<0.05;HBV:P>0.05)。这一结果与Utsunomiya 等[22]的研究一致,Utsunomiya等[22]纳入日本11 950 例肝细胞癌(hepatocellular Carcinoma,HCC)患者进行比较,结果显示HCVHCC 患者术后肝功能以及预后明显差于HBV-HCC患者。HCV-HCC 患者发生肝癌的年龄显著大于HBV-HCC 患者可能是出现这种差异的重要原因[23]。胸腔积液的发生或许与HCV 患者术后肝功能减低相关。术前肿瘤直径越大,则术后发生胸腔积液的风险越大,因其会对周围组织造成不同程度影响(侵犯刺激膈肌;向上的淋巴回流受阻;门-肺分流)[24],故术前肿瘤直径越大,切除后胸腔积液的发生率越高。肝切除术前低白蛋白血症是部分肝脏手术预后不良的独立危险因素[25],白蛋白水平被证明对手术结果、住院时间和术后并发症(瘘管、感染、伤口愈合和肺部疾病等)有重要影响[26-28]。综上,为减少术后胸腔积液发生率,建议术前评估患者身体状况,了解患者是否存在心血管、呼吸、消化等系统的疾病病史,术前行血清HBV-DNA、HCV-DNA 拷贝数等检查,并且在必要时行24 h 动态心电图或心脏超声检查。合并COPD的患者术前可在医师指导下进行深呼吸训练。此外,术前须禁止饮酒。
3.2 术中危险因素
右肝切除是肝肿瘤术后胸腔积液的危险因素,可能与人的右半肝体积大、重量重有关,生长在右肝大而软的肿瘤尤其难以处理,因为任何移动都会增加肿瘤破裂、出血和实质撕裂的风险[29]。与Hong 等[30]研究类似,在I、II 或IV 型肝门部胆管细胞癌中,左肝或右肝切除都是可选的手术方式,但相比之下,右肝切除需要更充分的术前支持、以及有着更高术后肝衰竭率,故胸腔积液发生与右肝切除有关。此外,手术时间延长作为肝肿瘤术后胸腔积液的危险因素,原因可能是较长手术时间增加了患者感染的风险,李斯特菌、芽孢杆菌、隐球菌等多种细菌感染会引发胸腔积液[31-33]。Chacon 等[34]研究表明,与单纯肝切除术相比,接受肝切除术并伴有胆道重建的患者手术时间明显延长(429 minvs.235 min,P<0.001)且感染并发症发生率较高(P<0.001),这也表明手术时间的延长与术后并发症密切相关。同样的肝门阻断时间也是肝肿瘤术后胸腔积液的危险因素,肝门阻断时间与肺损伤有联系,主要原因为肝门阻断结束后的再灌注阶段来源于肠道、肝脏的大量炎症因子致肺损伤[35],炎症环境中,发生胸腔积液的风险增大。失血量是肝肿瘤术后并发症的独立危险因素[36],与Kubota 等[37]的评估结果一致。Matsuo 等[38]的研究中,采用腔镜肝切除的患者术中失血量相对于开腹肝切除患者明显减少,同时术后并发胸腔积液的风险也更小,也能论证本研究结果。综上,术中有必要采取相应措施控制肝门阻断时间、手术时间、失血量等。
3.3 术后危险因素
术后腹水是胸腔积液的危险因素,这一结果与Mouroux 等[39]结果一致,与腹水经膈肌薄弱处破入胸腔有关,6 例肝硬化腹水合并胸腔积液的患者经胸腔镜膈肌缺损定位闭合后,均未出现复发胸腔积液(随访7~36 个月),另外2 例未经膈肌闭合处理的患者则均出现积液[38]。肝切除尤其是大肝切除(4 段或4 段以上切除)术后,易发生肝功能不全[40],白蛋白合成受限,由此可以证明术后白蛋白水平降低是肝切除术后胸腔积液的危险因素。TBIL 的代谢与肝功能密切相关,Uemura 等[41]基于20 例肝切除术后残余肝胆汁中TBIL 的分析结果与本研究正好相反,胆汁中TBIL 提示预后不良的临界值为60 mg/d,TBIL<60 mg/d 的5 例全部死亡,TBIL>60 mg/d 的15 例全部存活,这一结果或许与涉及的研究较少,研究样本及治疗质量存在差异有关。凝血酶原时间主要是反映术后肝功能的指标[42]。合并结果显示凝血酶原时间是肝切除术后胸腔积液的危险因素,其原因可能是术后肝功能不全。Yokoyama 等[43]的回顾性分析结果表明凝血酶原时间和TBIL 均是肝切除术后并发肝功能不全强有力的独立预测因子,其中的区别是TBIL 表现出更明显的升高,肝切除术后胆红素代谢能力相对于肝脏合成凝血因子的能力受到的影响更显著,进而说明了术后TBIL 与凝血酶原时间相比与胸腔积液的发生关系更紧密。综上,建议术后加强血液动力学维护[平均动脉压>100 mmHg(1 mmHg=0.133 kPa),有利于机体器官功能的保护],术后低白蛋白患者输注白蛋白。情况允许者,术后应减少卧床时间,早期进行康复训练。
3.4 不确定因素
肝硬化的不良反应对肝切除的结果有不利影响[44]。合并结果显示肝硬化无统计学意义,或许与本Meta 分析纳入病例有限相关,也不排除纳入数据的偶然性因素。文献[45]报道,糖尿病不仅增加了肝切除术后并发症的风险,而且降低了术后总体生存率。但在Liang 等[46]的回顾性研究中,表现出了相反的结果,糖尿病和(或)非酒精性脂肪性肝炎相关肝细胞癌患者肝切除术后得到了比其他肝细胞癌患者更良好的效果。因此,糖尿病作为肝切除术后胸腔积液的影响因素仍需大量病例深入研究。此外,合并结果显示术前TBIL 无统计学意义,术后TBIL 有统计学意义。研究[47]表明,门静脉栓塞后5~14 d TBIL 升高的患者,如果进行大肝切除术,则可能增加并发症发生率和术后30 d病死率。肝硬化、糖尿病和术前TBIL 合并结果无统计学意义,但在敏感度分析结果中,这3 个因素均表现出统计学的差异,故仍需慎重对待本研究中这3 个因素。
3.5 总结
本Meta 分析结果显示,肝切除术后并发胸腔积液已确定的危险因素包括:⑴术前:高龄、低血清白蛋白水平、肿瘤直径大、有饮酒史、合并COPD 和HCV 感染;⑵术中:肝门阻断时间、失血量、手术时间、右肝切除;⑶术后:TBIL 升高、凝血酶原时间长、低血清白蛋白水平、合并腹水。针对这些已确定的危险因素采取合理的围手术期干预措施,可以有效降低肝切除术后胸腔积液发生率。而术前TBIL、肝硬化、糖尿病是肝切除术后胸腔积液的不确定因素。需要警惕的是,合并肝硬化的患者更容易出现胸腔积液基本是临床中较为公认的现象,如Dinu 等[48]的研究结果证实了胸腔积液的产生与肝硬化有关,但在本Meta 分析结果中,肝硬化是不确定因素,可能受纳入研究质量及数量限制,有待后续研究来补充和证实。
3.6 局限性及展望
由于本研究中,纳入的病例来自武汉、广东、江浙地区及台湾地区,疾病诊断完整性、胸腔积液发生时间等没有统一规范。此外,各个医院肝癌肝切除采用的术式也有一定差异,因而肝切除术后并发症的预测因子也未统一。文章质量差异也会对本文结果产生影响。因此,针对肝癌患者肝切除术后并发胸腔积液的研究,有待未来大样本、更严谨的多中心随机对照试验来验证。

