珊瑚共附生DMSP降解菌的分离及其多样性分析
唐小玉,张颖,张文谦,张燕英,杨清松,董俊德,3,4
(1.中国科学院南海海洋研究所 热带海洋生物资源与生态重点实验室/广东省应用海洋生物学重点实验室,广东 广州510301;2.烟台大学 海洋学院,山东 烟台 264005;3.中国科学院海南热带海洋生物实验站,海南 三亚 572000;4.三亚中科海洋研究院 海南省热带海洋生物技术重点实验室,海南 三亚 572000;5.中国科学院大学 资源与环境学院,北京 100049)
1 引言
珊瑚礁是地球上生物多样性最高的生态系统之一,虽然全球珊瑚礁总面积只占全部海域的0.2%左右,但是却为大约30%的海洋生物提供栖息地和食物来源,同时为人类社会提供食物、药物、旅游、美学等方面的实际效益;另外,珊瑚礁在保护海岸和维持海洋生态系统碳、氮生物地球化学循环中发挥重要的作用[1]。然而,珊瑚礁生态系统非常脆弱,在过去的50年里,受人类活动(过度捕捞、农业污染、陆地径流)、全球变暖及海洋酸化等的影响,珊瑚死亡率急剧上升,导致珊瑚覆盖率大幅下降[2]。1998年和2010年的珊瑚暖化事件在全球范围内影响了48%的珊瑚礁[3–4];在第3次全球珊瑚白化事件期间(2014‒2017年)[5],所有热带珊瑚礁都经历了异常的海洋温度事件,这些事件以后可能每年都会发生。
珊瑚礁被认为是海洋天然硫酸盐的主要来源,珊瑚虫、共生藻和微生物都能够产生二甲基巯基丙酸内盐(dimethylsulfoniopropionate,DMSP)。DMSP 具有渗透压调节、化学引诱、抗氧化、冷冻保护等多种生物学功能[6]。DMSP是生源性气体二甲基硫(dimethyl sulfide,DMS)的前体物质,海洋中的 DMS主要由 DMSP降解产生。DMS在驱动全球硫循环和调节气候变化中具有重要作用,海洋中产生的DMS通过海−气扩散的方式进入大气后被氧化成硫酸盐,其氧化产物促进气溶胶的形成,从而增加了云凝结核的数量、提高了云层折射率、减少了地面热量收入,起到了减缓温室效应的作用[7]。高温会引起珊瑚共生体细胞活性氧自由基(Reactive Oxygen Species,ROS)过量释放,过量的ROS会氧化细胞膜、使蛋白变性并破坏核酸,进而对宿主细胞造成损伤,导致珊瑚的白化[8]。Sunda等[9]研究发现,DMSP的裂解产物DMS和丙烯酸等能够有效地捕获羟基自由基和ROS;并且,DMS能够扩散进入光合膜中,显著地增加细胞内水相和脂质膜相的抗氧化保护功能。高温胁迫下,珊瑚体内DMS和丙烯酸的浓度相应地降低,其可能参与到ROS的捕获中,表明DMSP及其降解产物在珊瑚抗逆反应中具有重要的作用[10]。
在海洋中,异养细菌是DMSP最主要的降解者[11],了解细菌降解DMSP的机制,对海洋中硫循环意义深远。海洋微生物对DMSP的降解主要通过两条途径:一条为去甲基化途径,DMSP经去甲基化反应生成3-巯基丙酸甲酯(MMPA),进一步转化为甲硫醇(MeSH),该途径不产生DMS;一条为裂解途径,DMSP在酶的作用下裂解产生DMS[12–13]。目前,研究者从红杆菌属(Rhodobacters)、玫瑰杆菌属(Roseobacters)、硫杆菌属(Sulfitobacter)和假单胞菌属(Pseudomonadales)菌株中鉴定出相关的DMSP裂解酶,包括DddP、DddY、DddQ、DddW、DddK和 DddL,其催化DMSP裂解产生DMS和丙烯酸;另一种DMSP裂解酶—DddD,催化DMSP裂解产生DMS和3-羟基丙酸,其常见于海洋单胞菌属(Marinomonas)[14–16]。
研究发现,某些珊瑚的共附生细菌具有降解DMSP的功能,并对珊瑚的健康发挥着重要作用。如Raina等[17]从多孔鹿角珊瑚(Acropora millepora)和瘿叶表孔珊瑚(Montipora aeqituberculata)中分离出能够降解DMSP的细菌,这些细菌大都来自于γ-变形菌纲(Gammaproteobacteria);并且 DMSP 的降解产物能够影响珊瑚微生物群落结构,对珊瑚的健康具有重要作用。Tandon等[18]通过比较基因组学发现,Endozoicomonas acroporae可以降解DMSP为DMS,使珊瑚避免受到溶珊瑚弧菌(Vibrio coralliilyticus)的侵害—溶珊瑚弧菌利用DMSP作为信号分子寻找高温胁迫下的珊瑚,而DMS不能作为其信号分子[19]。珊瑚共附生DMSP降解菌使得海洋中DMS浓度增加,更多的DMS通过海−气扩散进入大气,对气候调节起到了重要的作用。
目前,有关珊瑚共附生DMSP降解菌的研究还相对较少,鉴于珊瑚共附生DMSP降解菌在珊瑚应对高温胁迫及气候调节上的重要作用,本文利用纯培养技术从多孔鹿角珊瑚(Acropora millepora)、美丽鹿角珊瑚(Acropora formosa)、指状鹿角珊瑚(Acropora digitifera)、多棘鹿角珊瑚(Acropora echinata)、鹿角杯形珊瑚(Pocillopora damicornis)和丛生盔形珊瑚(Galaxea fascicularis)中分离筛选 DMSP降解菌,探索DMSP降解菌在6种珊瑚中的多样性与分布特征,并通过火焰光度检测器−气相色谱联用技术分析DMSP降解菌的DMS生产能力,以填补国内关于珊瑚共附生DMSP降解菌研究的空缺。
2 材料与方法
2.1 材料
鹿回头岸礁(长约为 3 km、宽为 250~500 m)位于海南岛南岸,毗邻三亚市区,1990年被划入三亚国家级珊瑚礁自然保护区。过去50年来,受人类活动的影响,鹿回头岸礁珊瑚群落组成多样性严重下降,活珊瑚覆盖率从约85%下降至12%左右[20]。此外,全球变暖导致鹿回头岸礁海域水温升高,使该海域多数珊瑚物种长期处于温度胁迫状态[21]。样品采集于2019年9月11日和2019年9月22日进行。
2.1.1 样品采集
6 种珊瑚样品采自三亚鹿回头岸礁(18°12′19′N,109°28′27′E)1.5~2 m 水深处,每种珊瑚采集 3 个重复样本,直径为10~15 cm。采集的样品放置于温度为28℃、光照强度为200 μmol/(m2·s)的养殖缸中暂养2 d,之后开展珊瑚共附生DMSP降解菌的分离筛选实验。
2.1.2 培养基
改良基础营养盐培养基的配方[22]:基础盐溶液[MgSO4·7H2O,2 g;CaCl2,0.57 g;Fe-EDTA,0.295 g;微量元素母液(MnSO4·H2O,1.790 g;H3BO3,2.8 g;CuSO4·5H2O,0.079 g;ZnSO4·7H2O,0.24 g;Na2MoO4·2H2O,1.26 g;ddH2O,100 mL),1 mL;ddH2O,100 mL],5 mL;维生素溶液(维生素 B12,2 mg;p-氨基苯酸、核黄素、维生素B6、烟酸 B5、维生素 C、维生素 B1、D-(+)-生物素,各10 mg;ddH2O,1 L),0.5 mL;(NH4)2SO4,0.33 g;NaCl,0.585 g;酵母提取物,0.05 g;蒸馏水,500 mL;灭菌前培养基pH调至6.4,灭菌后培养基pH用磷酸盐缓冲液调至6.8。固体培养基加入9 g琼脂,其中磷酸盐缓冲液单独灭菌。
甜菜碱或DMSP为唯一碳源改良基础营养盐培养基:基础盐溶液,5 mL;维生素溶液,0.5 mL;(NH4)2SO4,0.33 g;NaCl,0.585 g;甜菜碱或 DMSP,终浓度 5 mmol/L;蒸馏水,500 mL;灭菌前pH调至6.4,灭菌后pH用磷酸盐缓冲液调至6.8。固体培养基加入9 g琼脂,其中DMSP使用孔径为0.22 μm的滤器单独抽滤灭菌。
2.2 方法
2.2.1 DMSP 降解菌的分离筛选
初筛:截取10 g左右的珊瑚样品,无菌海水冲洗2~3次以除去珊瑚表面非共附生微生物。将冲洗后的珊瑚样品包裹于灭菌锌箔中,锤子砸碎匀浆,转移至50 mL无菌离心管,加入20 mL灭菌海水混匀,得到珊瑚母液,每次处理1个珊瑚样品以避免不同珊瑚样品之间的污染。取100 μL母液于200 mL改良基础营养盐液体培养基中进行富集培养,摇床温度为28℃、转速为 180 r/min,培养时间为 4 d。培养液出现浑浊后,吸取 0.5 mL 稀释得到 10−1~10−5浓度梯度稀释液,取 200 μL 10−5浓度稀释液涂布至以甜菜碱为唯一碳源的改良基础营养盐固体平板上,28℃条件下培养4 d。挑取平板上的单菌落,采用三区划线法接种于新的平板,培养4 d后进一步划线纯化,直至平板上各菌落的颜色、形态一致。
复筛:将初筛获得的菌株接种于以DMSP为唯一碳源的改良基础营养盐固体平板上,观察其是否能够生长。
2.2.2 16S rRNA 基因扩增
用试剂盒 Bacterial DNA Kit(OMEGA,美国)提取细菌基因组 DNA。引物27 F(5′-GAGTTTGATCMTGGCTCAG-3′)和 1492 R(5′-GGTTACCTTGTTACGAC TT-3′)用于扩增 16S rRNA基因,PCR反应条件为:95℃ 预变性 4 min;95℃ 变性 15 s,56℃ 退火 30 s,72℃延伸 1.5 min,循环 35 次;最后 72℃ 延伸 10 min。扩增体系为:rTaq DNA 聚合酶(takara,大连宝生物)12.5 μL,正反向引物各 0.5 μL,细菌 DNA 1 μL,无菌去离子水补足25 μL。PCR产物用琼脂糖凝胶电泳检测,条带清晰的送广州天一辉远基因科技有限公司进行测序。
2.2.3 菌株鉴定及系统发育树构建
通过Chromas软件查看16S rRNA基因测序获得的峰图,将单一无套峰的16S rRNA基因序列(长约为1 300 bp)导入 NCBI数据库进行 BLAST 同源性比对,获得最相似种属并确定其分类地位。下载相似度最高的菌株的16S rRNA基因序列,通过ClustalW进行多序列比对,利用MEGA 7.0软件采用邻接(Neighborjoining)法构建系统发育树,其中替换模型选择Kimura双参数(Kimura 2-parameter)模型,用于检验支持率的重复抽样次数为1 000次。
2.2.4 DMS 浓度检测
采用吹扫捕集−冷阱富集气相色谱法测定DMS浓度。筛选菌株于含有5 mmol/L甜菜碱的改良基础营养盐液体培养基中预培养至OD600值为0.3左右;取 300 μL 菌液加入到含有 2 mL 5 mmol/L DMSP 改良基础营养盐液体培养基的进样瓶中,另设空白对照,于 28℃、180 r/min 条件下培养 48 h[23]。用高纯氮气将培养基中的DMS进行吹扫,吹扫出的DMS被捕集在浸泡于液氮中的聚四氟乙烯环形管中;捕集到的气体使用90℃热水加热解析,注入装有长为3 m、直径为3 mm的玻璃柱子和火焰光度检测器的气相色谱(安捷伦7890A,美国)中进行检测,玻璃柱子中填充有10% DEGS、Chromosorb W-AW-DMCS 混合物。该方法的检出限约为 0.4 nmol DMS[24–25]。
3 结果
3.1 DMSP 降解菌 16S rRNA 序列多样性分析
从6种珊瑚中共分离获得DMSP降解菌39株,通过16S rRNA基因测序进行分类学鉴定,隶属于4个门、6个纲、19个属。其中,21株隶属于变形菌门(Proteobacteria),包括 α-变形菌纲(Alphaproteobacteria)9株、γ-变形菌纲 12株;13株隶属于厚壁菌门(Firmicutes),4株隶属于放线菌门(Actinobacteria),1株隶属于异常球菌−栖热菌门(Deinococcus-Thermus)(图 1)。优势属为芽孢杆菌属(Bacillus),共10株,占比为25.6%;其次为弧菌属(Vibrio),共7株,占比为17.9%。从鹿角杯形珊瑚分离获得的DMSP降解菌最多,共10株,隶属于7个属;其次为丛生盔形珊瑚,共7株,隶属于7个属。4种鹿角珊瑚中,从多孔鹿角珊瑚分离获得的DMSP降解菌最多,7株,隶属于6个属;其次为美丽鹿角珊瑚,6株,隶属于5个属;指状鹿角珊瑚共附生DMSP降解菌有5株,隶属于4个属;多棘鹿角珊瑚共附生DMSP降解菌最少,共4株,隶属于3个属。从多孔鹿角珊瑚、美丽鹿角珊瑚和鹿角杯形珊瑚分离获得的DMSP降解菌均以芽孢杆菌属为主;从多棘鹿角珊瑚分离获得的DMSP降解菌以不动杆菌属(Acinetobacter)为主;从指状鹿角珊瑚分离获得的DMSP降解菌以弧菌属为主(表 1)。

图1 DMSP 降解菌分类信息Fig.1 Taxonomic information of DMSP degrading bacteria
3.2 系统发育树的构建
将DMSP降解菌的16S rRNA基因序列导入NCBI进行BLAST同源性比对,并下载同源性最高的序列进行ClustalW多序列比对分析,选择Kimura双参数模型采用邻接法构建系统发育树(图2)。从图2中可以看出,39株DMSP降解菌形成3个大的分支,菌株Pd3单独为一支,剩下的38株菌形成两个分支。筛选获得的39株菌,10株与芽孢杆菌属聚为一支,相似度最高为100%;7株与弧菌属聚为一支,相似度最高为99.93%;2株与赤杆菌属(Erythrobacter)聚为一支,相似度为99.48%;2株与不动杆菌属聚为一支,相似度最高为99.79%;2株与微杆菌属(Microbacterium)聚为一支,相似度最高为99.28%;2株与类芽孢杆菌属(Paenibacillus)聚为一支,相似度最高为98.96%;2株与Fulvimarina聚为一支,相似度最高为99.78%;剩下的12株各单独聚为一支。

图2 DMSP 降解菌株系统发育树Fig.2 The phylogenetic tree of DMSP degrading bacteria
3.3 DMS 浓度检测结果分析
将筛选获得的菌株接种到含有5 mmol/L DMSP的改良基础营养盐液体培养基中,28℃、180 r/min条件下培养48 h后,使用火焰光度检测器−气相色谱联用技术检测DMSP降解产物DMS。结果显示,可以降解DMSP产生DMS的菌株有20株,分别为Ad1、Ad2、Ad3、Ae1、Ae2、Ae3、Af1、Af2、Am1、Am2、Am3、Am4、Gf1、Gf2、Gf3、Gf4、Gf5、Pd1、Pd2、Pd3,产量为 3.759~16.240 μmol/L;其中,有 9 株菌产 DMS能力较强,分别为 Ad1、Ad2、Ad3、Ae1、Af2、Am4、Pd1、Pd2、Pd3,产量分别为 11.826 μmol/L、16.185 μmol/L、16.240 μmol/L、15.220 μmol/L、13.843 μmol/L、10.473 μmol/L、9.430 μmol/L、9.976 μmol/L、9.265 μmol/L(图 3)。所筛选获得的DMS产生菌株中,有3株来源于指状鹿角珊瑚、3株来源于多棘鹿角珊瑚、2株来源于美丽鹿角珊瑚、4株来源于多孔鹿角珊瑚、5株来源于丛生盔形珊瑚、3株来源于鹿角杯形珊瑚。
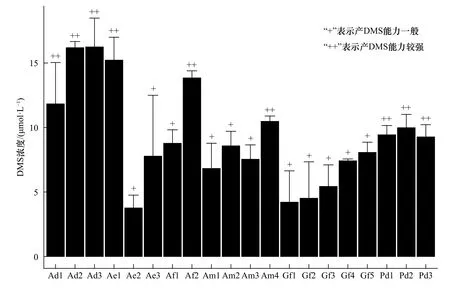
图3 DMSP 降解菌株 DMS 产量柱形图Fig.3 Histogram of DMS production of DMSP degrading bacteria
4 讨论
大型有机体与微生物的共生有助于其对不断变化的环境条件的适应,对宿主的健康和进化具有重要作用[26]。在珊瑚礁生态系统中,共生细菌为珊瑚宿主提供营养物质,并通过占用生态位和分泌抗菌化合物保护珊瑚不受致病菌的侵害[27–29]。尽管珊瑚共附生DMSP降解菌对珊瑚健康意义重大[17],但有关珊瑚共附生DMSP降解菌的研究还相对较少。本研究利用纯培养技术首次分离筛选三亚鹿回头6种造礁石珊瑚共附生DMSP降解菌,并对其多样性及降解特性进行了分析。早期研究发现[30],珊瑚共附生DMSP降解菌主要来自于变形菌门,且大多分布于α-变形菌纲与γ-变形菌纲[11]。本研究获得9株α-变形菌纲菌、12株γ-变形菌纲菌,其中橙单胞菌科(Aurantimonadaceae)、红杆菌科(Rhodobacteraceae)、海洋螺菌科(Oceanospirillaceae)和弧菌属在先前的研究中已被证实可降解 DMSP[31–33];然而,玫瑰单胞菌属(Roseomonas)、鞘脂单胞菌属(Sphingomonas)、赤杆菌属、Thalassotale、甲基杆菌属(Methylobacterium)、副球菌属(Paracoccus)和不动杆菌属首次被发现具有降解DMSP的能力。珊瑚共附生微生物群落组成具有时间和空间上的差异性,并且不同珊瑚物种具有独特的微生物群落多样性[34],新的DMSP降解菌的发现不足为奇。Wagner和Stadtman[35]早在1962年首次发现了厚壁菌门中可降解DMSP的菌株,并指出该菌株隶属于梭菌属(Clostridium)。本研究中,芽孢杆菌属、类芽孢杆菌属和鲁梅尔芽孢杆菌属(Rummeliibacillus)被证明也具有降解DMSP的能力,这扩大了厚壁菌门中可降解DMSP菌株的范围。放线菌门细菌是常见的珊瑚共附生菌,其可通过产生重要的次生代谢产物保护珊瑚的健康[36]。林钰等[37]从马里亚纳海沟沉积物中分离获得来自于放线菌门的菌株,并通过DMSP降解能力测定发现某些微杆菌属、微球菌属(Micrococcus)细菌可降解DMSP。本研究分离获得来自于微杆菌属、微球菌属的DMSP降解菌,这与林钰等的研究结果相一致。此外,本研究获得1株隶属于异常球菌−栖热菌门的DMSP降解菌,首次证明异常球菌−栖热菌门菌株具有降解DMSP的能力。假单胞菌属(Pseudomonas)为典型的珊瑚共生菌并被发现具有降解DMSP的能力[17];本研究未获得该属的菌株,分析其原因可能是由于本次研究样品处理过程中黏液丢失过多,而假单胞菌属细菌主要存在于珊瑚黏液中[38]。
相关研究表明[39],50%~90%的DMSP通过去甲基化途径转化为MMPA,剩余部分的DMSP通过DMSP裂解酶转化为DMS和丙烯酸。通过去甲基化途径降解DMSP的细菌多发生于玫瑰杆菌属(Roseobacter)[40],然而本研究未获得来自于该属的菌株。Newton等[41]研究发现,相比于可培养细菌,通过去甲基化途径降解DMSP的玫瑰杆菌属细菌多为不可培养细菌,这为本研究未获得玫瑰杆菌属细菌提供了解释。能够降解DMSP产生DMS的细菌多来自于玫瑰杆菌属、红杆菌属(Rhodobacter)、海洋单胞菌属及硫杆菌属(Sulfitobacter)等[42]。Curson 等[14]发现Fulvimarina菌株含有dddL基因,并证明该菌株具有产DMS能力。本研究筛选获得的39株DMSP降解菌中,有20株菌的降解产物中可检测到DMS,表明其通过裂解途径降解DMSP,剩余19株菌通过去甲基化途径降解DMSP,这与文献中报道的不同DMSP降解途径占比相符合。本研究获得的9株高产DMS菌株中,有3株分别来自于α-变形菌纲中的Fulvimarina、鞘脂单胞菌属和赤杆菌属,表明α-变形菌纲中DMS产生菌有广泛的分类地位。此外,微杆菌属、芽孢杆菌属、类芽孢杆菌属和不动杆菌属细菌在本研究中也被发现具有高产DMS的能力,这进一步扩大了可降解DMSP产生DMS的菌株的范围。孙浩等[43]研究发现,可降解DMSP的硫杆菌属细菌多分布于深层水体,本次研究样品采集多位于浅层水体,这可能是导致未获得硫杆菌属DMSP降解菌的主要原因。Zhang等[44]对鹿回头海域4种珊瑚的共附生微生物的功能基因进行了研究,发现Thalassiobium等菌株具有dmdA基因。然而,在其他区域的珊瑚礁生态系统中,并未发现珊瑚共附生Thalassiobium菌株具有降解DMSP的功能,表明不同区域的珊瑚共附生DMSP降解菌存在差异,这为本研究获得的DMSP降解菌与前人有所差别提供了解释。此外,本研究以甜菜碱为唯一碳源的改良基础营养盐培养基对DMSP降解菌进行初筛,导致能够利用DMSP而不能利用甜菜碱的潜在菌株的遗失,这可能是本研究未获得前人所报道的DMSP降解菌株的重要原因。
目前,有关珊瑚益生菌的研究越来越受到科学家的关注,如Rosado等[45]通过向珊瑚接种益生菌而增加了珊瑚对白化的抵抗力。DMSP是影响细菌趋化作用的重要化学因子,Garren等[19]发现,溶珊瑚弧菌对DMSP具有一定的趋化反应,这对于其致病性具有关键意义。珊瑚共附生DMSP降解菌对DMSP的降解减少了溶珊瑚弧菌对珊瑚的侵害,有力地促进了珊瑚的健康。虫黄藻产生的DMSP主要存在于囊泡、叶绿体和细胞质中,其不仅为重要的细菌趋化因子,并对珊瑚微生物群落结构有着重要的影响[46]。由于珊瑚微生物群落结构与珊瑚健康密切相关[47],珊瑚共附生DMSP降解菌通过降解DMSP影响珊瑚微生物群落结构进而间接影响珊瑚健康。DMS产生菌降解DMSP产生DMS和丙烯酸[13],捕获珊瑚因高温胁迫产生的ROS[8],减少了ROS对珊瑚的损伤,极大地促进了珊瑚对全球气候变暖的响应。DMSP降解菌代谢 DMSP 产生原二植酸(Tropodithietic Acid,TDA),有效抑制了珊瑚致病菌—溶珊瑚弧菌和欧式弧菌(Vibrio owensii)的生长[48]。这些研究表明,珊瑚共附生DMSP降解菌为重要的珊瑚益生菌;然而,有关珊瑚共附生DMSP降解菌的益生效应验证实验目前尚缺乏。本研究提出的多种DMSP降解菌作用机制,为以后开展DMSP降解菌对珊瑚的益生效应验证实验奠定了理论基础。
5 结论及展望
通过以DMSP为唯一碳源的选择性改良基础营养盐培养基,从三亚鹿回头岸礁6种造礁石珊瑚中分离获得共附生DMSP降解菌39株,分布于19个属。其中,21株菌来自于变形菌门,13株菌来自于厚壁菌门,4株来自于放线菌门,1株来自于异常球菌−栖热菌门。6种珊瑚中,从鹿角杯形珊瑚中筛选获得的共附生DMSP降解菌最多,其次为丛生盔形珊瑚。所选的4种鹿角珊瑚中,多孔鹿角珊瑚的共附生DMSP降解菌最多,多棘鹿角珊瑚共附生DMSP降解菌最少。所获得的菌株中,20株具有产DMS的潜力,9株具有高产DMS的能力。本研究获得的DMSP降解菌在不同的珊瑚物种之间出现了部分重叠。本研究只关注了6种珊瑚共附生DMSP降解菌的多样性分布特征及降解特性,没有探讨DMSP降解菌对珊瑚应对高温胁迫是否具有益生作用,后续研究可以进行相关实验验证DMSP降解菌是否可以协助珊瑚应对高温胁迫,为三亚鹿回头海域的珊瑚保护提供参考。
致谢:感谢中国科学院烟台海岸带研究所张升辉老师的技术支持;感谢中国科学院海南热带海洋生物重点实验站为本研究提供实验平台。

