肿瘤坏死因子-α、肿瘤坏死因子受体与正常白蛋白尿2型糖尿病肾病患者肾功能的相关性
吴晓光
(郑州阳城医院 肾内科,河南 郑州 452470)
微量白蛋白尿是糖尿病肾病(diabetic nephropathy,DN)的早期临床体征,随着病情发展可出现大量白蛋白尿,引起肾小球滤过率(estimated glomerular filtration rate,eGFR)降低,最终导致终末期肾脏病(end stage renal disease,ESRD)。有研究表明,在出现白蛋白尿前,10%~30%的1型和(或)2型糖尿病患者eGFR已低于60 mL·min-1·1.73 m-2,这使得糖尿病肾病的诊断需要重新定义[1]。研究发现,患有正常白蛋白尿的糖尿病肾病(diabetic nephropathy with normal proteinuria,NA-DKD)患者主要为老年女性,其视网膜病变发生率较低[2]。此外,慢性炎症、动脉粥样硬化以及肾小管间质或血管损伤已被证明在NA-DKD的病理生理发展过程中起关键作用。但是,关于NA-DKD诊断的特征性生物标志物尚少见报道。本研究选取了血清骨保护素(osteoprotegerin,OPG)、血浆脑钠肽(brain natriuretic peptide,BNP)、心-踝血管指数(cardio-ankle vascular index,CAVI)等心血管疾病标志物,肾小管损伤和炎症[血清肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、血清肿瘤坏死因子受体1(tumor necrosis factor receptor1,TNFR1)]标志物,探讨其与2型糖尿病白蛋白尿患者eGFR之间的关联。
1 资料与方法
1.1 一般资料选取2017年2月至2020年5月郑州阳城医院收治的314例2型糖尿病患者作为研究对象,纳入研究人群的平均年龄(64.5±13.7)岁,166例(52.9%)患者为男性,eGFR中位数为72(61~85)mL·min-1·1.73 m-2。本研究经郑州阳城医院医学伦理委员会批准。
1.2 选取标准(1)纳入标准:符合美国糖尿病学会(American Diabetes Association,ADA)制定的糖尿病医学诊疗标准。(2)排除标准:① 1型糖尿病或其他类型的糖尿病;②微量白蛋白尿;③大量白蛋白尿;④未接受眼底镜检查;⑤血生化资料不完整。
1.3 资料收集记录所有患者基线资料和临床特征。采用戴维斯分类法将糖尿病性视网膜病变分为增生前、增生或未增生。既往心血管疾病定义为冠状动脉或外周动脉血运重建史、既往心肌梗死或中风史。患者入院时采集血清样品,-80 ℃保存备用。采用酶联免疫吸附测定法测量TNF-α、血清TNFR1和血清肿瘤坏死因子受体2(tumor necrosis factor receptor 2,TNFR2)和OPG。常规实验室方法测量BNP、尿液肝型脂肪酸结合蛋白(liver-type fatty acid-binding protein,L-FABP)。非高密度脂蛋白胆固醇(non-high-density lipoprotein cholesterol,non-HDL-C)定义为总胆固醇减去HDL-C的差。采用免疫比浊法和酶法定量检测尿白蛋白和肌酐(creatinine,Cr),并计算尿白蛋白与肌酐的比值(ratio of urinary albumin to creatinine,ACR)。使用VaSeraVS-1500A血管筛查系统测量CAVI。

2 结果
2.1 基线资料比较根据eGFR分类的2型糖尿病研究患者的基线特征[eGFR <60(NA-DKD)比≥60(No-CKD)(mL·min-1·1.73 m-2)]。NA-DKD组年龄较大,糖尿病病史更长,既往CVD发生率更高,尿酸水平更高,且具有更低水平的DBP、HDL-C和血红蛋白水平。此外,NA-DKD组的CAVI、BNP、OPG、TNF-α、TNFR1和TNFR2水平高于No-CKD组,差异有统计学意义(P<0.05)。见表1。
2.2 ACR、eGFR与生物标志物之间的相关性分析ACR与L-FABP(r=0.35,P<0.001)、BNP(r=0.15,P<0.01)、TNFR1(r=0.14,P<0.05)及CAVI(r=0.15,P<0.01)正相关。比较之下,eGFR与BNP(r=-0.39,P<0.001)、OPG(r=0.22,P<0.001)、TNF-α(r=0.25,P<0.001)、TNFR1(r=-0.47,P<0.001)、TNFR2(r=-0.48,P<0.001)及CAVI(r=0.32,P<0.001)呈负相关。另外,TNF-α和TNFR标志物之间呈正相关,两个TNFR之间的相关系数为0.90(P<0.001),存在多重共线性,并且两个TNFR与TNF-α呈正相关(TNFR1:r=0.45,P<0.001;TNFR2:r=0.49,P<0.001)。见表2。

表2 ACR、eGFR与生物标志物之间的Pearson相关性分析(r)
2.3 肾功能降低的多元logistic风险回归模型分析多元logistic回归分析的结果,以是否发生肾功能降低(赋值eGF<60 mL·min-1·1.73 m-2=1,eGFR≥60 mL·min-1·1.73 m-2=0)为因变量,将年龄、性别、尿酸、DBP和血红蛋白作为协变量加入模型中评估了生物标志物对NA-DKD风险的影响。结果显示,除TNF-α和TNFR外其他生物标记物均无统计学意义(P>0.05)。为了进一步评估TNF-α和TNFR评估NA-DKD的独立作用,建立了模型2和模型3,结果显示,在患有2型糖尿病白蛋白尿的患者中升高的TNFRs而不是TNF-α与肾功能降低密切相关(P<0.05)。见表3。
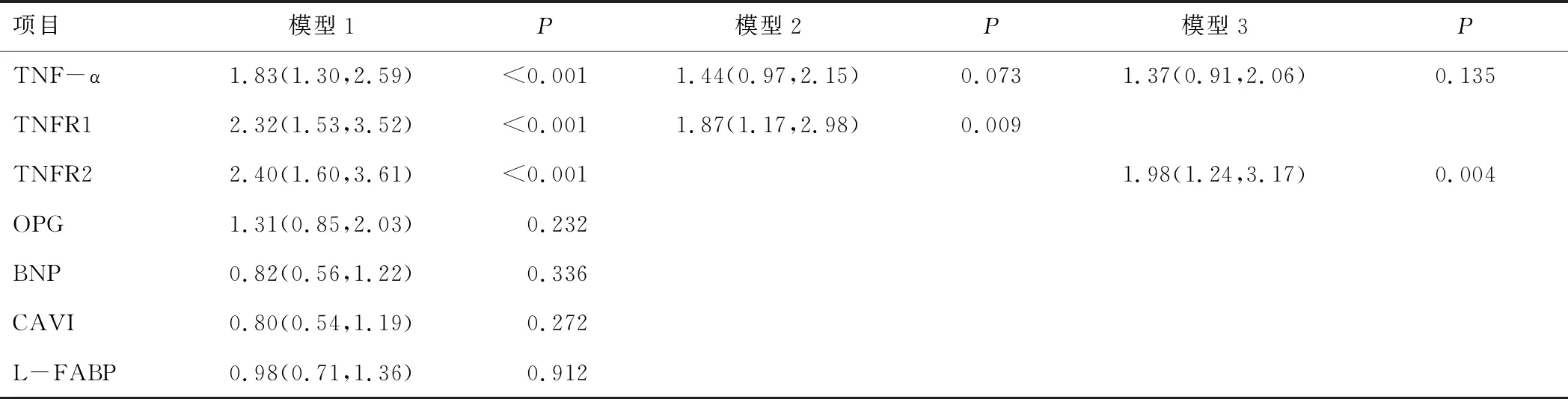
表3 多因素logistic比例风险回归模型分析
3 讨论
CAVI与2型糖尿病白蛋白尿患者肾功能的关联。动脉硬化是心血管疾病发生的重要预测因子,并且与肾功能降低和蛋白尿的发生密切相关。本研究中使用CAVI来评估动脉硬度,与臂踝脉搏波速度等指标比较CAVI受血压影响更小,因此准确性更高。此外,CAVI也是心血管疾病的有效预测因子,CAVI水平变化可以预测冠心病患者不良心血管事件。本研究结果显示,NA-DKD组CAVI高于非CKD组,相关性分析显示CAVI与ACR、EGFR两种肾功能指标相关。即使对相关临床协变量及生物标记物进行调整后,ACR仍然与CAVI存在相关性。这些结果表明,CAVI和ACR存在相关性,即使是正常白蛋白尿患者。但是,多因素分析中未发现CAVI与肾功能降低存在显著性。
OPG与2型糖尿病白蛋白尿患者肾功能的关联。OPG与TNFR1和TNFR2同属于TNFR超家族成员,并被认为是动脉粥样硬化的标志物[3]。既往研究采用脉搏波速度或CAVI评估发现OPG与周围血管疾病存在联系,并与ACR和eGFR相关,因此可以作为预测DN患者CVD及终末期肾脏疾病的潜在风险因素[4]。本研究发现OPG与CVD(即CAVI和BNP)和炎症标志物(即TNF-α和TNFRs)相关。但是多因素logistic回归模型分析显示,OPG无法有效区分NA-DKD和No-CKD患者(P>0.05)。
L-FABP与2型糖尿病白蛋白尿患者肾功能的关联。既往研究发现,肾小管间质纤维化与肾功能降低而不是蛋白尿有关,此外,Ekinci等[5]发现,与患有糖尿病合并白蛋白尿的患者比较,NA-DKD患者肾小管间质纤维化和血管病变发生率更高,提示肾小管间质病变可能参与NA-DKD的发生发展。动物实验和临床试验均发现,尿L-FABP水平与肾小管间质纤维化相关,其可以预测DN患者的肾功能降低和心血管事件发生风险[6-7]。基于上述研究基础,本研究选择L-FABP作为评估肾小管间质损伤的标志物,结果显示,NA-DKD组和No-CKD组之间L-FABP水平差异无统计学意义,且多因素logistic回归模型分析亦显示,L-FABP无法有效区分NA-DKD和No-CKD患者(P>0.05),可能与本研究纳入对象肾功能损伤程度较轻有关,其肾小管间质纤维化程度较小,因此无法观测到统计学差异。
M-TNF-α、TNFR与2型糖尿病白蛋白尿患者肾功能的关联。慢性炎症可能在DN的发生和发展中发挥着重要作用。肾组织中的巨噬细胞、T细胞和中性粒细胞产生促炎症因子,进一步激活糖尿病肾内浸润的炎症细胞进而导致肾细胞的炎症反应。肿瘤坏死因子α由肾细胞和巨噬细胞产生,通过几种机制参与DN的发生和发展,包括肾小球内血流量减少、肾小球血管收缩增加和肾小球基膜通透性增加。TNFR可以预测糖尿病患者肾功能水平,并通过建立糖尿病小鼠模型证明了TNF-TNFR途径也参与了DN的发病机制。但是,尚不清楚肿瘤坏死因子α和肿瘤坏死因子受体是否与NA-DKD患者肾功能降低有关。本研究结果表明,在对2型糖尿病白蛋白尿患者潜在的生物标志物和临床协变量进行调整后,血清肿瘤坏死因子α和肿瘤坏死因子受体与肾功能降低有关,尚需进一步对其参与机制进行深入探讨。
本研究存在一定局限性。首先,未进行肾活检以诊断DKD,因此可能无法完全排除患有其他肾脏疾病的患者。其次,仅使用尿液中的L-FABP作为肾小管间质损伤的生物标志物,因此不能排除其他肾小管间质损伤生物标记物(如KIM-1和NGAL)的影响。最后,作为一项回顾性研究无法确定TNF-α、TNFR与肾功能之间的因果关系。
综上所述,2型糖尿病白蛋白尿患者TNFRs水平而不是TNF-α水平与肾功能降低密切相关。

