血清人抗菌肽LL-37与急性胰腺炎患者严重程度及预后的关系
陈明,季红莉,付万发
急性胰腺炎(acute pancreatitis,AP)是由梗阻、感染、外伤等多种因素导致胰酶异常激活造成胰腺组织水肿、出血及坏死等的炎症反应性疾病。AP患者病情严重时可能出现感染性休克、多器官功能障碍等,病死率较高[1]。及时准确评估患者病情严重程度对积极采取相应的治疗方案、改善患者预后有重要意义。由于AP的发生与炎症反应增加密切相关[2],探究AP进展中炎性因子水平变化可为评估患者预后提供一定帮助。有研究表明,溃疡性结肠炎患者结肠黏膜中人抗菌肽LL-37表达上调,可能作为疾病治疗靶点和病情评估指标[3]。LL-37也被证实可作为脓毒症早期患者的监测因子,在脓毒症患者外周血中高表达[4]。炎症性疾病发生时中性粒细胞外诱捕网可靶向LL-37激活树突细胞并促进干扰素-γ(Interferon-γ,IFN-γ)、白介素-6(interleukin-6,IL-6)、白介素-1β(interleukin-1β,IL-1β)等炎性因子表达引起机体炎症反应[5]。由于LL-37在AP中表达水平研究较少,本研究通过检测AP患者血清中LL-37表达水平,分析其与AP病情严重程度及患者预后相关性,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2017年1月至2019年1月北京老年医院收治的AP患者123例作为研究对象,其中,男65例,女58例,患者年龄38~57岁,平均年龄(45.05±7.34)岁。纳入标准:①根据中华医学会相关诊断标准[6],确诊为AP;②首次发病;③临床及随访资料完整。排除标准:①合并患有恶性肿瘤患者;②妊娠期患者;③合并患有自身免疫性疾病,及心、肺、肾、肝脏等重要脏器功能严重不足者。入组患者根据患病严重程度分为:轻症急性胰腺炎(mild acute pancreatitis,MAP)组57例,中重症急性胰腺炎(moderately severe acute pancreatitis,MSAP)组38例,重症急性胰腺炎(severe acute pancreatitis,SAP)组28例。另选取同期在北京老年医院体检的健康者115例作为对照组,其中,男63例,女52例,年龄38~57岁,平均年龄(44.82±7.02)岁。本研究经北京老年医院伦理委员会批准同意。所有受试者对研究知情并签署知情同意书。如表1所示,SAP组、MSAP组、MAP组、对照组性别、年龄、有吸烟史比例比较,差异无统计学意义(P>0.05)。MAP组、MSAP组、SAP组合并糖尿病、饮酒史比例依次显著升高(P<0.05)。

表1 SAP组、MSAP组、MAP组、对照组一般资料比较
1.2 方法
1.2.1 一般资料收集 收集入组患者性别、年龄、吸烟史、糖尿病、饮酒史、急性生理学与慢性健康状况评分Ⅱ(Acute Physiology and Chronic Health Evaluation Ⅱ,APACHE Ⅱ)评分等一般资料。APACHE Ⅱ由急性生理学评分状况(APS)、年龄及慢性健康状况(CPS)三部分组成。
1.2.2 样本采集 收集入组患者入院时及体检健康者体检时外周静脉血5 mL,在4 ℃、3 000 r/min(离心半径13.5 cm)条件下离心20 min,收集上清液(即血清)于-80 ℃环境下保存。
1.2.3 血清LL-37、IFN-γ、IL-6、IL-1β水平检测 采用酶联免疫吸附法检测血清LL-37、IFN-γ、IL-6、IL-1β水平,其中LL-37、IFN-γ、IL-6试剂盒购自英国biorbyt公司(货号:orb406607、orb405942、orb506697),IL-1β试剂盒购自美国Sab公司(货号:EK0445),严格按照试剂盒说明书进行操作。
1.3 随访
入组AP患者入院治疗起1个月内对其进行随访,记录患者发生多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)及死亡情况,发生上述两种情况即为预后不良。入组患者中发生预后不良43例(包括死亡15例、发生MODS 28例)。根据有无发生预后不良将入组AP患者分为预后不良组(43例)和预后良好组(80例)。
1.4 统计学分析

2 结果
2.1 对照组、MAP组、MSAP组、SAP组血清LL-37、IFN-γ、IL-6、IL-1β水平及APACHE Ⅱ评分比较
如表2所示,对照组、MAP组、MSAP组、SAP组血清LL-37、IFN-γ、IL-6、IL-1β水平及APACHE Ⅱ评分均依次升高,各组间比较,差异均有统计学意义(P<0.05)。

表2 SAP组、MSAP组、MAP组、对照组血清LL-37、IFN-γ、IL-6、IL-1β水平及APACHE Ⅱ评分比较
2.2 AP患者血清LL-37表达与IFN-γ、IL-6、IL-1β水平及APACHE Ⅱ评分相关性
AP患者血清LL-37表达水平与APACHE Ⅱ评分及IFN-γ、IL-6、IL-1β水平均呈正相关(r/P=0.431/0.001、0.365/0.000、0.484/0.000、0.402/0.001)。见图1。
2.3 预后良好组与预后不良组AP患者血清LL-37、IFN-γ、IL-6、IL-1β水平及APACHE Ⅱ评分比较
如表3所示,预后不良组AP患者血清LL-37、IFN-γ、IL-6、IL-1β水平及APACHE Ⅱ评分均明显高于预后良好组(P<0.05)。
2.4 APACHE Ⅱ评分及血清LL-37、IFN-γ、IL-6、IL-1β对AP患者不良预后的预测价值分析
血清LL-37对AP患者不良预后预测的曲线下面积为0.835,明显大于APACHE Ⅱ评分、IFN-γ、IL-6、IL-1β的曲线下面积0.742、0.757、0.740、0.774(Z/P=2.244/0.025、2.096/0.036、2.062/0.039、1.984/0.047)。见图2、表4。

图1 AP患者血清LL-37表达与IFN-γ、IL-6、IL-1β水平及APACHE Ⅱ评分相关性
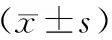
表3 预后良好组与预后不良组血清LL-37、IFN-γ、IL-6、IL-1β水平及APACHE Ⅱ评分比较
3 讨论
AP患者临床症状主要包括持续性腹痛、发热、呕吐等,随病情加重患者还可能出现持续性高热、休克等,严重影响患者生存[1]。研究发现,糖尿病易引起机体血脂水平升高、炎症反应增加等,是影响AP发生的危险因素[7]。此外,饮酒也会造成血脂水平升高,增加AP发生风险[8]。本研究分析入组患者临床资料发现,SAP组、MSAP组、MAP组、对照组合并糖尿病、饮酒史比例依次显著降低,与前人研究结果[7-8]一致,提示饮酒及合并糖尿病可能与AP发生及加重有关。
目前临床多采用APACHE Ⅱ评分等对AP患者病情严重程度及预后进行评估,但由于该评分涉及生理指标较多、操作复杂等,该评估方式存在一定缺陷[9]。因此需探究更多相关因子,以更准确评估患者预后。研究报道,外因刺激影响胰腺中胰蛋白酶被激活、胰腺细胞损伤等引起中性粒细胞分泌TNF-α、IL-6促炎因子增多,进而促进炎症反应增加,是AP发生发展的主要机制[2]。
LL-37作为Cathelicidins家族中唯一的人源抗菌肽,由37个氨基酸组成,产生于上皮细胞、中性粒细胞等,可参与炎症反应调节、新生血管生成、抗菌等生物学进展[10]。前人关于LL-37在肿瘤中作用研究较多,肺癌、乳腺癌进展中LL-37可能通过参与免疫细胞激活进而诱导肿瘤细胞增殖[11-12]。另IFN-γ作为一种由Th1细胞产生的促炎因子,有促进炎症性疾病进展作用。研究表明,AP患者血清中IFN-γ表达升高,且随病情加重有上升趋势[17]。此外,常见炎症因子IL-6、IL-1β水平变化也被证实与AP严重程度密切相关[18-19]。本研究结果显示,与对照组相比,AP患者血清IFN-γ、IL-6、IL-1β水平及APACHE Ⅱ评分均明显升高,且随AP患者病情严重程度增加各因子水平差异显著,与前人[7, 18-19]研究结果一致。本研究还发现,AP患者血清LL-37表达水平与IFN-γ、IL-6、IL-1β水平及APACHE Ⅱ评分均呈正相关,提示血清LL-37在AP进展中作用可能与IFN-γ、IL-6、IL-1β等炎症因子的表达密切相关,并通过APACHE Ⅱ评分反映。LL-37可能通过调节巨噬细胞等分泌IFN-γ、IL-6、IL-1β等炎症因子表达上调,促进疾病进展。

图2 APACHE Ⅱ评分及血清LL-37、IFN-γ、IL-6、IL-1β对AP患者不良预后预测价值的ROC曲研究发现,LL-37在类风湿性关节炎、慢性牙周炎患者血清中高表达,且与患者病情严重程度呈正相关,可用于评估牙周状况及类风湿性关节炎的稳定性[13]。有研究证实,Cathelicidins家族因子可参与调节小鼠AP严重程度[14]。本研究结果显示,健康对照组、MAP组、MSAP组、SAP组血清LL-37水平依次显著升高,表明血清LL-37水平升高可能与AP发生及患者病情加重有关,与Deng等[14]在小鼠模型中研究结果相似。LL-37可能通过参与组织mtDNA降解诱导的自噬、中性粒细胞外诱捕网功能维持等加重炎症反应,进而影响AP进展[15-16]。
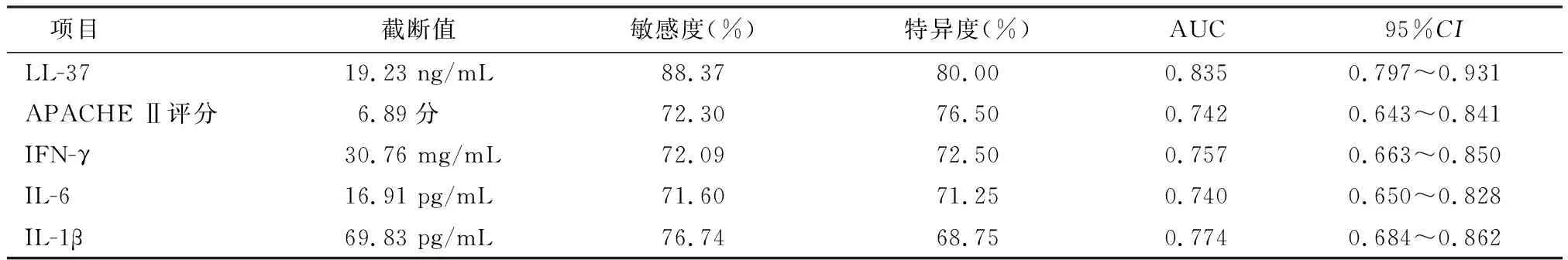
表4 APACHE Ⅱ评分及血清LL-37、IFN-γ、IL-6、IL-1β对AP患者不良预后预测价值分析结果
有研究报道,脓毒症患者入院早期外周血LL-37水平明显升高,与患者生存率降低密切相关。本研究结果显示,预后不良组AP患者血清LL-37、IFN-γ、IL-6、IL-1β水平及APACHE Ⅱ评分均明显高于预后良好组,提示血清LL-37水平升高可能通过反映AP患者炎症反应水平增加和病情加重来预示患者MODS、死亡等不良预后的发生。且经ROC曲线分析表明,血清LL-37对AP患者不良预后发生预测的曲线下面积为0.835,敏感度为83.70%,均明显高于IFN-γ、IL-6、IL-1β水平及APACHE Ⅱ评分的预测曲线下面积,提示血清LL-37对AP患者不良预后的预测价值较高,可能作为AP患者不良预后评估参考指标。
综上所述,AP患者血清LL-37水平高表达,且随病情加重而升高,可能作为生物标志物,以评估患者不良预后发生。但由于本研究仅通过血清表达水平及相关性分析LL-37参与胰腺炎进展的可能机制,具体作用机制尚需进一步研究验证。

