胃癌组织中FOXP1和FOXQ1的表达水平与临床病理特征及预后关系
朱 涛,王 伟,吴和刚
(1.宜宾市中医医院普外科,四川宜宾 644000;2.宜宾市第一人民医院,a.普外科;b.病理科,四川宜宾 644000)
胃癌是一种常见的消化道恶性肿瘤,其发病率在消化道肿瘤中居首位,其病死率居于恶性肿瘤第三位,且5年生存率低于30%[1-2]。目前探究胃癌的生物学特性与复发、转移及预后的关系,并找到相关的分子靶点予以靶向治疗研究已成为当今胃癌临床研究的热点。叉头框(forkhead box, FOX)蛋白作为一种转录调控因子,参与脂类的新陈代谢、细胞周期的调控、胚胎发育、免疫调节及生物老化等多种生物过程,其异常表达与代谢性疾病、发育畸形及肿瘤的发生发展存在密切相关[3-4]。多个FOX 家族的亚族广泛地参与肿瘤的发生和转移,其中叉头框蛋白P1(forkhead box P1, FOXP1)和叉头框蛋白Q1(forkhead box Q1, FOXQ1)属于重要的叉头转录因子[4]。研究报道,FOXP1 与FOXQ1 参与机体多种生理生化过程,在多种恶性肿瘤中异常表达[5-6]。但关于FOXP1 和FOXQ1 在胃癌中的作用研究鲜有报道。本研究采用免疫组化EnVision 法检测胃癌组织和癌旁组织中FOXP1,FOXQ1 的表达情况,并分析两者与临床病理参数和预后的关系,旨在探讨二者联合检测对胃癌预后诊断的临床意义。
1 材料与方法
1.1 研究对象 选择2014年1月~2017年2月在宜宾市中医医院普外科接受手术治疗的156 例胃癌患者,选取胃癌组织作为观察组,同时选取癌旁正常组织(距肿瘤边缘>5cm)作为对照组。纳入标准:所有患者诊断均经术前影像、胃镜检查和术后病理证实;所有患者均行胃癌根治术;术前未接受免疫治疗、放化疗或靶向治疗;临床随访资料完整者;患者或家属签署知情同意书。排除标准:术前接受新辅助治疗者;并发有其他原发性肿瘤者;行姑息性手术者;伴发血液、内分泌、免疫系统等对肿瘤标志物检测有影响的相关疾病;随访资料缺失。156例患者中男性91例,女性65例;年龄32~79岁,平均年龄55.26±8.59 岁;脉管神经侵犯67 例,未侵犯89 例;区域淋巴结转移92 例,未转移64 例;低分化69 例,中、高分化87 例; Lauren 分型弥漫型81 例,肠型75 例。
1.2 仪器与试剂 鼠抗人单克隆FOXP1,FOXQ1 抗体(美国Santa Cruz 公司),免疫组化EnVision 试剂盒和DAB 显示试剂盒(中杉金桥有限公司)。
1.3 方法
1.3.1 免疫组化检测:所有胃癌组织标本均以10g/dl 甲醛固定,石蜡包埋。免疫组化染色(EnVision二步法):常规脱蜡水化,抗原修复,DAB 显色,苏木精复染,芯片脱水,透明,封固,用自身对照作阳性对照,用PBS 代替一抗作阴性对照。
1.3.2 免疫组化结果判定:FOXP1,FOXQ1 蛋白阳性显色为浅黄色至棕黄色颗粒。FOXP1 阳性表达主要定位于细胞质和(或)细胞核,FOXQ1 阳性表达主要定位于细胞质和胞质膜。根据染色强度与染色阳性细胞百分比对检测结果进行综合评定。每张切片观察5 个以上高倍视野(×400),计数≥1 000 个细胞中的阳性细胞数,计算阳性细胞比。染色细胞百分率评分:阳性细胞率≤10%为0 分,11%~25% 为1 分,26%~50% 为2 分,5l%~75%为3分,>75%为4分;染色强度评分:浅黄色为1 分,棕黄色为2 分,棕褐色为3 分。FOXPl 和FOXQ1蛋白的表达结果为2 项乘积,0~3 分为低或无表达,4~12 分为高表达。本研究根据FOXPl 和FOXQ1蛋白表达将标本分为高表达组和低或无表达组。
1.3.3 随访:采用来院就诊和电话等方式对患者进行5年随访。随访截至2020年8月31日,随访时间为3~60 个月。随访内容为患者总体生存时间(overall survival time, OS)。OS 为手术开始至末次随访或死亡的时间。
1.4 统计学分析 所有数据采用SPSS22.0 统计软件进行处理,计数资料以阳性率(%)表示,组间比较采用χ2检验;采用Spearman 相关分析胃癌组织中FOXP1 与FOXQ1 表达的相关性;采用Cox比例风险回归模型分析胃癌患者预后的危险因素;采用Kaplan-Meier 生存法分析胃癌患者术后OS,比较采用Log-rank 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 FOXP1,FOXQ1 蛋白在胃癌和癌旁组织中表达情况 胃癌组织中FOXPl蛋白高表达率(38.46%)低于癌旁组织(86.67%),差异有统计学意义(χ2=23.521,P<0.05);胃癌组织中FOXQl 蛋白高表达率(65.38%)高于癌旁组织(6.67%),差异有统计学意义(χ2=35.193,P<0.05)。
2.2 胃癌患者FOXPl,FOXQl 蛋白表达情况与临床病理特征的关系 见表1。胃癌组织中FOXPl,FOXQl 蛋白表达与年龄、性别、Lauren 分型、肿瘤部位无关,差异无统计学意义(均P>0.05);胃癌组织中FOXPl,FOXQl 蛋白表达与肿瘤大小、病理分化程度、TNM 分期、淋巴结转移、浸润深度及脉管神经侵犯相关,差异均有统计学意义(χ2=5.668~14.909, 均P<0.05)。
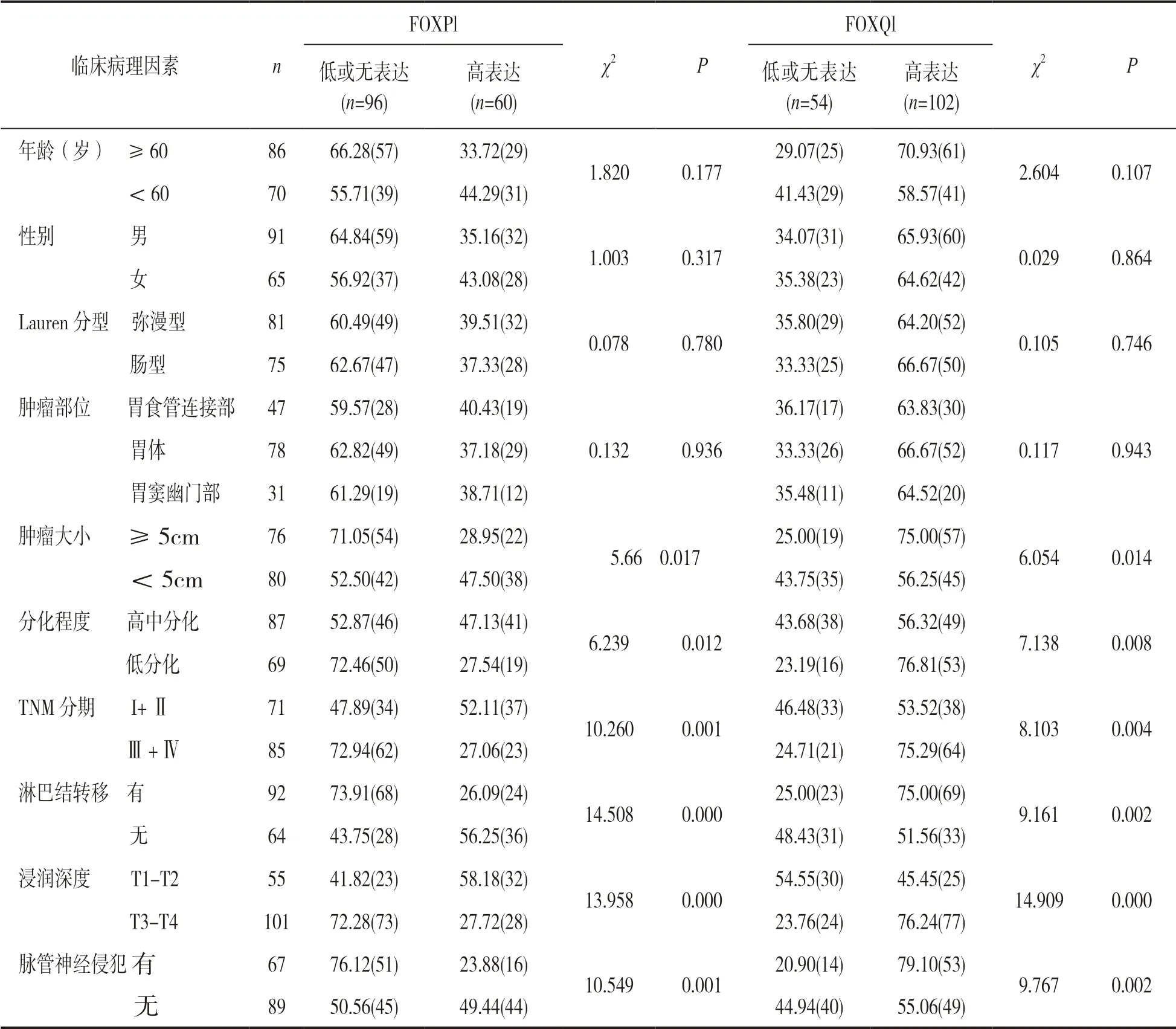
表1 FOXP1,FOXQ1 蛋白表达与胃癌患者临床病理特征的关系(%)
2.3 胃癌组织中FOXP1 和FOXQ1 蛋白的相关性分析 在156 例胃癌中,96 例FOXP1 低或无表达的胃癌组织中,FOXQ1 高表达92 例,而低或无表达仅有4 例;60 例FOXP1 高表达的胃癌组织中,FOXQ1 低或无表达的50 例,而高表达仅有10 例。经Spearman 相关性分析结果显示,FOXP1和FOXQ1 蛋白在胃癌组织中的表达呈负相关(r=-0.526,P<0.001)。
2.4 预后影响因素分析 见表2。将胃癌患者OS 作为因变量,以肿瘤大小、病理分化程度、TNM 分期、淋巴结转移、浸润深度、脉管神经侵犯、FOXP1 表达、FOXQ1 表达、FOXP1低或无表达/FOXQ1高表达为自变量进行多因素Cox 回归分析,结果显示TNM 分期、淋巴结转移、浸润深度、FOXP1 低或无表达、FOXQ1 高表达、FOXP1低或无表达/FOXQ1高表达均是影响胃癌患者OS 的独立危险因素(P<0.05)。
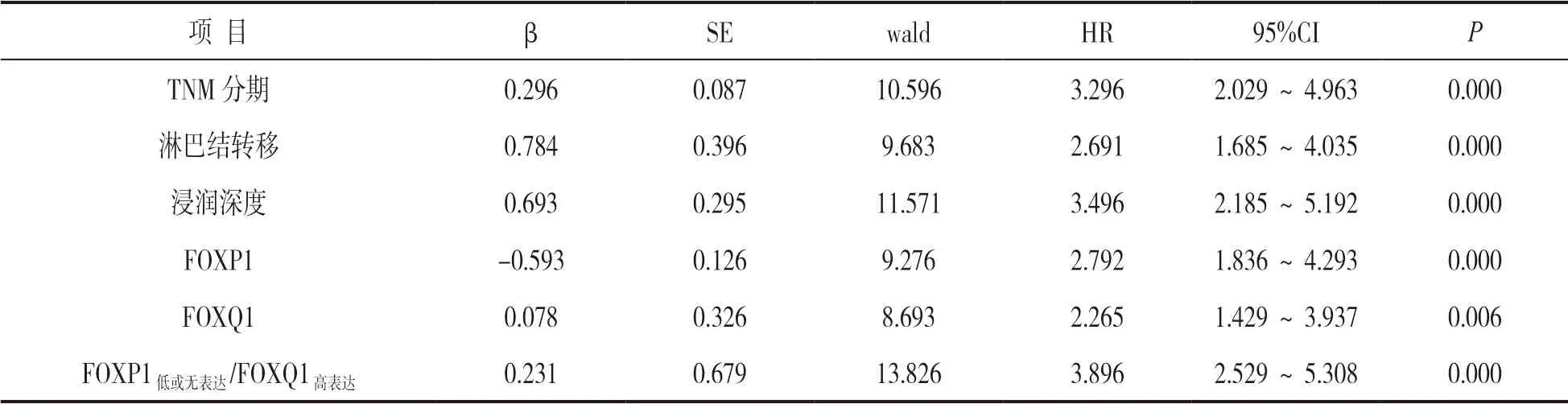
表2 影响胃癌患者OS 的多因素Cox 回归分析
2.5 生存分析 Kaplan-Meier 法分析结果显示FOXP1 低或无表达组和高表达组5年生存率分别为50.00%,68.30%,FOXP1 低或无表达组者OS短于高表达患者(χ2=6.570,P=0.010);FOXQ1 高表达组和低或无表达组5年生存率分别为50.98%和68.52%,FOXQ1 高表达组OS 短于低或无表达组(χ2=7.045,P=0.008);FOXP1低或无表达/FOXQ1高表达组和其他患者5年生存率分别为32.60%和92.20%,FOXP1低或无表达/FOXQ1高表达患者OS 短于其他患者(χ2==57.228,P=0.000);FOXP1低或无表达/FOXQ1高表达组、FOXP1 低或无表达组和FOXQ1 高表达组5年生存率分别为32.60%,50.00%,50.98%,FOXP1低或无表达/FOXQ1高表达组OS 短于FOXP1 低或表达组和FOXQ1 高表达组(χ2=8.112,P=0.017) 。
3 讨论
近年来,胃癌的诊断技术水平已获得较大进步,但因胃癌起病隐匿,早期无症状或症状不明显,很多患者被确诊时已是临床晚期[7]。手术治疗仍是当前治疗胃癌的重要方法,胃癌根治术是主要的手术方式[8]。胃癌根治术尽管已进行了广泛的淋巴结清扫,但中晚期患者术后复发率仍较高,5年生存率低于20%[9]。胃癌的发病与体内癌基因及抑癌基因表达异常造成细胞增殖异常及凋亡受到抑制有关[10]。对胃癌的生物学特性、转移、复发及预后从基因层面上进行探索,并找到相关分子靶点予以靶向治疗研究已成为当今胃癌研究的热点。
叉头框蛋白(forkhead box, FOX)是一个转录因子家族,具有进化保守的“叉头”或“翼状螺旋结构”的DNA 结合域,在细胞周期调控、增殖、分化及DNA 损伤反应等多种生物学过程中扮演着重要角色[11]。研究报道,FOX 家族通过复杂广泛的网络,在不同的调控水平上促进恶性肿瘤的发生发展[12]。叉头框蛋白P1(FOXP1)是FOX 家族成员之一,定位于3p14.1 的肿瘤抑制基因座,此区域与许多肿瘤类型杂合性缺失相关,FOXP1 可能是一种潜在的恶性肿瘤抑制基因[13]。FOXP1 转录活性在许多恶性肿瘤中受到抑制,可能与FOXP1 mRNA 的下降、FOXP1 在细胞质的异常定位或表达水平下降有关[14-15]。刘湘鄂等[16]研究报道,前列腺癌组织中FOXP1 蛋白表达缺失或低表达与预后不良密切相关。孙百尔等[17]研究报道,FOXP1 蛋白在非小细胞肺癌组织中表达下降,其表达水平越低患者生存时间越短。XIAO 等[18]研究报道,子宫内膜癌组织中FOXP1 蛋白低表达,且与低氧介导因子1α,雌激素受体-α 的表达呈负相关。目前,FOXP1 在胃癌中的研究报道较少。本研究结果显示,胃癌组织中FOXPl 蛋白高表达率低于癌旁组织(P<0.05);胃癌组织中FOXPl 蛋白表达与肿瘤大小、病理分化程度、TNM 分期、淋巴结转移、浸润深度及脉管神经侵犯相关(P<0.05);多因素Cox 回归分析结果显示,FOXP1 低或无表达是影响胃癌患者OS的独立危险因素(P<0.05);Kaplan-Meier 分析结果显示,FOXP1 低或无表达组者OS 累积生存率低于高表达患者(P<0.05)。结果表明,FOXP1 蛋白的表达在胃癌组织中被抑制,其在胃癌的发生发展中可能起到一定的促进作用,且FOXP1 表达被抑制与胃癌患者不良预后存在密切联系。
叉头框蛋白Q1(FOXQ1)是转录因子家族成员之一,定位在6p25.3 的肿瘤基因座,可参与调节上皮细胞间充质转化、调节Wnt/β-catenin 通路、抑制平滑肌特异性基因的启动子活性及促进大多数肿瘤细胞的侵袭和迁移等,与多种恶性肿瘤的发生发展密切相关[19-20]。FOXQ1 蛋白在胃癌、胰腺癌、结直肠癌、肝癌等多种消化道恶性肿瘤的发生发展中的作用国内外已有研究。王城等[21]研究报道,沉默FOXQ1 基因的表达能够抑制肝癌SMMC-7721细胞的迁移、侵袭能力。邓大炜等[22]研究报道,FOXQ1 蛋白在胰腺癌干细胞中过表达,且FOXQ1的mRNA 表达量也增加。LIU 等[23]研究报道,结直肠癌组织中FOXQ1 蛋白过表达与患者预后不良密切相关。崔晓海等[24]研究报道,FOXQ1 蛋白在胃癌组织中高表达,且与TNM 分期、淋巴结转移、浸润深度密切相关。本研究结果显示,胃癌组织中FOXQl 蛋白高表达率高于癌旁组织(P<0.05);胃癌组织中FOXQl 蛋白表达与肿瘤大小、病理分化程度、TNM 分期、淋巴结转移、浸润深度及脉管神经侵犯相关(P<0.05);多因素Cox 回归分析结果显示,FOXQ1 高表达是影响胃癌患者OS 的独立危险因素(P<0.05);Kaplan-Meier 分析结果显示,FOXQ1 高表达组者OS 累积生存率低于高表达患者(P<0.05)。结果表明,FOXQ1 蛋白高表达与胃癌的发生发展及预后密切相关。
本研究中,Spearman 相关性分析结果显示,在胃癌组织中,FOXP1 和FOXQ1 蛋白的表达情况呈负相关(P<0.05);Cox 回归分析结果显示,FOXP1低或无表达/FOXQ1高表达是影响胃癌患者OS 的独立危险因素(P<0.05);Kaplan-Meier 分析结果显示,FOXP1低或无表达/FOXQ1高表达患者OS 累积生存率低于其他患者(P<0.05);FOXP1低或无表达/FOXQ1高表达组OS 累积生存率低于FOXP1 低或表达组和FOXQ1 高表达组(P<0.05)。结果表明,FOXQ1 在胃癌的发生发展中是致癌基因,而FOXP1 在胃癌发生发展中是抑癌基因,FOXP1 低或无表达和FOXQ1 高表达患者预后更差,二者联合检测可应用于临床判断胃癌患者的预后。
综上所述,FOXP1 在胃癌组织中低或无表达,FOXQ1 蛋白在胃癌组织中高表达,FOXP1 低或无表达和FOXQ1 高表达患者预后更差,两者联合检测对胃癌的预后诊断价值较单独检测更高,同时也为胃癌的靶向治疗提供了新思路。

