ECE2通过上调E2F1和MYC来促进乳腺癌细胞的增殖和迁移
顾芯烨,吴旦平,江 波,商江峰,蒋国勤,魏金荣,李 华
(1.常熟市第一人民医院甲乳外科,江苏常熟 215500;2.苏州大学附属第二医院普外科,江苏苏州 215004;3.府谷县人民医院,陕西榆林 719400)
乳腺癌是女性最常见的恶性肿瘤之一,其发病率占全身各种恶性肿瘤的7%~10%,以手术为主的综合疗法是其临床主要治疗方法[1-2]。近年研究发现,乳腺癌是由上皮细胞恶性转化形成,在此过程中多种基因蛋白及信号通路参与其中[3]。越来越多证据也表明,肿瘤的发生和发展与基因或蛋白的异常表达有关,多种基因或蛋白可在表观遗传学层面调控基因的表达,参与肿瘤的发生进程[4]。并指出人类恶性肿瘤中存在多种基因或蛋白异常表达,可调控癌细胞的生物学行为及转录激活/抑制,与临床病理及预后关系密切[5]。目前,基于分子生物学探究肿瘤发生发展的分子机制是近年肿瘤研究领域的热点,也为临床肿瘤的研究治疗提供了新的方向。故深入探究找寻新的生物分子标志物并探究其在乳腺癌中的作用,对乳腺癌的临床诊治及预测预后具有积极意义。内皮素转化酶(ECE)是II 型膜金属肽酶,因其具有将无活性的前体大内皮素转化为有效的血管活性肽内皮素1 的能力而命名[6]。ECE1和ECE2具有59%的序列同源性并切割相似的底物,其中ECE1 在中性pH 下最活跃,ECE2 在弱酸性pH 下最活跃[7]。目前,ECE2 在癌症中的研究报道鲜少,而本研究前期经检索GEPIA[8]临床数据库筛选乳腺癌特异性靶基因时发现ECE2 基因在乳腺癌中表达异常,与乳腺癌临床病理分级及预后关系密切,提示其在乳腺癌发生发展中可能扮演某种角色发挥重要作用。因此,本研究拟通过设计体外细胞试验探究ECE2 在乳腺癌中表达及对乳腺癌细胞增殖、克隆形成、迁移和细胞周期的影响和潜在分子机制,以期为临床靶标的筛选提供参考。
1 材料与方法
1.1 研究对象 收集2018年9月~2019年9月于常熟市第一人民医院行手术治疗的20 例乳腺癌患者肿瘤组织及其癌旁正常组织(距癌灶边缘>5cm)标本,所有组织均由手术获取,快速行冰冻病理检查确认后低温保存备用。人乳腺癌细胞系MCF7 购于中国科学院细胞库,放入含10ml/dl胎牛血清的DMEM 培养液培养,加入链霉素100 μg/ml 和青霉素100 IU/ml,37℃,5ml/dl CO2培养箱培养。
1.2 仪器及试剂 胎牛血清购自上海薇宏生物科技有限公司;DMEM 培养液购自美国Hyclone 公司;MTS 试剂购自南京凯基生物技术有限公司;酶标仪购自美国赛默飞公司;Annexin V-PI 细胞周期检测试剂盒购自上海碧云天生物技术有限公司;Lipo2000 购自美国Invitrogen 公司等。
1.3 方法
1.3.1 细胞转染:待密度达到80%左右进行细胞转染,参照Lipo2000 说明书进行,转染后37 ℃,5ml/dl CO2,95%湿度条件下常规培养2 天,收集细胞用于后续实验。转染分组:转染无义SiCTL 序列的细胞作为对照组(SiCTL 组),转染2 条ECE2 SiRNA序列细胞分别作为SiECE2#1 组和SiECE2#2 组。
1.3.2 细胞增殖实验:取消化后细胞以适当浓度铺于96 孔板,每组设3 个复孔;37℃,5ml/dl CO2孵育待细胞贴壁后进行转染,48 h 后测量吸光度。按照MTS∶培养液=1∶20 比例配制MTS 反应液,每孔加入MTS 反应液100 μl,37℃分别继续培养0,24,48 和72 h 后在490 nm 处测量各孔的吸光度值,绘制细胞增殖曲线。
1.3.3 克隆形成实验:取转染后各组细胞适当浓度铺于6 孔板,每孔设3 个复孔,培养6~14 天待出现肉眼可见的克隆时收集细胞,PBS 洗涤两次,0.5g/dl 结晶紫甲醇溶液固定15 min,水洗、晾干、扫描、10g/dl醋酸溶液溶解结晶紫,在590 nm 处测吸光度值。
1.3.4 划痕迁移实验:取消化后细胞铺于6 孔板,细胞贴壁后进行转染,待生长到90%用枪头在孔板中央划痕,PBS 冲洗,培养0,24 h 拍摄照片观察。1.3.5 细胞周期实验:取消化后细胞重悬于PBS溶液,吹散、滴加等体积预冷无水乙醇,振荡混匀,4 ℃静置12~24 h,3 000 g 离心3 min,弃上清,重复一次;加入500μl PI/Triton X-100 染液[Triton X-100(0.10%)5μl,DNA Sefree RNA see A(sigma)2mg, PI(40μg/ml)10μl, 补ddH2O 至500μl]37 ℃孵育15 min,行DNA 染色,过滤成簇细胞,避光保存上机实验分析。
1.3.6 基因功能分析:在cBioPortal[9]临床数据库中找到与ECE2 共表达(相关性r>0.4)的基因,后拷贝在metascape 数据库中进行Hallmark 和KEGG信号通路分析。
1.3.7 细胞增殖回补实验:取消化后细胞铺于96 孔板,37℃,5ml/dl CO2孵育待细胞贴壁后进行转染siCTL,siECE2,siECE2+E2F1 和siECE2+MYC,每孔设3 个复孔;每孔加入MTS 反应液100μl,继续培养,在490 nm处测量吸光度值,绘制细胞增殖曲线。
1.4 统计学分析 采用SPSS 20.0 软件进行实验结果分析,所有实验数据均采用均数±标准差(±s)表示,多组间采用one-way ANOVA 分析,组间两两比较采用LSD-t检验;乳腺癌组织及临近正常组织数据比较采用配对t检验;P<0.05 为差异有统计学意义。
2 结果
2.1 ECE2 在乳腺癌组织中的表达 采用qRT-PCR法检测20 例临床乳腺癌组织样本,发现乳腺癌组织中ECE2 表达量(30.342±6.564)显著高于癌旁组织(21.753±8.244),差异有统计学意义(t=7.484,P<0.001)。
2.2 敲低ECE2 对乳腺癌细胞增殖、克隆形成,迁移及细胞周期的影响 敲低ECE2 显著抑制乳腺癌细胞增殖、克隆形成和迁移,阻滞细胞周期在G1期。通过靶向转染敲低乳腺癌中ECE2 表达,见图1a。经检测发现siECE2#1 组(0.232±0.016)和siECE2#2 组(0.214±0.014)细胞中ECE2 mRNA表达明显低于对照组(1.000±0.010),差异有统计学意义(F=756.347,P<0.001),提示成功转染敲低ECE2 表达。
细胞增殖实验见表1,图1b。转染24,48和72 h后,对照组、siECE2#1 组、siECE2#2 组在490nm 处的吸光度值差异均有统计学意义(P<0.05)。克隆形成实验见图1c。siECE2#1 组(0.515±0.014)和siECE2#2组(0.511±0.006)细胞克隆形成速率显著低于对照组(3.473±0.147),差异有统计学意义(F=467.152,P<0.001)。划痕迁移实验见图1d。siECE2#1 组(56.423±1.137) 和siECE2#2 组(42.036±0.754)细胞迁移愈合速率显著低于对照组(78.124±1.352),差异有统计学意义(F=805.162,P<0.001)。细胞周期实验见图1e。与对照组(69.99%)相比,siECE2#1 组(81.34%)和siECE2#2 组(83.38%)细胞周期显著阻滞在G1 期,以上结果说明ECE2 在乳腺癌发展进程中发挥促癌作用。
表1 不同时间点各组细胞吸光度值(±s)

表1 不同时间点各组细胞吸光度值(±s)
注:各时间点①组与②③组比较,差异有统计学意义P <0.05;②③组比较差异无统计学意义(P >0.05)。
时 间(h)siCTL 组①siECE2#1 组②siECE2#2 组③FP 240.203±0.0190.092±0.0110.083±0.00971.409<0.001 480.482±0.0230.224±0.0170.219±0.012211.681<0.001 720.824±0.0260.456±0.0200.376±0.019357.545<0.001
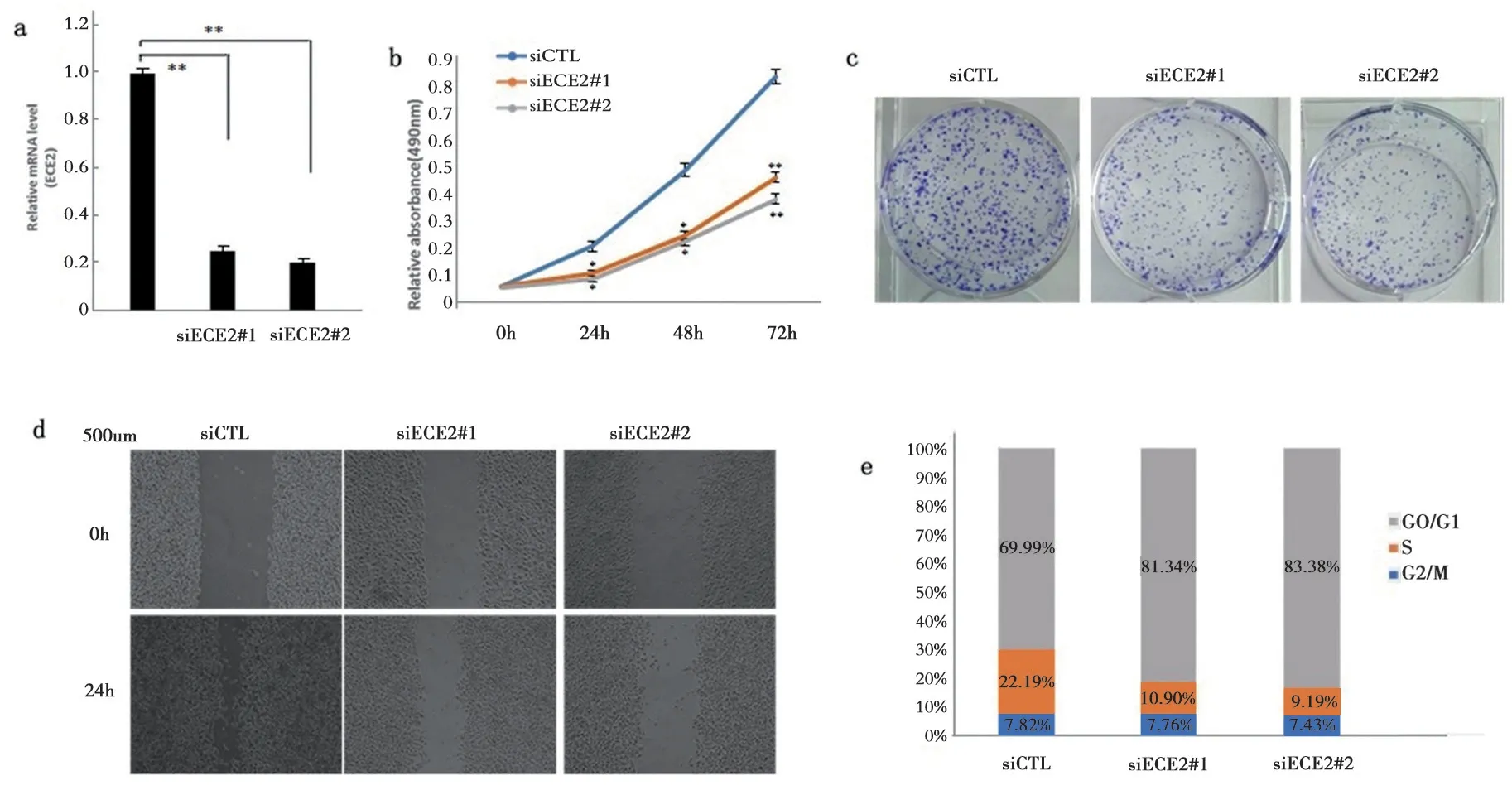
图1 敲低ECE2 对乳腺癌MCF7 细胞增殖、克隆形成、迁移及细胞周期的影响
2.3 ECE2 正调控E2F1 和MYC 表达 通过metascape 数据库分析与ECE2 共表达的基因,Hallmark信号通路显示ECE2 促进乳腺癌的生长可能是因其影响E2F1 和MYC 表达(P<10-2),见图2a。同时KEGG 信号通路也发现ECE2 可显著影响细胞周期(P<10-4,见图2b)。经检测20 例临床组织样本,发现乳腺癌组织中E2F1(1.534±0.316)和MYC(1.323±0.214)表达水平显著高于癌旁组织样本(0.542±0.125 和0.347±0.239),差异均有统计学意义(t=13.055,13.606,均P<0.001),见图2c。qRT-PCR 检测显示,siECE2#1 组(0.373±0.018)和siECE2#组(0.352±0.015)细胞中E2F1 mRNA表达水平明显低于对照组(1.012±0.013),差异有统计学意义(F=703.020,P<0.001);siECE2#1组(0.415±0.017)和siECE2# 组(0.396±0.016)中MYC mRNA 表达水平也明显低于对照组(1.014±0.012),差异有统计学意义(F=613.395,P<0.001),见图2d。蛋白免疫印迹实验检测显示:siECE2#1 组(0.485±0.044) 和siECE2# 组(0.287±0.035)细胞中E2F1 蛋白表达低于对照组(1.057±0.086),差异有统计学意义(F=136.301,P<0.001);siECE2#1 组(0.557±0.048) 和siECE2#组(0.557±0.048)细胞中MYC 蛋白也显著低于对照组(1.048±0.079),差异有统计学意义(F=102.573,P<0.001),见图2e。提示ECE2可正向调控E2F1,MYC 表达,其可能通过调控E2F1,MYC 表达进而促进乳腺癌发生发展。

图2 ECE2 调控乳腺癌发生发展的作用验证
2.4 ECE2 通过上调E2F1 和MYC 表达促进乳腺癌生长 研究在敲低ECE2 表达效果显著的siECE2#2组细胞中分别回补E2F1 和MYC,发现在敲低ECE2 表达的细胞中重新过表达E2F1 和MYC 后,细胞增殖速率又回归正常水平,见图3。各组吸光度值见表2。进一步说明ECE2 主要通过促进E2F1和MYC 的表达从而促进乳腺癌的发展进程。
表2 不同时间点各组细胞吸光度值(±s)
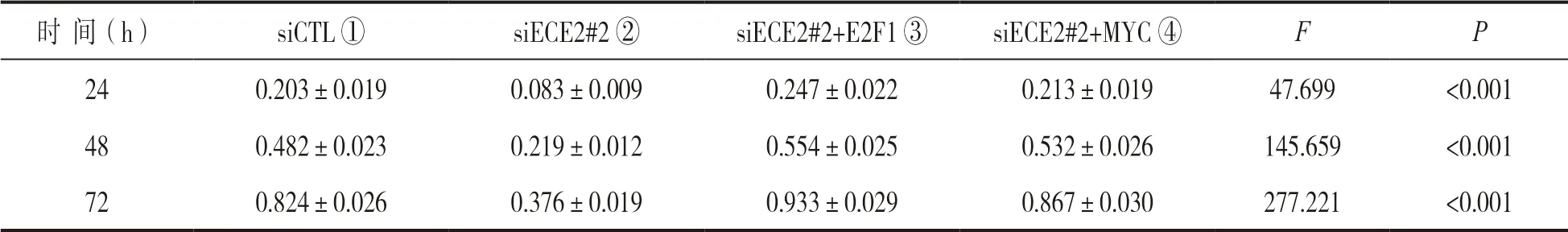
表2 不同时间点各组细胞吸光度值(±s)
注:24,48,72 h 时,②组分别与①③④组相比,均P<0.05;各时间点①③④组差异均无统计学意义(P >0.05)。
时 间(h)siCTL ①siECE2#2 ②siECE2#2+E2F1 ③siECE2#2+MYC ④F P 24 0.203±0.0190.083±0.0090.247±0.0220.213±0.01947.699<0.001 48 0.482±0.0230.219±0.0120.554±0.0250.532±0.026145.659<0.001 720.824±0.0260.376±0.0190.933±0.0290.867±0.030277.221<0.001

图3 回补实验验证
3 讨论
研究前期为找寻乳腺癌新的分子靶基因,通过GEPIA 数据库筛选发现相比于291 个邻近正常组织,有1 085 个乳腺癌组织中ECE2 显著高表达,且发现随着乳腺癌临床分期越高癌组织中ECE2 表达水平越高,与乳腺癌恶性程度呈正相关;ECE2高表达乳腺癌患者五年预后生存率为73.5%,明显低于其低表达患者的94.8%(LogrankP=0.0053),提示ECE2 基因高表达在乳腺癌发生发展中应扮演某种重要角色。既往研究发现,ECE2 主要在神经组织中表达,主要在锥体神经元中被检测到,星形胶质细胞和小胶质细胞中也有少量表达[6]。ECE2四个亚型都位于细胞内分泌囊泡中,均能够在轻度酸性条件下降解细胞内神经肽[7]。ECE2 基因编码变异可用于识别阿尔茨海默病[10]。ECE2 在人类皮层发育过程中调节神经发生和神经元迁移[11]。而目前关于ECE2 的表达和功能研究较少,其在乳腺癌中的表达作用尚不明确,故进一步探究其对乳腺癌细胞生物学行为的影响对临床乳腺癌的研究具有重要意义。本研究经检测20 组乳腺癌临床组织样本中ECE2 表达,发现既往数据库结果一致均显著高于正常组织,暗示ECE2 在乳腺癌发生发展进程中发挥致癌基因属性。根据ECE2 的临床特征研究探究了其在乳腺癌中的功能及其分子机制,转染siRNA 介导敲低乳腺癌MCF7 细胞中ECE2 表达,经体外细胞增殖实验、克隆形成实验、划痕迁移实验及细胞周期实验探究发现,敲低ECE2 表达后MCF7 细胞增殖率、克隆形成速率及细胞迁移速率均显著减慢,促使细胞周期显著阻滞在G1 期,证实了ECE2 高表达的致癌性;接着研究利用与ECE2 共表达基因参与的信号通路发现ECE2 可调控促癌基因E2F1 和MYC 的表达,故进一步探究了其与E2F1 和MYC 基因间的相互调控作用。
目前,已在哺乳动物细胞中鉴定出8 种E2F因子,并按其发现顺序编号为E2F1-8[12]。在人类乳腺癌中,E2F 被认为具有复杂的作用。据报道,E2F1 表达上调参与了乳腺癌的癌变,其结果是参与了Nanog 表达的抑制[13]。LIU 等[14]报道,转录因子E2F1 与HBXIP 共表达发挥激活作用,诱导PKM2 表达,进而促进雌激素受体阳性(ER+)乳腺癌细胞的增殖。抑制E2F1 可抑制MCF7 细胞增殖并诱导其凋亡[15];E2F1 及其与组蛋白脱乙酰基酶(HDAC)的复合物在下调乳腺癌细胞中抑癌基因ARHI 的表达中起重要作用[16],表示E2F1 在乳腺癌中发挥致癌作用,与以上报道一致的是,本研究发现敲低ECE2 在乳腺癌细胞中的表达后,E2F1表达显著降低,导致乳腺癌细胞生长增殖速率减慢;但在敲低ECE2 表达的乳腺癌细胞中回补E2F1,细胞增殖速率又回归正常水平,说明ECE2 促进乳腺癌进程主要通过调控E2F1 来实现。
原癌基因c-MYC 控制细胞增殖与细胞死亡之间的平衡[17]。致癌基因c-MYC 通过蛋白质的基本螺旋与Max 蛋白形成异源二聚体,调节靶基因的转录活性,包括代谢酶和细胞周期调节剂,如细胞周期蛋白D2[18]。此外,c-Myc 的表达上调会影响肿瘤发生,例如c-Myc 过度表达与乳腺癌,NSCLC和前列腺癌有关[19-21]。本研究发现敲低ECE2 表达后乳腺癌细胞中MYC 表达也显著降低,导致乳腺癌细胞生长增殖速率减慢,但在敲低ECE2 表达的乳腺癌细胞中回补MYC,细胞增殖速率又回归正常水平,进一步说明了ECE2 促进乳腺癌进程也可通过调控MYC 来实现。然而肿瘤的发生发展是多基因、多通路共同作用的结果,癌基因参与调控肿瘤进程的分子机制复杂,故ECE2 在乳腺癌中的表达调控作用机制还需通过更深入的信号分子通路进一步研究探明。
综上所述,ECE2 在乳腺癌中高表达导致促癌靶基因E2F1 和MYC 显著高表达,从而促进乳腺癌细胞生长增殖、克隆形成和迁移,并缩短细胞周期G1 进程,从而导致乳腺癌的发生发展。

