动态监测VEGF、HBP、NGAL在肺癌手术前后水平变化及与预后的关系
李伟 茹玉航 王林
全球癌症数据统计表明,肺癌在男性恶性肿瘤发病和死亡率占据第一位,在女性发病率、死亡率分别位居第三、第二位[1]。外科手术是肺癌首选治疗方法,早期肺癌术后5年生存率达70%以上,而局部中晚期肺癌仅约20%[2]。肺癌预后相关研究一直备受临床关注,随现代分子生物学发展,发现了多种与肺癌侵袭、转移相关的标志物,能否用于手术疗效及预后监测尚无明确定论。血管内皮生长因子(Vascular endothelial growth factor,VEGF)是作用最强、特异性最高的促血管生长因子,在肺癌侵袭、转移中发挥重要作用[3]。中性粒细胞明胶酶相关载脂蛋白(Neutrophil gelatinase-associated lipocalin,NGAL)参与炎症免役应答、细胞分化与凋亡、肿瘤发生发展等过程,成为肺癌研究领域新的切入点[4]。另研究证实,肝素结合蛋白(Heparin-binding protein,HBP)在多种肿瘤组织中表达上调,可作为独立预后因素[5]。本研究尝试动态监测VEGF、HBP、NGAL 在肺癌手术前后水平变化,并探究其与预后的关系。报道如下。
1 资料与方法
1.1 一般资料
选取2017年7月至2020年12月本 院80 例肺癌患者作为研究对象,根据患者术后复发情况分组,未复发组(n=68),其中男57 例,女11 例,年龄平均(59.75±7.41)岁,临床分期:Ⅰ期25 例,Ⅱ期33 例,Ⅲ期10 例;复发组(n=12),其中男8 例,女4 例,年龄平均(61.84±6.43)岁,临床分期:Ⅱ期6 例,Ⅲ期6 例。
纳入标准:①均经病理学明确且首次诊断为进展期肺癌[6];②预计生存时间≥6 个月;③采取手术治疗;④术前均未进行放化疗治疗;⑤患者及家属知情同意。排除标准:①合并其他恶性肿瘤;②术前有感染性疾病;③术后出现严重并发症;④合并重要脏器转移;⑤合并肝炎、糖尿病、冠心病、脑血管疾病、高血压等疾病。两组年龄、性别差异无统计学意义(P>0.05);本研究经本院伦理委员会审批通过。
1.2 方法
①术前及术后3 d 取空腹静脉血3 mL,离心(半径8 cm,3 500 r/min,9 min),取血清,采用酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)测定VEGF、HBP、NGAL,均采用上海江莱生物科技有限公司试剂盒。②Logistic 多因素回归分析肺癌术后复发影响因素,受试者工作特征(Receiver operating characteristic curve,ROC)曲线分析VEGF、HBP、NGAL 水平对预后(术后复发为预后差)的预测价值。
1.3 观察指标
①不同预后患者手术前后VEGF、HBP、NGAL水平。②预后Logistic 多因素回归分析。③VEGF、HBP、NGAL 水平对预后的预测价值。
1.4 统计学方法
采用统计学软件SPSS 22.0 处理数据,计数资料以n(%)描述,计量资料以()描述,两组间比较用t检验;影响因素采用Logistic 多因素回归分析;预测价值采用ROC 曲线,获取AUC、置信区间、敏感度、特异度及cut-off 值,联合预测实施Logistic二元回归拟合,返回预测概率logit(p),将其作为独立检验变量。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同预后患者手术前后VEGF、HBP、NGAL水平
两组术前VEGF、HBP、NGAL 水平相比,差异无统计学意义(P>0.05),术后复发组VEGF、HBP、NGAL 水平均高于未复发组,差异有统计学意义(P<0.05)。见表1。
2.2 预后Logistic 多因素回归分析
以肺癌患者术后复发情况为因变量(未复发=0,复发=1),将表1中差异有统计学意义的因素作为自变量,纳入Logistic 多因素回归模型,结果显示,术后VEGF、HBP、NGAL 水平均为肺癌患者术后复发影响因素(P<0.05)。见表2。
表1 不同预后患者手术前后VEGF、HBP、NGAL 水平(±s)Table 1 The levels of VEGF,HBP,and NGAL in patients with different prognosis before and after surgery(±s)
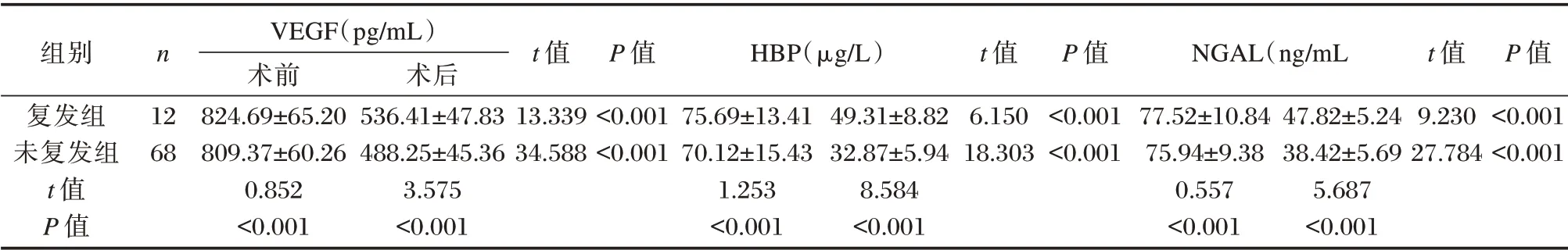
表1 不同预后患者手术前后VEGF、HBP、NGAL 水平(±s)Table 1 The levels of VEGF,HBP,and NGAL in patients with different prognosis before and after surgery(±s)
组别复发组未复发组t 值P 值n 12 68 VEGF(pg/mL)术前824.69±65.20 809.37±60.26 0.852<0.001术后536.41±47.83 488.25±45.36 3.575<0.001 t 值13.339 34.588 P 值<0.001<0.001 HBP(μg/L)75.69±13.41 70.12±15.43 1.253<0.001 49.31±8.82 32.87±5.94 8.584<0.001 t 值6.150 18.303 P 值<0.001<0.001 NGAL(ng/mL 77.52±10.84 75.94±9.38 0.557<0.001 47.82±5.24 38.42±5.69 5.687<0.001 t 值9.230 27.784 P 值<0.001<0.001
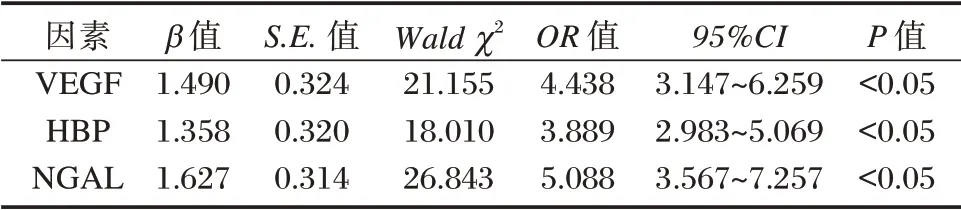
表2 预后Logistic 多因素回归分析Table 2 Logistic multivariate regression analysis of prognosis
2.3 VEGF、HBP、NGAL 水平对预后的预测价值
绘制ROC 曲线,术后VEGF、HBP、NGAL 水平联合对预后的预测AUC 最大,具有良好预测效能。见表3,图1。
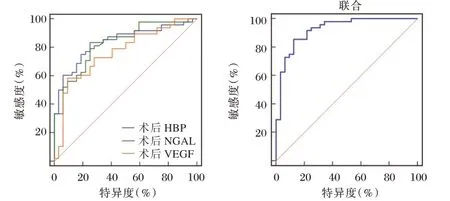
图1 ROC 曲线Figure 1 ROC curve

表3 VEGF、HBP、NGAL 水平对预后的预测价值Table 3 The prognostic value of VEGF,HBP and NGAL levels
3 讨论
肺癌恶性程度高,即使在早期行根治性手术,5年生存率仍较低。肿瘤侵袭、转移与肺癌预后有关。随现代分子生物学发展,发现多种与肺癌侵袭、转移相关的肿瘤标志物,如VEGF、HBP、NGAL,能否作为肿瘤标志物用于肺癌手术疗效及预后监测是一直困扰我们的问题。
血管生成是癌症转移和复发的主要原因,几乎所有实体瘤生长、转移均依赖于肿瘤血管生成[7]。新生肿瘤血管不仅是癌细胞增殖的内部条件,也是癌细胞浸润和血行转移的第一路径。VEGF 是作用最强的促血管生长因子,大量研究证实,VEGF 可作为评估肺癌恶性程度及预后的参考指标[8-9]。本研究结果提示VEGF 可能与肺癌术后复发有关。VEGF 可诱导血管内皮细胞产生间质胶原酶、蛋白水解酶等促进血管生成,且可提高血管通透性,引起肿瘤间质水肿,利于肿瘤浸润及转移[10]。因此,VEGF 与肺癌术后复发有关。
NGAL 是lipocalin 家族成员之一,其氨基酸序列及DNA 内含子和外显子的排列有着高度保守性,在免疫调节及维持细胞内环境稳定中发挥重要作用[11]。目前,已发现NGAL 与多种疾病有关,其对急性肾损伤、脓毒症有明确预测价值,也参与慢性阻塞性肺疾病、冠心病等发生发展[12]。近年来,NGAL 与肿瘤的关系愈发受到重视,在食管癌、乳腺癌、膀胱癌、胃癌等恶性肿瘤中呈显著高表达[13]。在肺癌中,研究证实,NGAL 在患者原位肿瘤、血清、胸腔积液均有明显高表达[14-15]。本研究数据显示,肺癌术后复发患者NGAL高表达,为肺癌患者术后复发影响因素。
HBP 在凝血、细胞分化及肿瘤发生发展等过程中发挥重要调节作用。目前,关于HBP 在肺癌中的研究鲜有报道。本研究探讨HBP 与肺癌术后复发的关系,发现,HBP 为肺癌术后复发影响因素。抗凝药物肝素(HP)及其结构类似物硫酸乙酰肝素(HS)均为高度硫酸化糖胺聚糖家族成员,研究证实,HS/HP 通过糖链中大量精细寡糖片段与HBP 相互作用,发挥抗肿瘤转移作用[16]。此可能为HBP 参与肺癌术后复发的关键机制,但临床尚无相关验证,有待进一步证实。ROC 曲线是兼顾灵敏度和特异性的诊断试验评价工具,而基于Logistic 回归的ROC 曲线可用于联合指标预测效能评价。本研究ROC 曲线显示,结果提示临床可同时检测VEGF、HBP、NGAL,为肺癌患者预后预测提供更全面、可靠的参考信息。因此,建议肺癌患者术后应定期检测VEGF、HBP、NGAL,准确估计其复发转移的可能性,在复发转移前即得到及时治疗,以有效延长生存期。
综上可知,动态监测VEGF、HBP、NGAL 可有效预测肺癌患者术后预后情况,利于评估复发转移风险,开展针对性防治措施。本研究所选病例中复发率符合以往文献复发比例,但本研究存在一定不足,如样本量较小,还需临床多中心、多渠道取样,做进一步证实。

