外周血NLR、PLR及胸水ADA、LDH在鉴别胸腔积液性质中的应用
雷震 王震 郭锋
正常人胸膜腔内少量液体可在呼吸运动时起到润滑作用,虽然正常人中每天有大量胸水形成,但其滤过与吸收处于动态平衡。倘若发生全身或局部病变,则会破坏这种平衡,并导致胸膜腔内液体形成迅速而吸收缓慢,最终产生胸腔积液[1-2]。因胸腔积液发病因素众多,不同类型的胸腔积液致病机理不同,其治疗方案不同,尤其是对于恶性胸腔积液患者而言,明确胸腔积液类型能帮助患者尽早接受治疗。国内外研究证实[3-4],胸水腺苷脱氨酶(adenosine deaminase,ADA)、乳酸脱氢酶(lactate dehydrogenase,LDH)有助于临床医师鉴别胸腔积液的性质,但其鉴别效果有限。近来有学者发现[5],在不同病因胸腔积液患者中,其炎症性标志物也呈现不同的变化趋势,外周血中性粒细胞和淋巴细胞比值(ratio of neutrophils to lymphocytes,NLR)与血小板和淋巴细胞比值(ratio of platele to lymphocytes,PLR)或可用于鉴别胸腔积液性质。基于此,本研究就外周血NLR、PLR 及胸水ADA、LDH 在胸腔积液不同性质患者中的表达及临床价值进行分析,以期提高临床对胸腔积液的鉴别效果。分析结果呈报如下。
1 资料与方法
1.1 一般资料
选取2019年5月至2020年10月本院呼吸内科住院的100 例胸腔积液患者作为研究对象,其中患者男55 例、女45 例,年龄18~79 岁,最终确诊36 例为TPE、31 例为BPE、33 例为MPE。诊断为MPE 的33 例患者中,原发病灶肺腺癌20 例、小细胞肺癌4例、鳞癌3 例、乳腺癌2 例、其他4 例。所有患者以最终出院结果分为结核性胸腔积液(tuberculosis pleural effusion,TPE)组、细菌性胸腔积液(bacterial pleural effusion,BPE)组以及恶性胸腔积液(malignant pleural effusion,MPE)组。
纳入标椎:①临床资料完整;②所有患者均符合《实用内科学》[6]中胸腔积液相关诊断标椎,并经实验室、病理学、影像学等手段确诊;③均获取始段胸水,且为渗出性胸腔积液;④年龄≥18 岁。④所有患者均知情同意。排除标椎:①既往明确诊断为肺结核、肺癌等疾病;②非首次胸腔积液者;③合并肺不张、肺栓塞、阻塞性肺炎等其他肺部疾病;④检查前已接受胸腔内给药或其他局部治疗者;⑤不明原因所造成的胸腔积液;⑥合并血液系统疾病、免疫系统疾病;⑦使用糖皮质激素或激动剂者。本研究获医学伦理委员会批准。
1.2 方法
所有患者入院24 h 内均收集外周血、始段胸腔积液:取血液标本上XE-2100 全自动血液分析仪(Sysmex 公司,日本)及配套试剂检测中性粒细胞(neutrophils,N)、淋巴细胞(lymphocytes,L)及血小板计数(platelet count,PLT),并计算NLR 与PLR;获取胸腔积液标本于30 min 内离心并收集上清液,于-80℃保存待用,取标本上AU1000全自动生化分析仪(OLYMPUS 公司,日本)采用酶显色法检测ADA水平(试剂及质控物由Beckman 公司提供),另取标本上AU1000 全自动生化分析仪采用酶速率法检测LDH水平(试剂及质控物由Randox公司提供)。
1.3 统计学处理
采用统计软件SPSS 22.0 处理数据,计数资料用n(%)表示,行χ2检验;计量资料用()表示,多组间采用单因素方差分析、两组间比较采用t检验;相关性采用Pearson分析,鉴别价值行受试者工作特征曲线(ROC),以曲线下面积(AUC)。以P<0.05为差异有统计学意义。
2 结果
2.1 各组一般资料比较
3组患者性别、年龄、胸腔积液量、胸腔积液位置等一般资料比较,差异均无统计学意义(P>0.05)。见表1。
表1 3 组患者一般资料比较[n(%),(±s)]Table 1 Comparison of general data of patients in the 3 groups[n(%),(±s)]
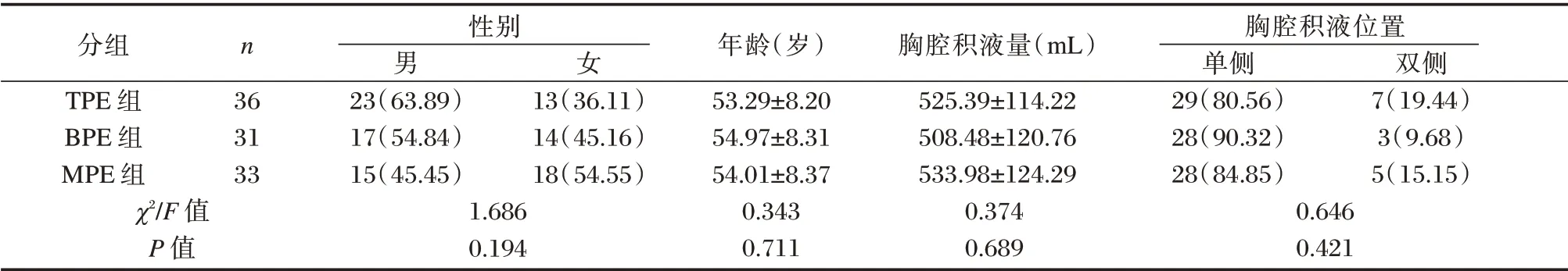
表1 3 组患者一般资料比较[n(%),(±s)]Table 1 Comparison of general data of patients in the 3 groups[n(%),(±s)]
分组TPE 组BPE 组MPE 组χ2/F 值P 值n 性别男23(63.89)17(54.84)15(45.45)1.686 0.194女36 31 33 13(36.11)14(45.16)18(54.55)年龄(岁)53.29±8.20 54.97±8.31 54.01±8.37 0.343 0.711胸腔积液量(mL)525.39±114.22 508.48±120.76 533.98±124.29 0.374 0.689胸腔积液位置单侧29(80.56)28(90.32)28(84.85)0.646 0.421双侧7(19.44)3(9.68)5(15.15)
2.2 各组外周血NLR、PLR 水平比较
3 组患者外周血NLR 水平比较,差异有统计学意义(P<0.05),PLR 水平比较,差异无统计学意义(P>0.05)。见表2。
表2 3 组外周血NLR、PLR 水平比较(±s)Table 2 Comparison of NLR and PLR levels in peripheral blood of the 3 groups(±s)
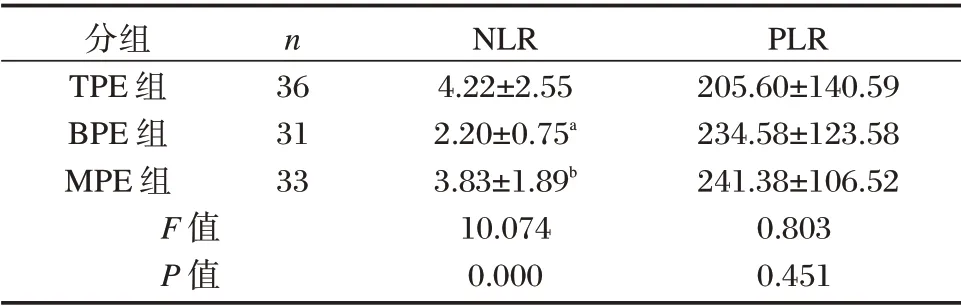
表2 3 组外周血NLR、PLR 水平比较(±s)Table 2 Comparison of NLR and PLR levels in peripheral blood of the 3 groups(±s)
注:与TPE 组比较,aP<0.05;与BPE 组比较,bP<0.05。
PLR 205.60±140.59 234.58±123.58 241.38±106.52 0.803 0.451分组TPE 组BPE 组MPE 组n 36 31 33 F 值P 值NLR 4.22±2.55 2.20±0.75a 3.83±1.89b 10.074 0.000
2.3 各组胸水ADA、LDH 水平比较
3 组患者胸水ADA、LDH 水平比较,差异有统计学意义(P<0.05)。TPE 组胸水ADA 水平均显著高于BPE 组、MPE 组,差异有统计学意义(P<0.05),BPE 组与MPE 组胸水ADA 比较,差异无统计学意义(P>0.05);BPE 组胸水LDH 均显著高于TPE 组、MPE 组,差异有统计学意义(P<0.05),TPE组与MPE 组胸水LDH 比较差异无统计学意义(P>0.05)。见表3。
表3 3 组胸水ADA、LDH 水平比较(±s)Table 3 Comparison of ADA and LDH levels in pleural fluid of the three groups(±s)

表3 3 组胸水ADA、LDH 水平比较(±s)Table 3 Comparison of ADA and LDH levels in pleural fluid of the three groups(±s)
注:与TPE 组比较,aP<0.05;与BPE 组比较,bP<0.05。
分组TPE 组BPE 组MPE 组n 36 31 33 F 值P 值ADA(U/L)45.88±8.27 13.76±2.19a 14.13±2.40a 418.563 0.000 LDH(U/L)307.27±73.4 564.92±108.44a 313.85±74.08b 93.774 0.000
2.4 外周血NLR、PLR 与胸水ADA、LDH 相关性分析
Pearson分析结果显示,外周血NLR 与胸水ADA 水平呈正相关(r=0.432,P=0.000),与胸水LDH 呈负相关(r=-0.615,P=0.000);外周血PLR与胸水ADA、LDH 均无相关性(P=0.197、0.155)。
2.5 生化指标对MPE 的预测价值
ROC 曲线结果显示,三项联合诊断AUC、特异度分别为0.995、0.955,且联合鉴别AUC 显著高于外周血NLR 及胸水ADA、LDH 单独鉴别效果(Z=6.047、5.212、5.723,P=0.000、0.000、0.000)。见表4、图1。
表4 3 组胸水ADA、LDH 水平比较(±s,U/L)Table 4 Comparison of ADA and LDH levels in pleural fluid of 3 groups(±s,U/L)

表4 3 组胸水ADA、LDH 水平比较(±s,U/L)Table 4 Comparison of ADA and LDH levels in pleural fluid of 3 groups(±s,U/L)
因子NLR ADA LDH联合AUC 0.643 0.737 0.696 0.995标准错误0.058 0.049 0.052 0.005 95%CI 0.529~0.758 0.641~0.832 0.595~0.797 0.986~1.000最佳截断值2.745 18.945U/L 447.04U/L 19.974敏感度0.697 0.970 1.000 1.000特异度0.597 0.552 0.418 0.955约登指数0.294 0.522 0.418 0.955 P 值0.020 0.000 0.002 0.000

图1 ROC 曲线Figure 1 ROC curve
3 讨论
渗出性病因比较复杂,诊断相对困难,不同病因的处理方法也有所不同。TPE 是一种由结核分枝杆菌(mycobacterium tuberculosis,MTB)及其代谢产物进入已致敏机体所引发的迟发型过敏性反应[7],巨噬细胞、中性粒细胞等均参与其中,但到后期则主要由T 细胞介导。MPE 通常是由肺癌、乳腺癌、淋巴瘤等恶性肿瘤侵犯或转移至胸膜,阻塞淋巴管而降低胸水重吸收能力[8-9]。BPE 主要继发于肺炎或肺脓肿,为病原菌感染胸膜后导致胸膜血管通透性增加、蛋白增加及胸腔内细胞的聚集进而导致胸腔积液的发生。不同类型的胸腔积液治疗方式有所不同。临床对于TPE 的处理则在于尽快抽取积液的同时给予早期、规律、全程、适量及联合的化学治疗[10]。研究表明[11],胸腔积液细胞学首次采样敏感度低,连续三次送检敏感度才能够接近90%,这也就导致细胞学检查需要耗费更长的时间,极易延误治疗时机。因此,寻求可靠且临床可广泛开展的实验室指标以提高胸腔积液的鉴别效果,也是当前学者们关注的重点。
既往大量研究显示[3-4],胸水ADA、LDH 可用于鉴别胸水性质。本研究中三组患者ADA、LDH 差异显著,且ROC 曲线也显示胸水ADA、LDH 可用于鉴别MPE,与既往研究一致[12]。本研究中结果与既往研究类似[13]。且已有研究显示[14],胸腔积液患者外周血NLR、PLR 与正常人差异显著。对于外周血PLR 是否能够用于胸腔积液的鉴别,需要后续研究。相关性分析结果显示,NLR 与胸水ADA、LDH均呈一定相关性,ROC 曲线进一步表明,NLR 可用于鉴别MPE,与韦文君等人[15]研究一致。
本研究尝试分析外周血NLR、PLR 及胸水ADA、LDH 在鉴别不同性质胸腔积液中的应用价值,结果显示外周血PLR 水平在不同类型的胸腔积液患者中并无显著变化,但外周血NLR 及胸水ADA、LDH 均显著变化且可用于鉴别MPE。受限于本研究为回顾性研究,未能获取患者临床症状、胸部CT表现、肝肾功能等相关资料,以帮助临床医师更好的鉴别不同性质的胸腔积液;此外,本研究仅分析渗出性胸腔积液、整体恶性胸腔积液患者外周血及胸水生化因子的变化水平,未分析漏出性胸腔积液、不同病因恶性胸腔积液中各生化因子的变化水平:这些都需要后续研究。但总体而言,临床医师可结合外周血NLR 及胸水ADA、LDH 水平以鉴别恶性胸腔积液。

