磁共振扩散张量成像联合1H-MRS技术在HIE诊断及病情评估中的应用
于洪福 尹超 姜云飞
新生儿缺氧缺血性脑病(Hypoxic ischemic encephalopathy,HIE)是导致新生儿死亡、遗留永久性神经缺陷的重要原因[1-2]。目前临床诊断新生儿HIE 主要根据患儿窒息史、阿氏评分(Apgar)<5分、神经系统体征异常等,但其存在一定主观性,缺少量化指标。近年来,随影像学技术持续发展,磁共振成像(Magnetic Resonance Imaging,MRI)逐渐成为多种疾病的重要检查手段[3],但其在脑损伤评估方面存在延迟性。磁共振扩散张量成像(diffusion tensor imaging,DTI)可呈现脑白质纤维束损伤程度,定量判断脑损伤与脑髓鞘发育程度。氢质子磁共振波谱(1H-magnetic resonance spectroscop,1H-MRS)技术通过分子水平可弥补常规MRI 检查缺点,无创定量评价活体器官组织代谢及生化代谢物[4],然而关于其与DTI 联合对新生儿HIE 的诊断价值临床鲜有报道。基于此,本研究尝试分析DIT 联合1H-MRS 技术参数在新生儿HIE诊断及病情评估中的应用效果。详情如下。
1 资料和方法
1.1 一般资料
选取本院2018年1月 至2020年6月HIE 患儿108 例作为观察组,另选取同期正常新生儿54例作为对照组。其中观察组女45 例,男63 例,日龄平均(3.46±0.65)d;对照组女20 例,男34例,胎龄平均(39.25±0.37)周。两组性别、日龄等基本资料均衡可比(P>0.05)。本院伦理委员会经审核评议同意所有研究对象监护人均签署知情同意书。
纳入标准:①观察组均符合《新生儿缺氧缺血性脑病诊断标准》[5]中HIE 诊断标准;②对照组无围生期窒息史与宫内窘迫史及羊水Ⅲ度污染;未出现持续≥5 min 胎心<100 次/min;出生后1 min、5 min Apgar 分均≥8 分。排除标准:①合并中枢系统异常、神经系统感染或染色体病症者;②先天畸形或遗传代谢障碍者;③电解质紊乱、颅内出血或产伤等原因所致抽搐者;④血红蛋白<120 g/L 者;⑤监护人精神行为异常。
1.2 方法
两组检查前均由儿科医生对新生儿检查耐受情况进行评估,以保证安全性。于检查前20~30 min 注射(3~5)mg/kg 苯巴比妥钠,棉花团填塞外耳道,固定头部。应用GE360 1.5T 超导型MR 成像仪,选择头颅专用线圈,行仰卧位,头朝向进场方向。扫描参数:①DTI:采用单次激发自旋回波-回波平面成像、矢状位3D-T1WI 序列,回波时间/重复时间为88/2 700 ms,层距/层厚为1.0/4.0 mm,矩阵为128×128,弥散敏感梯度方向数30 个,b 值为1 000 s/m2,视野为180 mm×180 mm。②1HMRS 技术:采用液体衰减反转恢复序列、轴位T1WI-自旋回波、快速自旋回波T2 加权像序列对颅顶至颅底扫描,层距/层厚为1.0/4.0 mm,矩阵为512×512,视野为180 mm×180 mm,层数15 层;液体衰减反转恢复序列回波时间/重复时间为94/8 500 ms;T2WI 序列回波时间/重复时间为95/5 500 ms。采集总时间为6 min 45 s。将上述所得数据传至工作站进行后处理,在内囊后肢、内囊前肢、胼胝体压部、胼胝体膝部、半卵圆中心、额叶白质及豆状核选取感兴趣区域,计算各向异分数(FA)值,并获取IH-MRS 图,自动测量基底节区、额叶区N-乙酰天门冬氨酸(NAA)、肌酸(Cr)、胆碱复合物(Cho)峰下面积,人工计算NAA/Cr、NAA/Cho、Cho/Cr 值,上述均测量3 次取平均值。见图1。
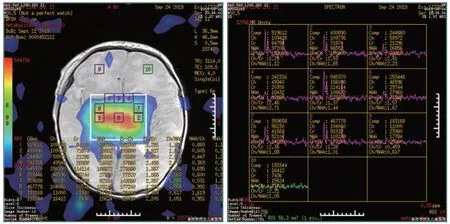
图1 感兴趣区域的测量Figure 1 Measurement of the region of interest
1.3 观察指标
①比较两组DTI、1H-MRS 技术参数。②比较观察组不同病情程度患儿DTI、1H-MRS 技术参数及神经行为发育(neonatal behviors neurological assessment,NBNA)评分,其中病情程度根据MRI 表现进行评估[6]:皮质及皮质下沿脑回发现细条状、斑点状异常信号为轻度;伴有上述轻度表现外,深部脑白质发现对称性片状、点状异常信号为中度;伴有上述中度表现外,基底神经节区信号异常,存在内囊后肢T1WI 低信号,弥漫性脑水肿,脑室内出血且系统扩大为重度;NBNA 评分包括一般状态、原始反射、被动肌张力、主动肌张力及行为能力,共20 项,每项0~2 分,得分与神经行为发育呈负相关。③分析DTI、1H-MRS 技术参数与HIE 患儿病情程度、NBNA 评分相关性。④分析DTI 参数、1H-MRS 技术参数对HIE 的诊断价值。
1.4 统计学方法
采用统计学软件SPSS 22.0 处理数据,计量资料以()描述,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析;计数资料用n(%)表示、χ2检验;相关性分析采用Pearson相关系数模型;诊断效能分析采用受试者工作特征(ROC)曲线,获取曲线下面积(AUC),联合诊断实施Logistic 二元回归拟合,返回预测概率logit(p),将其作为独立检验变量。P<0.05 为差异有统计学意义。
2 结果
2.1 两组DTI、1H-MRS 技术参数
观察组内囊后肢、内囊前肢、胼胝体压部、胼胝体膝部、半卵圆中心、额叶白质FA 值、基底节区、额叶区NAA/Cr、NAA/Cho 低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组DTI、1H-MRS 技术参数比较(±s)Table 1 Comparison of DTI and 1H-MRS technical parameters of the two groups(±s)

表1 两组DTI、1H-MRS 技术参数比较(±s)Table 1 Comparison of DTI and 1H-MRS technical parameters of the two groups(±s)
参数DTI 参数(FA 值)内囊后肢内囊前肢胼胝体压部胼胝体膝部半卵圆中心额叶白质豆状核1H-MRS 技术参数基底节区NAA/Cr NAA/Cho Cho/Cr额叶区NAA/Cr NAA/Cho Cho/Cr观察组(n=108)0.492±0.027 0.391±0.018 0.603±0.014 0.570±0.020 0.236±0.031 0.233±0.022 0.140±0.019对照组(n=54)0.533±0.036 0.408±0.022 0.613±0.015 0.592±0.027 0.258±0.020 0.260±0.025 0.142±0.016 t 值8.124 5.253 4.184 5.851 4.741 7.032 0.664 P 值<0.001<0.001<0.001<0.001<0.001<0.001 0.507 0.96±0.05 0.74±0.06 1.13±0.15 1.02±0.06 0.80±0.07 1.15±0.17 1.20±0.09 0.68±0.07 1.63±0.18 1.28±0.10 0.79±0.12 1.61±0.17 6.727 5.670 0.765 5.138 7.358 0.679<0.001<0.001 0.064<0.001<0.001 0.498
2.2 观察组不同病情程度患儿DTI、1H-MRS 技术参数及NBNA 评分
观察组内囊后肢、内囊前肢、胼胝体压部、胼胝体膝部、半卵圆中心、额叶白质FA 值、基底节区、额叶区NAA/Cr、NAA/Cho、NBNA 评分随病情程度增加呈逐渐降低趋势(P<0.05)。见表2。
表2 观察组不同病情程度患儿DTI、1H-MRS 技术参数及NBNA 评分比较(±s)Table 2 Comparison of DTI,1H-MRS technical parameters and NBNA scores of children with different disease levels in the observation group(±s)

表2 观察组不同病情程度患儿DTI、1H-MRS 技术参数及NBNA 评分比较(±s)Table 2 Comparison of DTI,1H-MRS technical parameters and NBNA scores of children with different disease levels in the observation group(±s)
参数DTI 参数(FA 值)内囊后肢内囊前肢胼胝体压部胼胝体膝部半卵圆中心额叶白质豆状核1H-MRS 技术参数NAA/Cr NAA/Cho Cho/Cr NAA/Cr NAA/Cho Cho/Cr NBNA 评分(分)轻度患儿(n=43)中度患儿(n=36)重度患儿(n=29)F 值P 值0.511±0.020 0.405±0.013 0.614±0.015 0.584±0.017 0.253±0.012 0.248±0.014 0.143±0.022 0.494±0.016 0.393±0.010 0.602±0.011 0.569±0.014 0.238±0.009 0.237±0.008 0.140±0.019 0.460±0.013 0.370±0.008 0.591±0.007 0.552±0.010 0.211±0.006 0.209±0.009 0.138±0.023 78.080 90.347 32.572 42.972 162.631 110.748 0.502<0.001<0.001<0.001<0.001<0.001<0.001 0.607 1.02±0.05 0.79±0.06 1.11±0.13 1.29±0.04 0.75±0.10 1.65±0.21 34.15±2.38 0.94±0.03 0.75±0.04 1.12±0.15 1.18±0.12 0.66±0.07 1.63±0.20 28.03±2.17 0.90±0.02 0.66±0.05 1.17±0.18 1.09±0.14 0.60±0.05 1.60±0.16 21.46±2.04 97.204 56.130 1.467 33.449 32.595 0.573 284.468<0.001<0.001 0.235<0.001<0.001 0.566<0.001
2.3 DTI、1H-MRS 技术参数与HIE 患儿病情程度、NBNA 评分相关性
Pearson 相关性分析,内囊后肢、内囊前肢、胼胝体压部、胼胝体膝部、半卵圆中心、额叶白质FA值、基底节区、额叶区NAA/Cr、NAA/Cho 与HIE 患儿病情程度呈负相关,与NBNA 评分呈正相关(P<0.05)。见表3。

表3 DTI、1H-MFA 值RS 技术参数与HIE 患儿病情程度、NBNA 评分相关性Table 3 Correlation between DTI,1H-MFA value,RS technical parameters,disease severity and NBNA score in children with HIE
2.4 DTI 联合1H-MRS 技术参数对HIE 诊断价值
选取DTI 诊断价值最优的参数与1H-MRS 技术诊断价值最优的参数获取联合诊断AUC 为0.888,95%CI为0.829~0.947 敏感度为86.11%,特异度为81.48%,优于各参数单独诊断(P<0.05)。见图2。
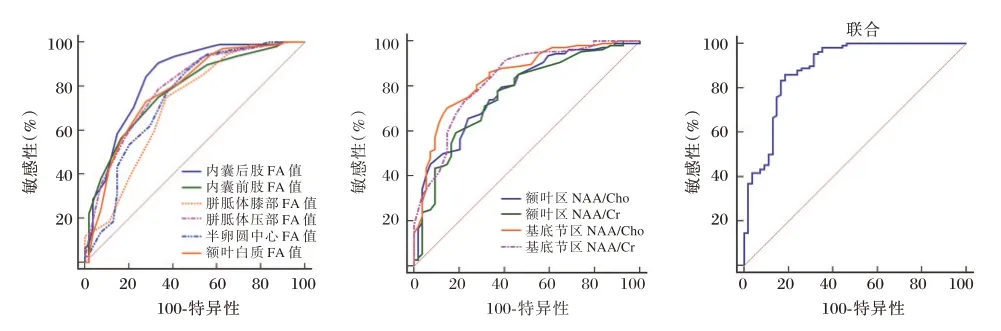
图2 各参数对HIE 诊断价值Figure 2 The diagnostic value of each parameter to HIE
3 讨论
调查显示,HIE 所致脑白质发育不良与髓鞘化功能障碍是患儿遗留脑性瘫痪、智力障碍等后遗症的主要因素[7]。DTI 是目前唯一无创性探讨活体脑白质纤维的MR 技术,以各向异性为基础,可有效反映缺氧缺血所致脑白质损伤程度[8]。FA 值是DTI 常用描述参数,可评价脑组织水分子扩散状态,其水平越靠近l,代表扩散趋于各向异性,表明纤维束细胞膜、髓鞘及轴索功能完整性越好[9]。本研究通过对比研究可知,与正常新生儿比较,HIE 患儿内囊后肢、内囊前肢、胼胝体压部、胼胝体膝部、半卵圆中心、额叶白质FA 值更低,结合黄莹[10]、黄珍欢等[11]研究推测这可能归因于缺血缺氧影响脑部细胞与组织内线粒体供能,破坏细胞膜离子梯度,造成髓鞘功能障碍,甚至缺损、坏死,进而减少轴突生长数量,引起轴突生长障碍,损坏脑白质纤维束完整性,从而降低水分子各向异性程度,主要表现为FA 值下降。由于豆状核为灰质,轴突髓鞘与脑白质纤维含量较少,扩散呈各向同性,故HIE 患儿豆状核FA 值未发生明显改变。
1H-MRS 可从细胞水平上了解缺血缺氧发生时脑代谢物变化情况,为临床评估脑损伤提供细胞能量代谢、神经元功能等相关信息[12-13]。NAA、Cr、Cho 为1H-MRS 常见代谢产物。本研究数据表明,HIE 患儿基底节区、额叶区NAA/Cr、NAA/Cho较低,与郭莉莉等[14]观点具有相似性,并随病情程度加重、NBNA 评分下降而降低,这主要是由于HIE患儿脑损伤可增加线粒体功能障碍发生风险,释放大量葡萄糖,诱发无氧酵解,促使大量丙酮酸向乳酸转化,进而引起氧化磷酸化不足、细胞酸中毒,造成神经元破坏或丢失,相应减少NAA、Cho 含量。而HIE 患儿基底节区、额叶区Cho/Cr 未发生明显变化可能与检查时间点不一、脑白质急性期损伤不明显等因素有关。然而采用DTI、1H-MRS 技术单一诊断效能均存在一定局限性,故本研究尝试选取DTI 诊断价值最优的参数与1H-MRS 技术诊断价值最优的参数做联合诊断,结果显示,内囊后肢、胼胝体压部、额叶白质FA 值、基底节区NAA/Cr、NAA/Cho联合诊断新生儿HIE AUC 值最大,为0.888,优于各参数单独诊断。提示可见DTI 联合IH-MRS 技术可进一步为临床提供更为可靠的诊断方式。
综上可知,DTI 联合IH-MRS 技术可无创定量反映脑白质结构损伤情况,为新生儿HIE 早期诊断、病情程度评估提供有效影像学信息。但由于选取时间限制,本研究选取病例数较少,今后需扩大样本量对研究结果做进一步论证。

