胃癌患者癌组织中精氨酸酶-1的表达及预后价值*
郑威强, 王向阳
华中科技大学同济医学院附属武汉中心医院胃肠外科,武汉 430014
胃癌(gastric cancer,GC)是全球最常见的消化道肿瘤,也是癌症相关死亡的主要原因之一。早期胃癌无症状或非特异性症状,诊断时常处于晚期而导致患者5年生存率较低。胃癌发病率存在很强的地域性特点,好发于东亚地区且死亡率高,其中男性每10万中24人死亡,女性每10万中9.8人死亡[1]。寻找和鉴定胃癌新的分子标志物对提高治疗水平意义重大[2]。精氨酸酶(Arginase)可将1-精氨酸(l-Arginine)水解成1-鸟氨酸和尿素,而l-精氨酸是机体内细胞生存所需的必需氨基酸。人体内精氨酸酶存在两种同工酶形式,其分别为精氨酸酶-1(Arg-1)和Arg-2。在肿瘤患者血清、肿瘤组织和髓样抑制细胞(myeloid-derived suppressor cells,MDSCs)中均可检测到高水平的精氨酸酶活性[3-4]。Arg-1在肝细胞中特异性表达,可作为肝细胞免疫组化标记物,区分原发性肝细胞癌和转移性肝癌[5]。然而,胃癌患者中Arg-1的表达水平及其预后的临床意义尚不得知,本研究旨在探讨Arg-1在胃癌组织中的表达水平,分析其表达水平与病理特征间的关系,并阐明预后价值。
1 材料和方法
1.1 患者临床标本收集
本研究癌组织来源于武汉市中心医院病理科保存的2012年1月至2014年3月期间胃肠外科收治的胃癌患者石蜡组织标本92例。全部患者均接受胃癌切除术治疗,其中男64例,女28例,年龄31~82岁,中位年龄60岁。纳入标准:①患者接受胃癌切除术并经病理诊断为胃癌;②除胃癌外患者无其他肿瘤;③病历资料详细完整。排除标准:病历资料不完整者。所有病理组织标本经2位病理医师重新确认,并根据世界卫生组织标准重新分类[6]:高分化18例,中分化28例,低分化46例;肠型38例,弥漫型54例。本研究获得武汉市中心医院伦理委员会批准同意。
1.2 患者随访
通过定期门诊和电话方式进行随访,术后每半年随访1次。总生存时间为术后至随访截止或死亡之间的时间间隔。无瘤生存时间为术后至随访期间首次复发或随访截止之间的时间间隔。随访截止时间为2020年1月,中位随访时间42个月,范围为35~60个月,共3例失访。
1.3 免疫组化检测
手术切除后立即收集癌组织,除常规病理切片外,病理组织储存于-80℃冰箱中。癌组织经抗生物素蛋白-生物素-过氧化物酶复合物法处理,甲醛溶液固定,石蜡包埋,并切成4 μm厚组织切片后再行免疫组化(IHC)染色。具体操作步骤如下:将石蜡切片安装在超级玻璃载玻片上,并在二甲苯中进行脱蜡并在梯度乙醇中再水化,然后行抗原修复。使用0.3%过氧化氢封闭内源性过氧化物酶活性15 min。在4℃下与兔Arg-1一抗(1∶300;Abcam,美国)孵育过夜后,将切片与二抗一起于37℃孵育2 h,苏木精用于核复染。将载玻片通过梯度乙醇和二甲苯洗涤脱水,并安装在盖玻片上,未加一抗的切片用于阴性对照染色。
1.4 免疫组化评估和患者分组
染色百分比评分如下:0分=0%细胞染色;1分=1%~10%细胞染色;2分=11%~50%细胞染色;3分=51%~100%细胞染色。染色强度评分如下:0分=阴性染色;1分=弱染色;2分=中度染色;3分=重度染色。免疫评分计算公式:总评分=染色百分比评分×染色强度评分。根据免疫染色评分结果将患者分为两组:染色总评分0~4分定义为Arg-1低表达组;染色总评分6~9分定义为Arg-1高表达组。
1.5 统计学方法
所有统计分析均使用SPSS 19.0统计软件包(SPSS,Chicago,IL)进行,χ2检验或Fisher精确概率法检验用于研究Arg-1表达与病理参数的关系。Kaplan-Meier法绘制生存曲线,采用Log-Rank检验进行比较。Cox比例风险回归模型用于单变量和多变量分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 胃癌患者癌组织Arg-1表达
免疫组化染色显示胃癌组织中Arg-1主要定位于肿瘤细胞的细胞核及胞质中,可观察到阳性染色。92例肿瘤组织中71例(77.2%)Arg-1高表达,21例(22.8%)Arg-1低表达,癌组织中Arg-1染色代表性图像见图1。
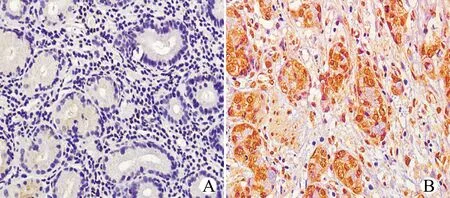
A:Arg-1在胃癌中呈低表达;B:Arg-1在胃癌中呈高表达
2.2 胃癌组织中Arg-1的表达与临床病理参数之间的关系
癌组织中Arg-1表达与患者TNM分期(P<0.05)、局部浸润深度(P<0.05)、Lauren分型(P<0.05)、淋巴结转移(P<0.05)、分化程度(P<0.05)和远处转移(P<0.05)显著相关;而Arg-1表达与患者性别、年龄和肿瘤大小之间无显著相关性(均P>0.05),见表1。

表1 Arg-1表达与胃癌患者临床病理参数之间的关系(n=92)
2.3 胃癌组织中Arg-1表达与无瘤生存率和总生存率之间的关系
Kaplan-Meier法绘制患者生存曲线并评估高、低Arg-1表达患者无瘤生存率和总生存率差异。Arg-1高表达组1年、3年、5年无瘤生存率为73.1%、48.3%及28.0%,Arg-1低表达组1年、3年、5年无瘤生存率为82.4%、61.2%及44.0%,Arg-1高表达组无瘤生存率低于Arg-1低表达组(均P<0.01);Arg-1高表达组1年、3年、5年总生存率为78.3%、55.3%及35.1%,Arg-1低表达组1年、3年、5年总生存率为85.2%、70.2%及46.0%,Arg-1高表达组总生存率低于Arg-1低表达组(均P<0.01),见图2。
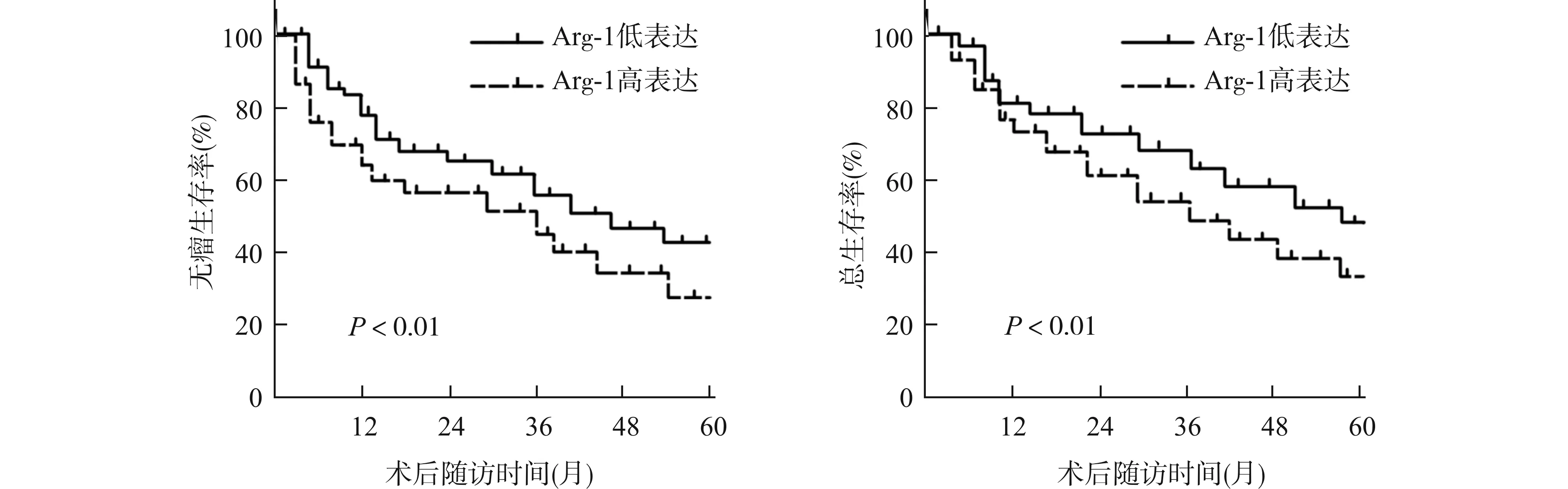
图2 Arg-1高、低表达组患者无瘤生存率和总生存率比较
2.4 影响胃癌患者无瘤生存率的单因素和多因素分析
Cox比例风险模型单因素分析显示:影响胃癌患者无瘤生存率的单因素为TNM Ⅲ~Ⅳ期、局部浸润深度、淋巴结转移、远处转移和Arg-1高表达(均P<0.05),多因素分析显示Arg-1高表达、TNM Ⅲ~Ⅳ期、淋巴结转移和远处转移是影响胃癌患者无瘤生存率的独立危险因素,见表2。
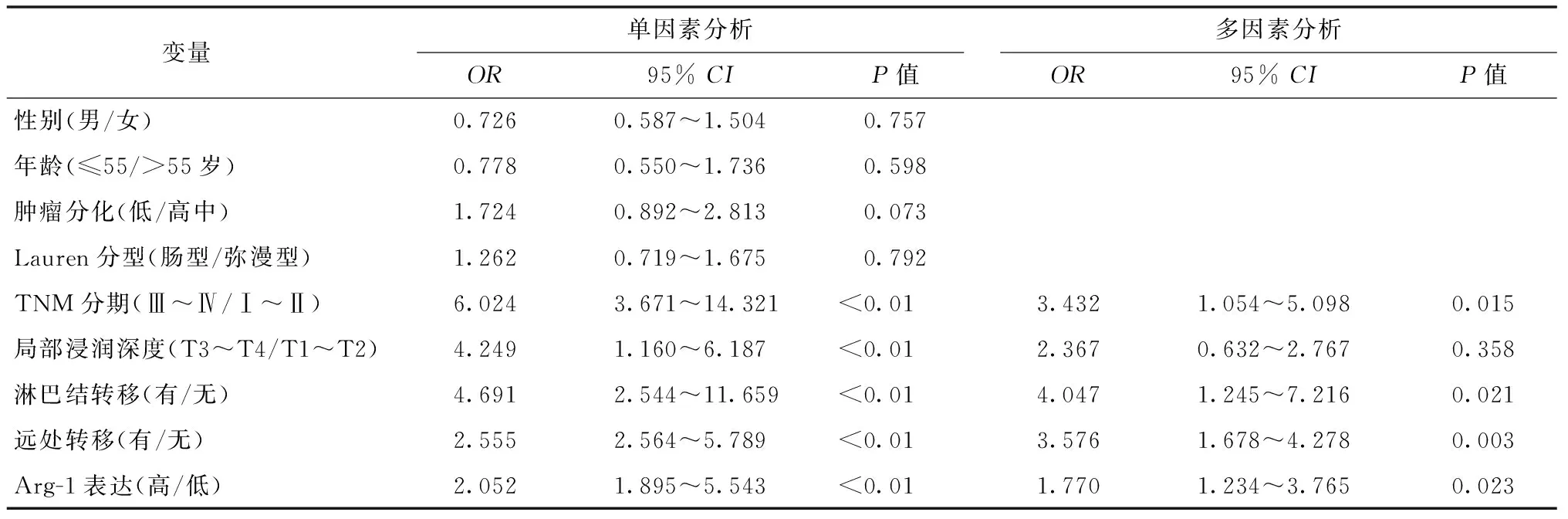
表2 影响胃癌无瘤生存率的单因素和多因素Cox回归分析
2.5 影响胃癌患者总生存率的单因素和多因素分析
Cox比例风险模型单因素分析显示:TNM Ⅲ~Ⅳ期、局部浸润深度、淋巴结转移、远处转移和Arg-1高表达为影响总生存率的单因素(均P<0.05),多因素分析显示Arg-1高表达、TNM Ⅲ~Ⅳ期、淋巴结转移和远处转移是影响胃癌患者总生存率的独立危险因素,见表3。
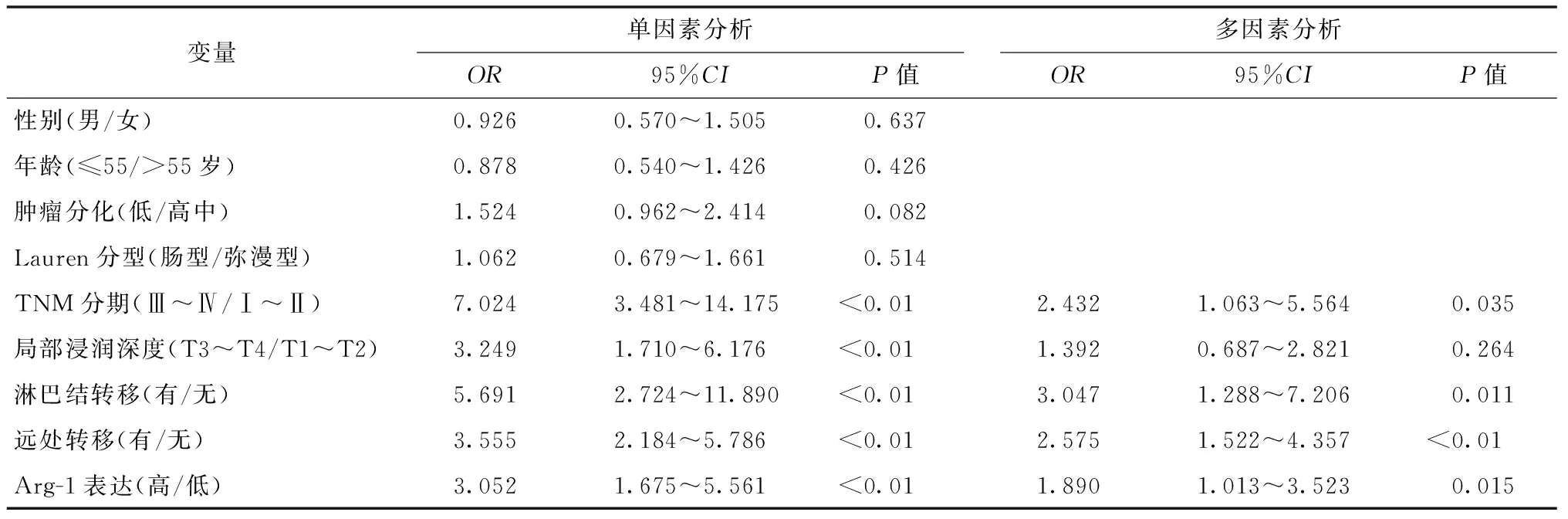
表3 影响胃癌总生存率的单因素和多因素Cox回归分析
3 讨论
胃癌是起源于胃黏膜上皮的恶性肿瘤,其发病率居我国恶性肿瘤首位,虽然随着胃镜检查的普及,胃癌早期诊断率增加,手术联合化疗技术进步,胃癌特别是早期胃癌患者生存率大幅度改善,但晚期胃癌患者病死率仍在25%~30%之间,预后不佳[7-9]。早期诊断,准确分期和持续监测仍是有效治疗胃癌的先决条件,但目前尚无有效预测预后的生物标志物。因此,探索新的标志物以改善胃癌的预后具有重要的临床意义[10]。
本研究通过免疫组化评估胃癌患者癌组织中Arg-1蛋白表达,免疫组化染色结果显示胃癌组织中Arg-1蛋白主要定位于肿瘤细胞内的细胞核及胞质中,呈阳性染色。分析胃癌组织中Arg-1蛋白表达水平与临床病理变量之间的相关性,发现Arg-1与TNM分期、局部浸润、Lauren分型、肿瘤分化、淋巴结转移和远处转移相关,提示Arg-1高表达与肿瘤侵袭和转移密切相关,与肿瘤恶性程度相关。Cox回归分析显示Arg-1高表达是影响胃癌患者预后的独立危险因素,并且其高表达与患者预后差相关。
Arg-1最初被发现在尿素循环中发挥关键作用,参与氨基酸代谢[11],最近研究发现其可能参与细胞免疫和癌症进展[12]。动物实验中发现在与结肠炎相关的结直肠癌小鼠模型中Arg-1基因表达显著增加[13],Arg-1可在肝细胞中特异性表达,同时可作为肝细胞免疫组化标记物用于区分原发性肝癌和身体其他部位肿瘤肝脏转移所致的转移性肿瘤[5]。本研究发现胃癌组织中Arg-1蛋白主要定位于肿瘤细胞的细胞核中,在92例肿瘤组织样品中71例(77.2%)Arg-1高表达,21例(22.8%)Arg-1低表达。有文献报道[14]结直肠癌组织中Arg-1免疫组化高表达比例为48.3%,且通过PCR和Western blot检测发现癌组织中Arg-1显著高于癌旁组织,两者高表达率之间差异可能原因为肿瘤类型的异质性。
文献报道在原发性肝细胞癌组织中Arg-1高表达与肝细胞癌转移和侵袭等恶性程度相关[5],血清中高Arg-1活性与肝细胞癌患者不良预后密切相关[15]。Arg-1参与胃癌进展的机制尚不清楚,综合文献报道其机制可能包括Arg-1的高表达可消耗肿瘤微环境中的L-精氨酸,严重抑制T细胞在肿瘤免疫监视期间的反应。L-精氨酸缺乏导致T细胞受体(T cell receptor,TCR)轻链的表达下调,TCR轻链是TCR的主要信号转导成分,是受体复合物的组装和膜表达所必需的[16]。TCR轻链表达下调导致T细胞对抗原或有丝分裂原反应降低,导致肿瘤特异性T细胞应答能力降低,进一步导致机体对肿瘤清除能力下降而促进肿瘤进展。体外实验研究报道,在不存在L-精氨酸刺激的情况下培养的T细胞在细胞周期处于G0/G1期停滞,这种现象与T细胞不能上调细胞周期蛋白D3和细胞周期蛋白依赖性激酶4表达有关[17]。
本研究发现Arg-1高表达患者无瘤生存率和总生存率显著低于Arg-1低表达患者,结果提示Arg-1高表达可能在肿瘤进展中起重要作用。研究报道由Arg-1产生的l-鸟氨酸进一步代谢成多胺,而后者是细胞分化和增殖的必需成分并促进肿瘤生长[18]。研究报道精氨酸酶高活性的乳腺癌细胞系比相对低活性的乳腺癌细胞系表现出更高的增殖速率,精氨酸酶抑制剂对细胞增殖具有抑制作用,且在高精氨酸酶活性的乳腺癌细胞系中抑制作用尤为明显[18-19]。本研究发现Arg-1高表达与胃癌患者预后不良有关,其可能与肿瘤细胞在高精氨酸酶条件下促进细胞生长和增殖密切相关,其具体机制尚需要进一步研究。
临床医生主要依靠传统的TNM分期系统预测肿瘤患者的预后。鉴定可预测胃癌患者预后的新型生物标志物可能有助于选择术后治疗策略和改善患者的生存[20]。本研究显示在胃癌中,Arg-1高表达是影响无瘤生存率和总生存率的危险因素,提示Arg-1高表达可用于预测胃癌预后。
总之,胃癌患者癌组织中Arg-1表达与患者肿瘤分期和淋巴结转移密切相关,是胃癌患者术后预后不良的新指标。

