基于还原氧化石墨烯@DNA修饰电极的Cu2+传感器
张子强 吴珍玲 周心雨 周培兰 张 娜 张克营
(宿州学院 化学化工学院,安徽 宿州 234000)
引言
铜离子是生命体中必需的微量元素,广泛分布于生物组织中[1]。它在生物体内以复杂化合物形式存在,对于生命活动具有重要的意义[2]。铜离子对大脑、心脏、抗癌、以及造血等也具有重要作用[3]。它还与人们在恐慌和压力下的生理反应密切相关[4]。然而,迅速的工业化使重金属铜在水和土壤中积聚,使生物体摄入过量会造成严重威胁[5]。常用的测定铜离方法有原子吸收光谱法[6]、电感耦合等离子体质谱[7]、电感耦合等离子体发射光谱法等[8]。电化学传感器由于其成本低、选择性好和检出限低等特点已被广泛用于铜离子的检测[9]。
还原氧化石墨烯因其优异的性能和独特的结构,在化学、物理和材料科学等领域近年引起了关注[10]。它由碳原子连接单个原子层构成,是目前发现的最薄的二维材料[11]。还原氧化石墨烯是一种重测的六角晶体,基本结构是每个碳原子的SP2轨道形成3个共价键,与相邻的3个相邻碳原子形成3σ键,剩余的1个P电子垂直于还原性氧化石墨烯的表面,并与周围原子形成π键[12]。它具有优异性能,是目前最强大的材料[13]。由于独特的载流特性、大的表面积及优异的电学性质,已成为化学修饰电极研究热点[14]。
随着对电化学生物传感器[15]研究,生物传感器领域研究者对生物传感器选择性和灵敏度的研究和检测方法的优化具有很大的兴趣[16]。DNA是很多生物体遗传信息的载体[17]。以DNA或DNA辅材为敏感元件,电流为特征检测信号的生物传感器[18],具有不破坏样品、灵敏度高、便捷快速等优点[19]。在环境检测中受到了广泛的关注[20]。
本文以还原氧化石墨烯和DNA为材料,制备了基于氧化还原石墨烯和DNA复合材料的电化学传感器。拓展了一种检测Cu2+的新方法,在环境检测中具有潜在的应用价值。
1 实验部分
1.1 主要仪器与试剂
CHI660A电化学工作站(上海辰华仪器有限公司),KQ5200DB型超声波清洗器(昆山市超声仪器有限公司),FA2004N电子天平(常州市宏衡电子仪器厂),电化学体系采用三电极系统,KQ5200DB型超声波清洗器,电化学实验三电极系统。
硫酸铜溶液、还原氧化石墨烯、KCl均为分析纯,二次蒸馏水。DNA(上海生物工程有限公司),序列为TTTTTTTTTTTTTTT。
1.2 DNA和氧化还原石墨烯混合溶液的配制
将DNA溶液和还原氧化石墨烯溶液按不同的比例(质量浓度比例分别为0.67/10、1/5、2/5、3/5、4/5、1/1)混合,分别放在不同的小离心管中,将离心管放入离心机中离心,两种物质即可混合均匀,就可以得到不同比例的还原氧化石墨烯@DNA复合材料。
1.3 石墨烯@DNA修饰电极的制备
把金电极放在润湿的Al2O3上打磨如镜面,打磨后用蒸馏水洗净,然后在无水乙醇溶液中超声清洗1 min左右,再用蒸馏水清洗其表面,将电极晾干。吸取5 μL配制好的DNA和还原氧化石墨烯混合溶液滴涂于预处理过的金电极表面,自然风干,即可得到还原氧化石墨烯@DNA修饰电极。
2 结果与讨论
2.1 优化DNA和还原氧化石墨烯的比例
不同配比的还原氧化石墨烯@DNA修饰电极对0.05 mol/L的Cu2+溶液的循环伏安图(图1)。从a到f依次分别为基于不同比例的DNA和还原氧化石墨烯(质量浓度比例分别为0.67/10、1/5、2/5、3/5、4/5、1/1)。从图2可知比例为4/5的还原氧化石墨烯@DNA修饰电极的峰电流值明显强于其他比例的还原氧化石墨烯@DNA电极的峰电流值。所以,比例为4/5的还原氧化石墨烯@DNA修饰电极性能最佳。
2.2 电化学阻抗谱表征电极的组装
a、b分别为裸电极与修饰电极的电化学阻抗谱(EIS),如图3所示。电化学阻抗谱(EIS)在0.1 mol/L PBS(pH 7.4,0.1 mol/L NaCl)中,5 mmol/L [Fe(CN)6]3-/4-的情况下进行,其频率范围为0.01~105 Hz,其形式电位为0.2 V。交流电压振幅为5 mV。将还原氧化石墨烯@DNA修饰到电极表面后,Ret进一步减小,表明还原氧化石墨烯@DNA已被成功修饰到电极表面。
2.3 Cu2+在不同修饰电极上的电化学行为
测定不同修饰电极的循环伏安图如图4所示。a~d分别表示的是裸金电极、DNA修饰电极、还原氧化石墨烯修饰电极、DNA@还原氧化石墨烯修饰电极。图4(a)所示Cu2+在裸金电极上的响应很小,而从图4(b)、4(c)上可以看出分别用DNA和还原氧化石墨烯修饰过的金电极上有一组较为明显的氧化还原峰,由图4(d)则可知在还原氧化石墨烯@DNA修饰电极上,Cu2+的氧化还原峰效果更好。因此,DNA和还原氧化石墨烯修饰电极均对Cu2+有较强的催化效果,而当两者结合起来时,DNA和还原氧化石墨烯修饰电极对Cu2+的氧化峰峰电流最大,表明该修饰电极对Cu2+催化氧化还原能力最强。

a—0.67/10修饰的电极;b—1/5修饰的电极;c—2/5修饰的电极;d—3/5修饰的电极;e—4/5修饰的电极;f—1/1修饰的电极图1 不同DNA和还原氧化石墨烯比例修饰电极的CV图Figure 1 CV diagram of different DNA and RGO proportional modified electrodes.

图2 DNA和还原氧化石墨烯的比例与峰电流关系图Figure 2 Ratio of DNA and RGO to peak current.

图3 裸电极(a)与还原氧化石墨烯@DNA修饰电极(b)阻抗图Figure 3 Impedance diagram of bare electrode (a) and RGO @DNA-modified electrode (b).
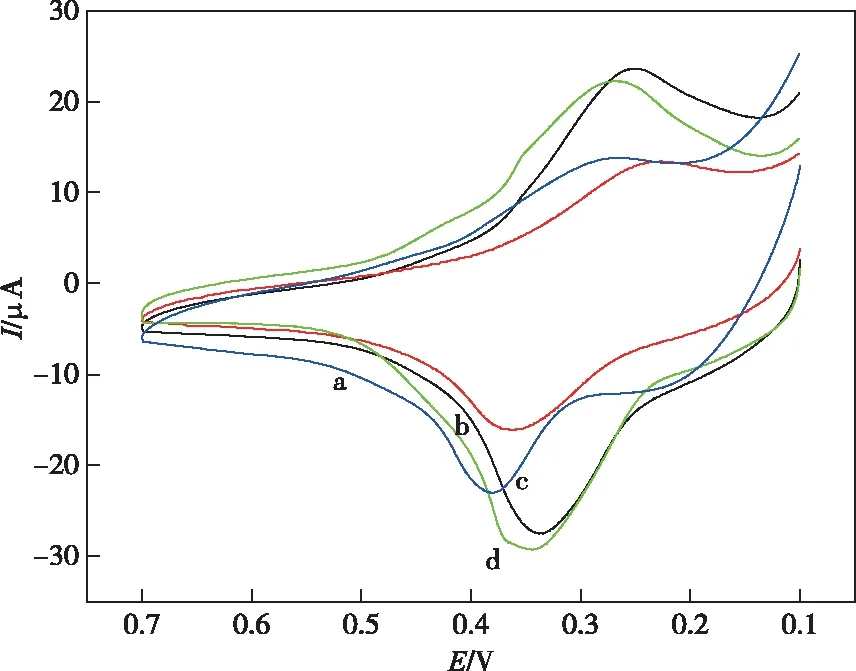
a—裸电极;b—DNA;c—还原氧化石墨烯;d—还原氧化石墨烯@DNA修饰电极图4 Cu2+在不同电极上的CV图Figure 4 CV diagram of Cu2+ at different electrodes.
2.4 不同扫描速度的影响
还原氧化石墨烯@DNA修饰电极在不同扫速下的循环伏安图如图5所示。从a~j扫描速率依次为10、20、30、40、50、60、70、80、90、100 mV/s。从图5可知,在扫描速率增加的同时,氧化峰电流值也逐渐在增大,同时氧化峰电位也略微的向正方向移动。图6为氧化峰电流值与扫描速率之间的关系图,由图6可知,当扫速从10 mV/s逐渐增至100 mV/s时,两者具有良好的线性关系,线性方程为i(μA)=1.345+0.057 7v(mV/s),相关性系数为0.969 1。

图5 相同浓度Cu2+(0.05 mol/L)不同扫速的循环伏安曲线Figure 5 Cyclic voltammetric curves of Cu2+(0.05 mol/L)with the same concentration and different sweeping speeds.
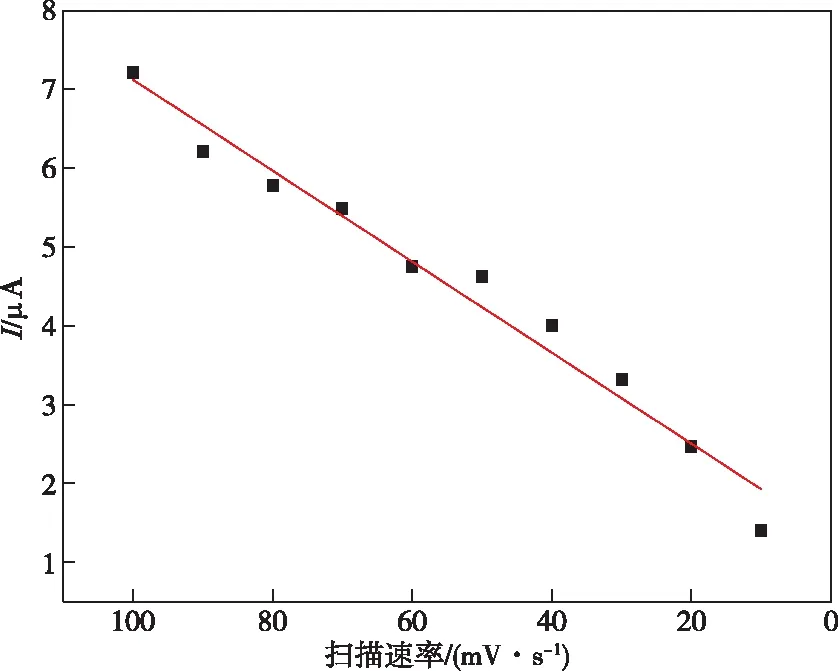
图6 Cu2+氧化峰电流与扫描速率的关系Figure 6 Relation between peak oxidation current of Cu2+ and scanning rate.
2.5 标准曲线
为探究还原氧化石墨烯@DNA修饰电极的性能,DNA和还原氧化石墨烯的修饰电极测定不同Cu2+浓度溶液的差分脉冲伏安图(DPV)如图7所示。加入6 mL KCl溶液(0.01 mol/L),再依次加入Cu2+溶液进行测定。a~g显示的是Cu2+溶液分别为6×10-7、1×10-6、1×10-5、2×10-5、3×10-5、4×10-5、6×10-5、8×10-5mol/L。由图8可知,随着Cu2+溶液浓度的增大,氧化峰电流逐渐增大。Cu2+浓度由6×10-7mol/L到8×10-5mol/L的范围内,即时电流响应信号同Cu2+的浓度分别成线性关系,如图8所示,线性方程为i(μA)=-2.098 8-0.538 5c(×10-5mol/L),线性相关系数R=0.996,最低检出限为1×10-8mol/L。将本方法与文献报道方法[21-23]相比较(见表1),结果显示,本方法具有较宽的线性范围和较低的检出限,说明该修饰电极在Cu2+的实际分析工作中具有潜在的应用价值。

图7 不同Cu2+浓度在修饰电极上的DPV曲线Figure 7 DPV curve of different Cu2+ concentrations on modified electrode.
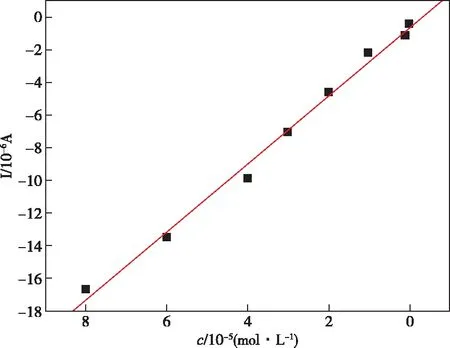
图8 Cu2+浓度与峰电流的关系Figure 8 Relationship between Cu2+ concentration and peak current.

表1 不同修饰电极测定Cu2+的比较
3 结论
本实验采用电化学分析的方法,制备了还原氧化石墨烯@DNA修饰电极,并结合循环伏安法(CV)与差分脉冲伏安法(DPV)将其用于Cu2+的检测,实验结果表明,还原氧化石墨烯@DNA修饰电极对Cu2+的氧化还原有显著的促进作用。在处理难降解有机物废水、重金属废水及生物传感器等方面都存在巨大研究潜力。

