中老年脑栓塞型脑梗死导致的AQP-4及TNF-α/IL-10失衡对患者神经元的损伤及脑梗死体积的影响
陈 昭, 魏志强
中老年脑梗死在临床中有较高的致死率、致残率和复发率,对患者的生命安全造成严重影响[1]。脑梗死是由于血管内膜损伤、脑动脉粥样硬化加之其他多种因素共同作用造成的脑血管堵塞,患者出现严重的脑血管血循环障碍导致缺血缺氧最终脑梗死,严重损伤脑神经及功能[2]。
脑栓塞型脑梗死患者因脑血管缺血严重,神经元细胞异常凋亡增多,导致脑缺血组织异常分泌神经元凋亡相关炎症因子。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)作为多肽类细胞因子,可诱导炎症细胞在急性期进入缺血损伤的脑组织,在缺血性脑损伤中起重要作用[3]。白介素-10(Interleukin 10,IL-10)是一种重要的抗炎细胞因子, 可通过缓解小胶质细胞活化, 减少炎症因子的释放,改善脑损伤[4]。
水通道蛋白-4(aquaporin-4,AQP-4)在毛细血管附近的室管膜以及星形胶质细胞的足突中表达较多[2],和神经系统相关疾病导致的脑水肿发生、发展关系密切,其水平下降有利于损伤的神经修复。然而AQP-4在脑损伤的研究大部分集中在动物实验中,且TNF-α/IL-10作为重要的炎症调控因子,国内鲜有研究两种细胞因子在中老年脑栓塞型脑梗死神经元损伤的作用。
本研究旨在探究中老年脑栓塞型脑梗死导致的TNF-α/IL-10失衡对患者神经元的损伤及疼痛的影响。
1 资料与方法
1.1 一般资料 选取在我院2018年4月-2020年8月进行治疗的中老年脑栓塞型脑梗死的患者及中老年脑栓塞非脑梗死患者作为研究对象,总共83例。研究组中老年脑栓塞型脑梗死的患者42例,对照组患者为中老年脑栓塞非脑梗死患者41例。研究组患者男21例,女20例;平均年龄(65.2±5.4)岁,平均病程(1.6±0.4)y;对照组男18例,女23例;年龄平均(67.86±5.09)岁。两组研究对象年龄、性别、平均病程等资料对比无统计学差异(P>0.05)。患者纳入标准:(1)患者符合《中国急性缺血性脑卒中诊治指南(2014)》中脑栓塞型脑梗死的相关诊断标准;(2)经过影像学CT检测确诊;(3)发病6~72 h;(4)无全身严重并发症;(5)签署知情同意书患者。排除标准:(1)肝肾功能不全者或凝血功能不全者;(2)合并脑内肿瘤患者;(3)重度昏迷患者。全部患者在本次试验之前均详细向其描述了研究的目的、方法和需要注意的事项,患者均知情同意,并经我院医学伦理委员会批准。
1.2 方法 患者在入院后3 d内静脉取血3.5 ml,4 ℃,3500 rpm离心15 min,分离上清,置于-80 ℃冰箱保存。采用酶联免疫吸附法测定全部患者血清中的AQP-4、TNF-α和IL-10含量,操作步骤均严格参照试剂盒说明书进行。TNF-α和AQP-4ELISA试剂盒购自上海远慕生物科技有限公司;IL-10ELISA试剂盒购自上海钰博生物科技有限公司。Multiskan MK3酶标仪购自美国赛默飞世尔科技有限公司。
1.3 神经功能损伤评估 采用美国国立卫生研究院卒中量表[5]评估患者的神经功能缺损情况,该量表的内容共11项,有视觉功能、意识、感觉等条目,满分42分。评分不足4分的为损伤较轻,评分在4~15分之间的损伤尚可,评分超过15分则为损伤严重。
1.4 疼痛程度评分 利用疼痛视觉模拟评分法[6]对患者的患肢疼痛情况进行评估。(1)0分说明患者未出现任何疼痛情况;(2)10分说明患者出现即为严重的疼痛情况;(3)1~9分说明患者出现不同程度的疼痛情况。分数和疼痛情况成正比。
1.5 脑梗死体积计算 两组患者均在发病的3 d~1 w内利用CT检查头部情况,根据影像学的结果让相同的神经科医师对患者梗死体积进行计算,然后根据其体积的大小分为不同组别,体积不足4 cm3为小梗死灶组;体积在4~10 cm3则为中梗死灶组;体积超过11 cm3则为大梗死灶组。

2 结 果
2.1 研究组和对照组血清AQP-4、TNF-α和IL-10水平 研究组患者血清TNF-α和IL-10水平明显高于对照组患者,且TNF-α/IL-10比值高于对照组患者的,差异明显(P<0.05)(见表1)。
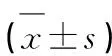
表1 研究组和对照组血清TNF-α和IL-10水平及比值比较
2.2 研究组患者和对照组患者神经功能评价 研究组患者发生神经损伤的总例数明显高于对照组患者,差异明显(P<0.05)(见表2)。

表2 研究组患者和对照组患者神经功能评分对比[n/%]
2.3 研究组患者和对照组患者疼痛程度评分 研究组患者发生疼痛的病例明显多于对照组患者,差异明显(P<0.05)(见表3)。

表3 研究组患者和对照组患者疼痛程度评分对比
2.4 研究组患者和对照组患者脑梗死体积 研究组患者发生脑梗死体积明显多于对照组患者,差异明显(P<0.05)(见表4)。

表4 研究组患者和对照组患者脑梗死体积比较[n/%]
3 讨 论
随着国家人口老龄化增多,中老年脑梗死的发生率不断增长,逐渐成为中老年疾病中常见的神经科疾病,饮食、高脂血症、肥胖、高血压等均是造成该病发生的重要原因,发病后损伤神经系统不仅影响患者正常的生活和工作,该病病死率极高且预后较差,甚至严重损害患者的生存质量[7]。脑栓塞型脑梗死主要由于患者脑部主干动脉因颅内外血管、发生粥样硬化,而导致动脉硬化形成,血流减慢导致脂质沉积加重动脉硬化并形成脑动脉斑块,最终脑部供血供氧不足,引起脑部组织损伤和神经细胞大量凋亡,对患者生命产生威胁[8,9]。因此对于中老年脑栓塞型脑梗死患者,及时采取检测措施和防护措施才能控制病情发展,挽回患者个体生命,减少因脑部缺血缺氧导致的脑损伤后的不良预后发生,提高患者的生存率及生存质量[10,11]。
随着脑栓塞研究深入,临床研究者发现患者在发病后,血清中的与神经细胞功能和损伤发生密切相关的细胞因子活性和含量发生明显改变。TNF-α是位于脑组织内的巨噬细胞、神经胶质细胞以及位于血管中的内皮细胞分泌产生的和炎症关系密切的细胞因子。相关研究发现[12,13],TNF-α能够加速缺血性脑损伤的发生、发展,其不仅能够直接影响达血管内皮细胞,让其通透性发生变化,而且还可以让趋化损伤细胞,让嗜酸性粒细胞和嗜碱性粒细胞在缺氧缺血而损伤的脑部病灶区大量聚集,并激活分泌数量众多的溶酶体酶、炎症因子,进而造成血管内皮细胞出现损伤,形成血栓,加重了脑梗死的情况。因此,TNF-α在血清中浓度高低可反映神经细胞非正常凋亡的程度。IL-10具有神经保护作用,可以在脑缺血缺氧的过程中,能够对抗T细胞活化分泌对的各种细胞因子,从而抑制细胞免疫应答,阻断炎症的级联反应发生[14,15]。AQP家族作为最几年临床发现的一类具有水特异性的膜内蛋白,主要包括7种类型,其中AQP4大多存在于脑组织,尤其高表达于蛛网膜下腔、血管附近的星形胶质细胞表面及其终足包绕的毛细血管壁膜上,呈现出极性分布的特点。
本研究中老年脑栓塞型脑梗死的患者发病后血清中TNF-α含量明显高于中老年脑栓塞非脑梗死患者。脑部动脉血管动脉狭窄导致脑梗死后,脑神经纤维细胞和胶质细胞及血管内皮细胞大量凋亡引起TNF-α和AQP4异常分泌,因此中老年脑栓塞型脑梗死患者血清中TNF-α和AQP42异常升高。而脑梗死后未损伤的脑组织分泌IL-10,对抗活化的T细胞产生细胞因子,减少炎症对脑功能的损害。研究组TNF-α/IL-10的比值明显高于对照组比值,研究组患者发生脑梗死后出现严重的炎症反应并伴有TNF-α升高,远高于IL-10的分泌,而炎症因子的异常分泌将引起炎症反应并伴有疼痛和发热,因此研究组患者发生疼痛的病例较高。
综上所述,中老年脑栓塞型脑梗死患者由于脑神经纤维细胞和胶质细胞及血管内皮细胞大量凋亡引起TNF-α异常分泌,引起TNF-α/IL-10的比值失衡和患者炎症反应和疼痛,因此TNF-α/IL-10的比值失衡会在中老年脑栓塞型脑梗死患者血清中发生动态变化,可用于评估患者的病情程度,具有临床价值。

