基于姑息性表现量表的肿瘤晚期病人3个月生存预测模型的初步构建
张 伟,费朝廷,朱冬梅,陈 星
1.江苏大学医学院,江苏 212013;2.江苏大学附属医院
近年来我国癌症发病率和死亡率不断上升,给国人带来了严重的疾病负担[1]。恶性肿瘤晚期病人在生命末期知晓较为准确的生存时间对他们决定护理目标、治疗方案以及处理个人和家庭事务等具有重要意义[2]。同时,准确的生存期预测也有利于护理人员更精准地评估和掌握病人病情,以制定最优照护方案,提高晚期癌症病人生存质量。目前,临床医生对晚期病人生存期预测较为主观和乐观[3]。欧洲缓和医疗协会(European Association for Palliative Care, EAPC) 于2005 年提出肿瘤晚期病人生存期预测影响因素主要与病人临床症状和体征、生化结果、体能状态等有关[4]。近年来,已有研究者通过科学研究筛选出肿瘤病人预后独立影响因素,且已建立用于判断肿瘤晚期病人生存期的统计学预测方法,其中包括姑息性表现量表(PPS)[5]。PPS 是根据Karnofsky 量表(KPS)的功能维度(包括行走、活动水平和疾病证据)改编而成,增加了自我护理、口服摄入量和清醒程度3 方面内容。作为一个成熟的预测工具,该量表在国外已被广泛应用于癌症病人的生存预测,大部分姑息单位[6-7]及社区临终服务机构[8-9]将其作为病情记录的内容之一。我国对肿瘤晚期病人生存期预测的研究尚无统一成果[10],仅有一篇报告了PPS 与胃癌之间的相关性[11],但其并未说明PPS 的应用方法。目前,尚未检索获得探讨PPS 与肿瘤晚期病人生存期关系的相关研究。本研究前期对PPS 进行了文化调试、汉化,在得到较好信效度的基础上,以期继续探讨PPS 预测肿瘤晚期病人生存时间的效果,并筛选出影响肿瘤晚期病人生存期的独立危险因素,构建预测模型,以期为临床决策提供参考。
1 对象与方法
1.1 研究对象 选取2018 年1 月—2019 年9 月入住江苏大学附属医院肿瘤科安宁疗护病房的200 例肿瘤晚期病人为研究对象。纳入标准:经细胞学或病理学明确诊断为恶性肿瘤晚期;无法耐受手术、放疗和化疗等抗肿瘤治疗;入院接受最佳支持治疗;临床资料完整;年龄≥18 岁。排除标准:存在药物引起的症状(如丙泊酚等镇静药物引起的谵妄等)。200 例病人中,男118 例(59.0%),女82 例(41.0%);年龄28~94 岁,平均年龄64 岁;胃癌病人28 例(14.0%),肺癌病人55 例(27.5%),肠癌病人27 例(13.5%),妇科肿瘤病人19例(9.5%),乳腺癌病人6 例(3.0%),其他癌症(肝癌、肾癌、头颈癌、食管癌、膀胱癌、胰腺癌、胆囊癌等)病人65 例(32.5%);有手术史75 例(37.5%),无手术史125例(62.5%);有共病(基础性疾病)174 例(87.0%),无共病26 例(13.0%)。
1.2 资料收集方法 通过病人入院首次病历记录收集病人年龄、性别、诊断、手术史等一般资料。评估病人PPS 得分,评分为0%~100%,以10%递增,0%代表病人已经死亡,100%代表行动健康[2]。分值越高,代表该病人体能状态越好。记录病人入院后24 h 临床症状及体征,包括心动过速、呼吸困难、吞咽困难、睡眠障碍、排痰困难、大小便失禁、水肿、谵妄、上消化道出血。跟踪随访病人3 个月(国内定义临终关怀界定时间为3~6 个月[12]),记录其结局。
1.3 统计学方法 应用Excel、SPSS 22.0 统计软件进行数据处理。非正态分布资料采用中位数(四分位数)[M(P25,P75)]表示,绘制Kaplan-Meier 生存曲线;运用Log-rank 检验各变量组间累计生存率差异,将有显著意义的变量(P<0.1)纳入Cox 比例风险回归模型进行多因素生存分析,筛选对生存期有影响的独立危险因素,统计结果均以P<0.05 为差异有统计学意义,建立预后指数(PI)方程。
2 结果
2.1 肿瘤晚期病人生存状况 200 例肿瘤晚期病人生存时间为30(27,33)d。2 例病人在入院1 d 内死亡,病人1 周生存率为94.5%,4 周生存率为52.5%,8 周生存率为17.0%。随访期间(3 个月)193 例病人死亡,7例病人存活。
2.2 病人PPS 评分分层Kaplan-Meier 生存曲线 病人PPS 评分分层Kaplan-Meier 生存曲线初始分为7组,见图1。Log-rank 分析显示,PPS 是影响肿瘤病人生存期的影响因素(P<0.001),不同PPS 类别显示出了很强的排序效果,但PPS 值为50%和60%时累计生存率差异无统计学意义(χ2=0.018,P=0.892)。
2.3 肿瘤晚期病人生存期影响因素的单因素分析PPS 生存曲线初始分为7 组,经文献研究[6]后最终分为2 组(PPS≤50%和PPS>50%)。肿瘤晚期病人生存期影响因素的单因素分析结果见表1。
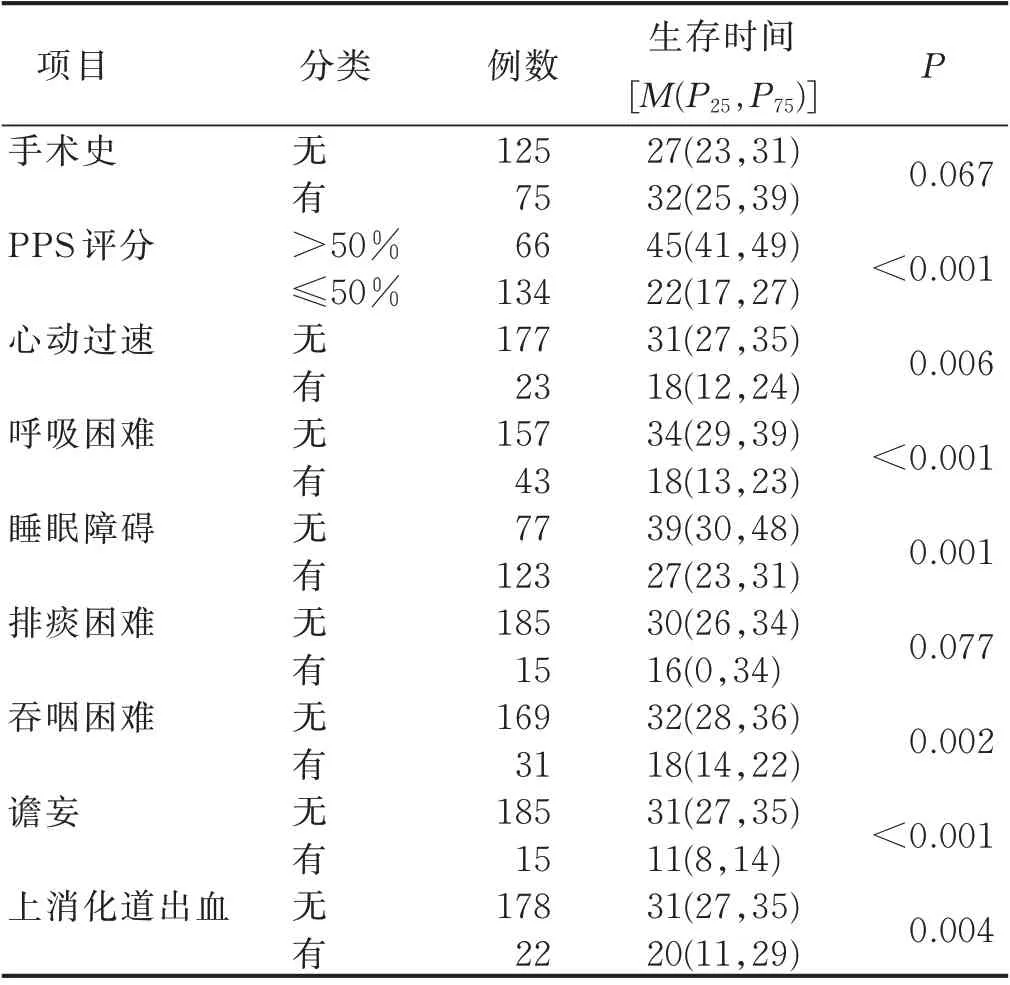
表1 肿瘤晚期病人生存期影响因素的单因素分析(n=200) 单位:d
2.4 肿瘤晚期病人生存期危险因素的多元逐步Cox模型分析 为了不遗漏重要变量,将单因素分析中P<0.1 的变量纳入Cox 比例风险模型进行多因素分析,自变量赋值情况为手术史(无=1,有=2),PPS(>50%=1,≤50%=2),呼吸困难(无=1,有=2),吞咽困难(无=1,有=2),谵妄(无=1,有=2)。最后进入主效应方程的因素为手术史、PPS 评分、呼吸困难、吞咽困难、谵妄。见表2。
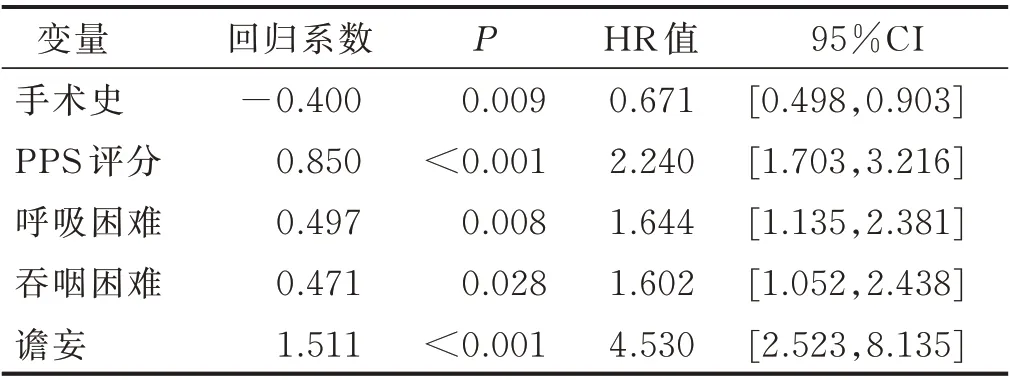
表2 肿瘤晚期病人生存期危险因素的多元逐步Cox 模型分析结果
2.5 建立预测模型及其PI 根据Cox 多因素分析筛选出的5 项指标建立Cox 生存预测方程得到:h(t,X)=h0(t)exp(-0.400X1+0.850X2+0.497X3+0.471X4+1.511X5),因此,预后指数(PI)方程:PI=-0.400X1+0.850X2+0.497X3+0.471X4+1.511X5,χ2=99.081(P<0.001),其中,X1为有手术史,X2为PPS≤50%,X3为呼吸困难,X4为吞咽困难,X5为谵妄。PI 指数越大,病人风险越大,预后越差。进一步计算每个个体PI 值,所有病人PI 值总体分布情况不服从正态分布,采用百分位数P43、P73为分界点(各组例数较均衡),将200 例肿瘤晚期病人分为3 组,PI 值为-0.400~<0.471 设为低危组,PI 值为0.471~0.850 设为中危组,PI 值为>0.850~3.329 设为高危组。计算并比较3 组肿瘤晚期病人的3 个月生存率,结果显示,随着PI 值升高,病人3 个月生存率呈下降趋势(χ2=72.718,P<0.001)。见表3,证明模型合理有效。绘制生存曲线图(见图2),Log-rank 检验进行各组间两两比较差异均有统计学意义(P<0.016 7)。

表3 3 组肿瘤晚期病人的生存情况 单位:例(%)
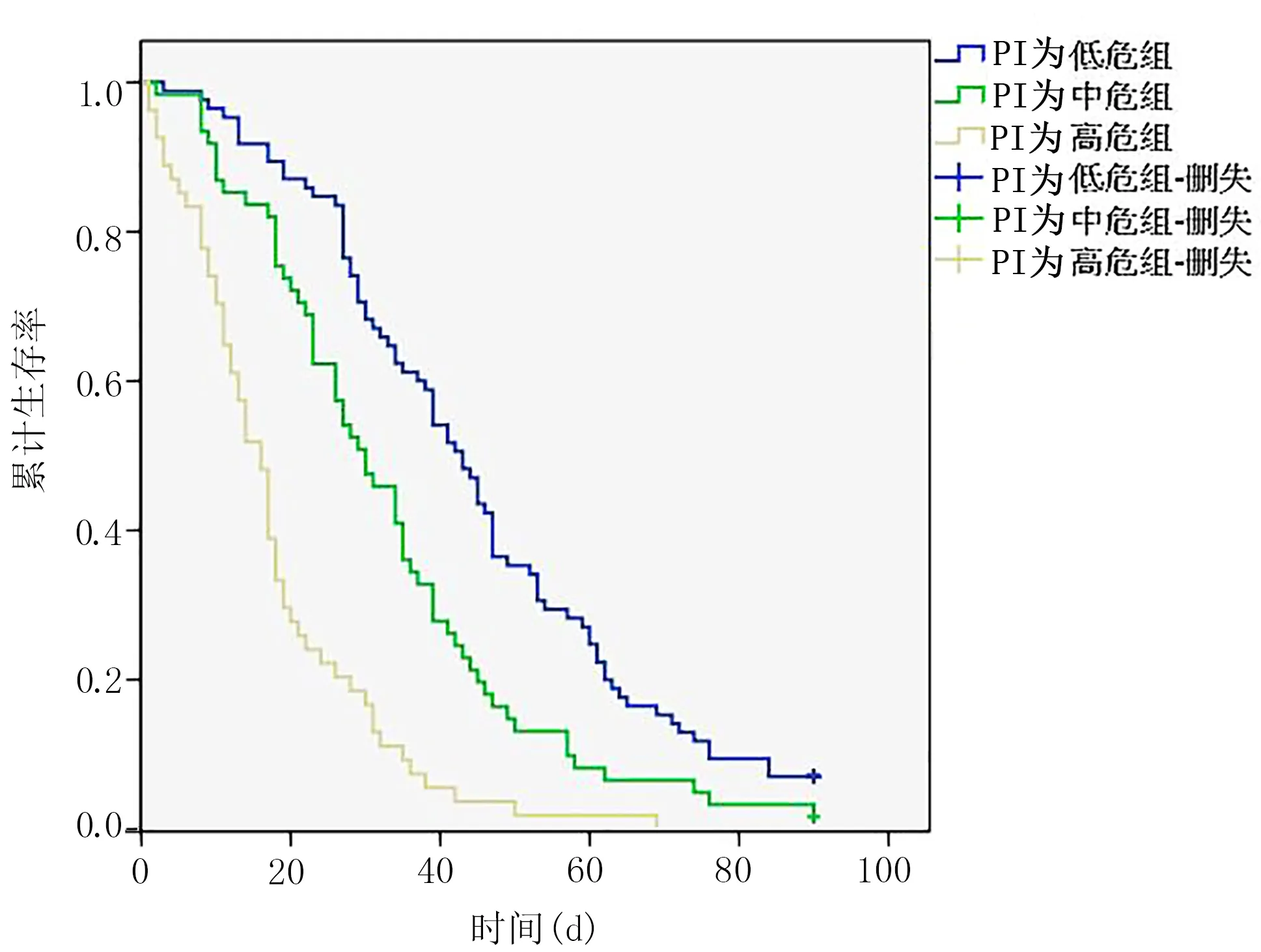
图2 3 组肿瘤晚期病人生存曲线(注:删失为在研究截止日期依然存活的病人)
3 讨论
PPS 是一个能有效反映病人功能状态的量表,该量表使用简单,护士或医生可以在病人患病的任何时期利用其进行评估[13],且相关研究表明,该表反映了活动能力、活动和疾病临床表现、自我照顾、摄入及意识水平这5 个领域的最佳组合,被认为是一个相当有效和可靠的预测工具[9]。Baik 等[6]对4 项独立研究中包含1 808 例病人的生存模式进行Meta 分析,证实PPS 是姑息治疗病人生存的有力预测因子。本研究发现,PPS 评分是我国肿瘤晚期病人生存期有效的预测因子,PPS 评分较高,病人预期存活时间较长,不同的PPS 类别显示了很强的排序效果,与Simmons 等[14]的研究的结果一致。本研究中PPS≤50%的病人死亡风 险 是PPS>50% 病 人 的2.240 倍,但PPS 分 值 为50% 和60% 间累计生存率差异无统计学意义(P>0.05)。PPS 中等分数没有显著的鉴别力,可能与回顾性研究的研究类型有关[13],提示PPS 在运用过程中“面对面”评估的重要性。
本研究发现,有手术史是肿瘤晚期病人生存的保护因素,可能与术后肿瘤负荷减轻、播散概率降低有关[15]。谢锐杰等[16]回顾性分析了1 620 例胰腺癌病人的病例资料,发现早期诊断胰腺癌并进行根治性手术治疗是延长病人生存期的重要举措。刘鹏等[17]研究结果也显示,手术会对病人的远期生存产生重要影响。
吞咽困难、呼吸困难等症状是生存期预测指标,被称为“临终综合征”[18]。呼吸困难是晚期癌症病人常见症状之一,频繁发作且难以控制的呼吸困难与晚期癌症病人的生存预后不良具有相关性[5]。本研究显示,呼吸困难、吞咽困难均是肿瘤晚期病人生存期的独立危险因素。21.5%(43 例)的病人出现呼吸困难症状,15.5%(31 例)的病人出现吞咽困难症状,且这些病人的生存期均比没有症状的病人短。
谵妄被认为是晚期癌症病人常见的意识下降表现[19]。谵妄是临床多因素作用的结果,包括药物、电解质紊乱、内分泌紊乱、低氧血症、感染、副肿瘤综合征、颅内转移及脱水等[5],常预示着较短的生存期[20],是晚期肿瘤病人短期生存期的独立危险因素[21]。Scarpi等[22]通过谵妄-姑息预后评分(Delirium-Palliative Prognostic Score,D-PaP)将病人分为3 组,分数越高表明30 d 生存率越低。但应注意,评估谵妄时需谨慎,需排除药物引起的可逆性谵妄[10]。
本研究初步构建了基于PPS 的晚期肿瘤病人3 个月生存预测模型,其存在一定局限性,如研究采取回顾性方法,PPS 评分是根据病人入院时病程记录获得,不能体现病人PPS 的实时变化;样本量偏小,研究结果还需更大样本的前瞻性研究予以验证。

