GRP78和bFGF在喉鳞癌组织中的表达及与微血管生成的关系
周永彬,高 珊,徐 勤,范凤霞,叶 忻
(自贡市第四人民医院,四川 自贡 646000)
喉癌作为耳鼻咽喉头颈外科最常见的恶性肿瘤,主要病理类型为鳞状细胞癌,我国北方地区高发。晚期癌细胞扩散转移成为影响其预后的主要原因,目前尚无确切治疗方法[1]。葡萄糖调节蛋白(GRP78)是内质网上的一种应激蛋白,与细胞防御系统有关,其主要功能有阻止内质网新生肽的聚集,参与未折叠蛋白反应(UPR)调控,阻止细胞凋亡,参与调节内质网钙稳态等[2]。同时,GRP78在癌细胞中缺氧状态下的适应和生存中起着重要作用,并有提高癌细胞对抗癌药物的耐药性的作用,研究GRP78抑制剂可以作为一种新的抗癌策略[3]。碱性成纤维细胞生长因子(bFGF)是人体内的常见多肽因子,在自身组织损伤修复、机体新生血管形成,甚至在肿瘤生长、扩散转移等过程中均起着关键作用。微血管密度(MVD)与bFGF关系密切,能够反映恶性肿瘤侵犯、转移程度等生物学行为,研究多采用D2-40标记并计数MVD。本实验采用免疫组织化学方法检测GRP78和bFGF在喉癌组织中表达情况,探讨GRP78、bFGF、MVD与喉癌各项临床病理学因素的关系及各指标之间的相关性,旨在为GRP78、bFGF是否能作为预判喉癌恶性程度及预后的敏感分子标志物,以及喉癌基因靶向治疗研究提供一定参考和思路。
1 资料与方法
1.1一般资料 收集2015年1月—2019年6月于自贡市第四人民医院耳鼻咽喉头颈外科收治住院手术的60例喉癌患者术后标本,均经术前活检病理证实为喉鳞癌,且均未接受放化疗治疗。60例喉鳞癌患者中,男52例,女8例;年龄45~74岁,中位年龄62岁,<60岁22例,≥60岁38例;发病前吸烟史20年以上(每日>20支)者48例;肿瘤直径≥3 cm者37例,<3 cm者23例;经术后病理证实有淋巴结转移者38例;高分化(G1级)19例,中低分化(G2~G3级)41例;依据UICC的TNM分期标准(2010):Ⅰ+Ⅱ期21例,Ⅲ+Ⅳ期39例。取60例患者喉癌组织和其中32例患者癌旁正常组织,均为术后1 h内获得,将组织立即放入10%福尔马林溶液中浸泡固定24 h,制备石蜡包埋标本。
1.2试剂和仪器耗材 兔抗人GRP78、bFGF多克隆抗体购于北京中杉金桥公司,鼠抗人D2-40单克隆抗体购于福州迈新生物技术开发有限公司。
1.3研究方法 采用SP法检测喉鳞癌组织和癌旁组织中GRP78和bFGF表达情况:均连续切取厚度5 μm石蜡切片3张,分别进行GRP78、bFGF和D2-40染色,二甲苯以及梯度酒精常规步骤脱蜡,枸橼酸抗原修复液高压修复及PBS反复冲洗3次,共约15 min进行抗原修复,3%过氧化氢室温孵育10 min以阻断内源性过氧化物酶,室温放置40 min,PBS冲洗,山羊血清工作液(A液)封闭15 min,去血清,滴加一抗50 μL 4 ℃冰箱过夜,次日取出后PBS冲洗,加二抗,室温孵育15 min,滴加辣根酶标记的血清(B液),经PBS冲洗3次,DAB显色5 min,背景颜色出现前终止染显色,然后复染、封片、镜检。阴性对照为PBS缓冲液,阳性对照为已知喉癌阳性组织切片,余步骤同前。分析GRP78、bFGF、MVD与临床病理因素的关系及GRP78、bFGF和MVD之间的关系。
1.4结果判定标准
1.4.1GRP78、bFGF表达判定标准 光学显微镜下,GRP78、bFGF主要表达于细胞质中,以呈现淡黄或者棕黄色颗粒为阳性反应。由2位不知患者临床病理资料的资深病理科医师采用Volm双评分法进行判定。图像采集后在染色均匀的肿瘤区每张切片随机选取5个高倍镜视野(×400)。①A值评分(阳性细胞百分率):1分(<25%),2分(25%~50%),3分(>50%);②B值评分(染色强度):0分(为不着色),1分(为浅棕黄色),2分(为棕黄色),3分(为棕褐色)。综合染色阳性细胞数与染色强度判断结果:阴性(-)为0分,弱阳性(+)为1~2分,中度阳性()为3~4分,强阳性()为5~6分。
1.4.2MVD计数标准 D2-40定位于淋巴管内皮细胞,以胞质呈棕黄色颗粒为阳性反应。根据Weidener方法来进行微血管计数:不以是否形成管腔或管腔内有无红细胞为计数依据,而以被D2-40标记成棕黄色的单个内皮细胞或内皮细胞簇来作为一个微血管计数单位。管腔径大于8个红细胞直径或有肌层的血管不参与计数。由2位不知患者临床病理资料的资深病理科医师进行不同视野的微血管数目计数,记录5个不同200倍视野下微血管数目,取其平均值作为MVD结果。
1.5统计学方法 所有数据结果经Excel软件整理,应用SPSS 17.0统计软件进行分析。计数资料采用2检验。计量资料的数据以表示,两样本均数比较用t检验。GRP78与bFGF表达的相关性分析方法采用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1GRP78和bFGF在人喉鳞癌组织、癌旁组织中的表达情况 GRP78和bFGF在喉鳞癌组织、癌旁组织细胞质内均有阳性表达,喉鳞癌组织中阳性表达率均明显高于癌旁组织,差异均有统计学意义(P均<0.05)。见表1及图1~4。
2.2D2-40在喉鳞癌、癌旁组织中的表达情况高倍视野下,喉鳞癌组织中MVD值为25.12±3.77,癌旁组织MVD值为14.65±3.80,喉鳞癌组织中MVD值明显高于癌旁组织,差异有统计学意义(P<0.05)。见图5及图6。

表1 喉鳞癌以及癌旁组织中GRP78和bFGF蛋白表达情况比较 例(%)
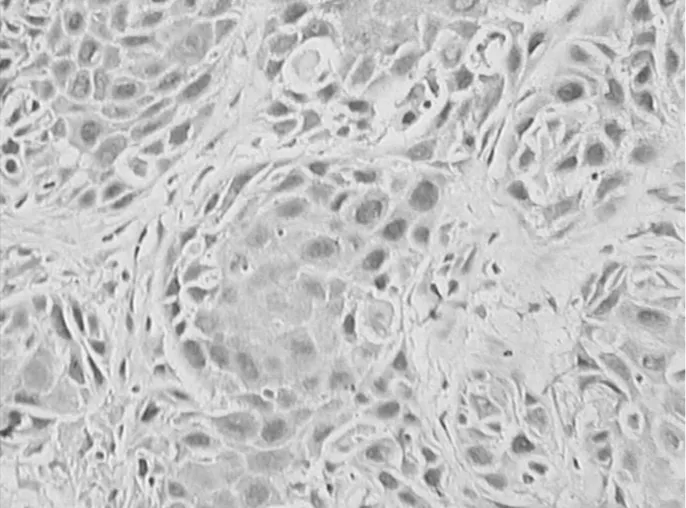
图1 GRP78蛋白在喉鳞癌组织中的表达情况(SP×400)
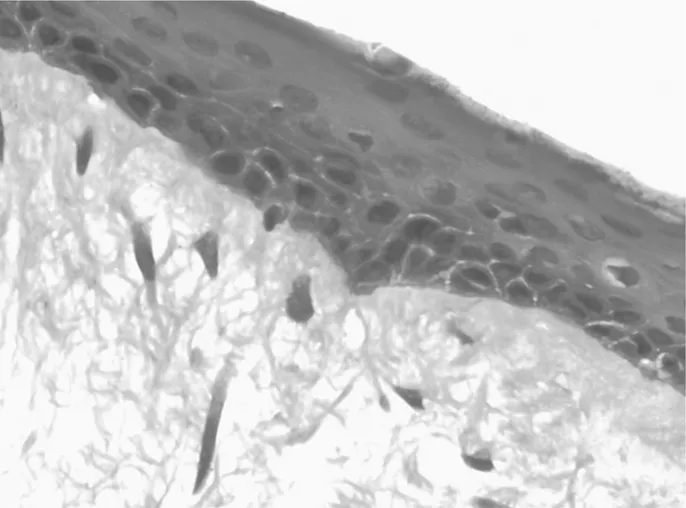
图2 GRP78蛋白在癌旁组织中的表达情况(SP×400)

图3 bFGF蛋白在喉鳞癌组织中的表达情况(SP×400)
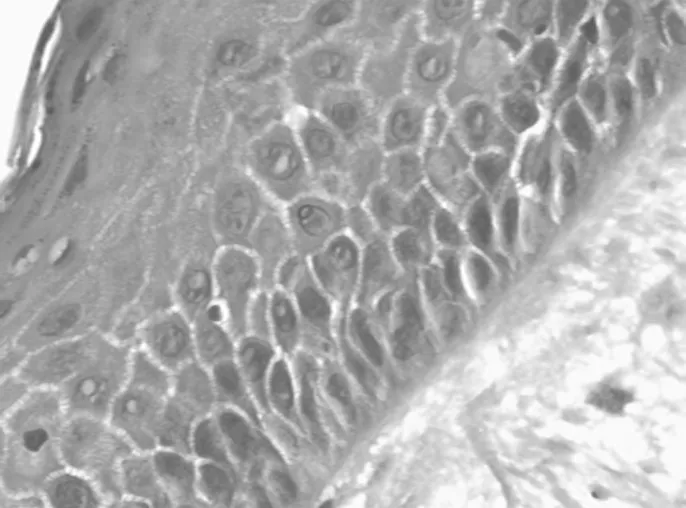
图4 bFGF蛋白在癌旁组织中的表达情况(SP×400)
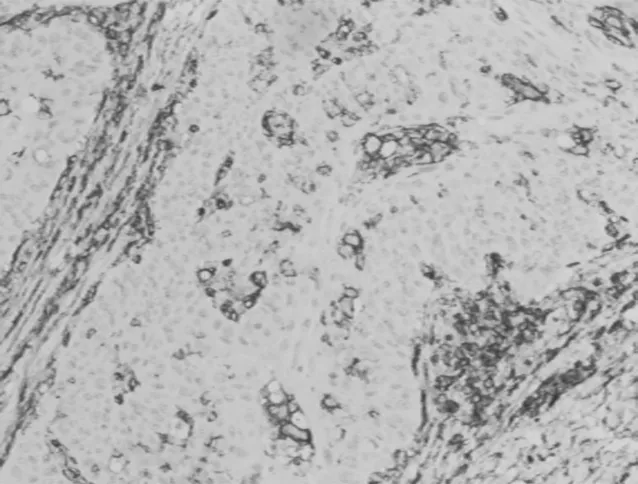
图5 D2-40在喉鳞癌组织中表达(SP×200)

图6 D2-40在癌旁组织中表达(SP×200)
2.3GRP78、bFGF在喉鳞癌组织中表达与临床病理资料的关系 GRP78、bFGF的阳性表达率与喉鳞癌病理学分化程度、淋巴结转移、临床分期有相关性(P均<0.05),与患者性别、年龄、吸烟史以及肿瘤大小无明显相关性(P均>0.05)。MVD与淋巴结转移有相关性(P<0.05),与其余临床病理学因素指标无相关性(P均>0.05)。见表2。
2.4GRP78、bFGF在喉鳞癌组织中表达的相关性GRP78阳性表达的47例喉鳞癌组织中,bFGF阳性35例(74.47%);bFGF阳性表达的50例喉鳞癌组织中,GRP78阳性41例(82.0%)。二者之间有直线正相关性(r=-0.704,P=0.039)。
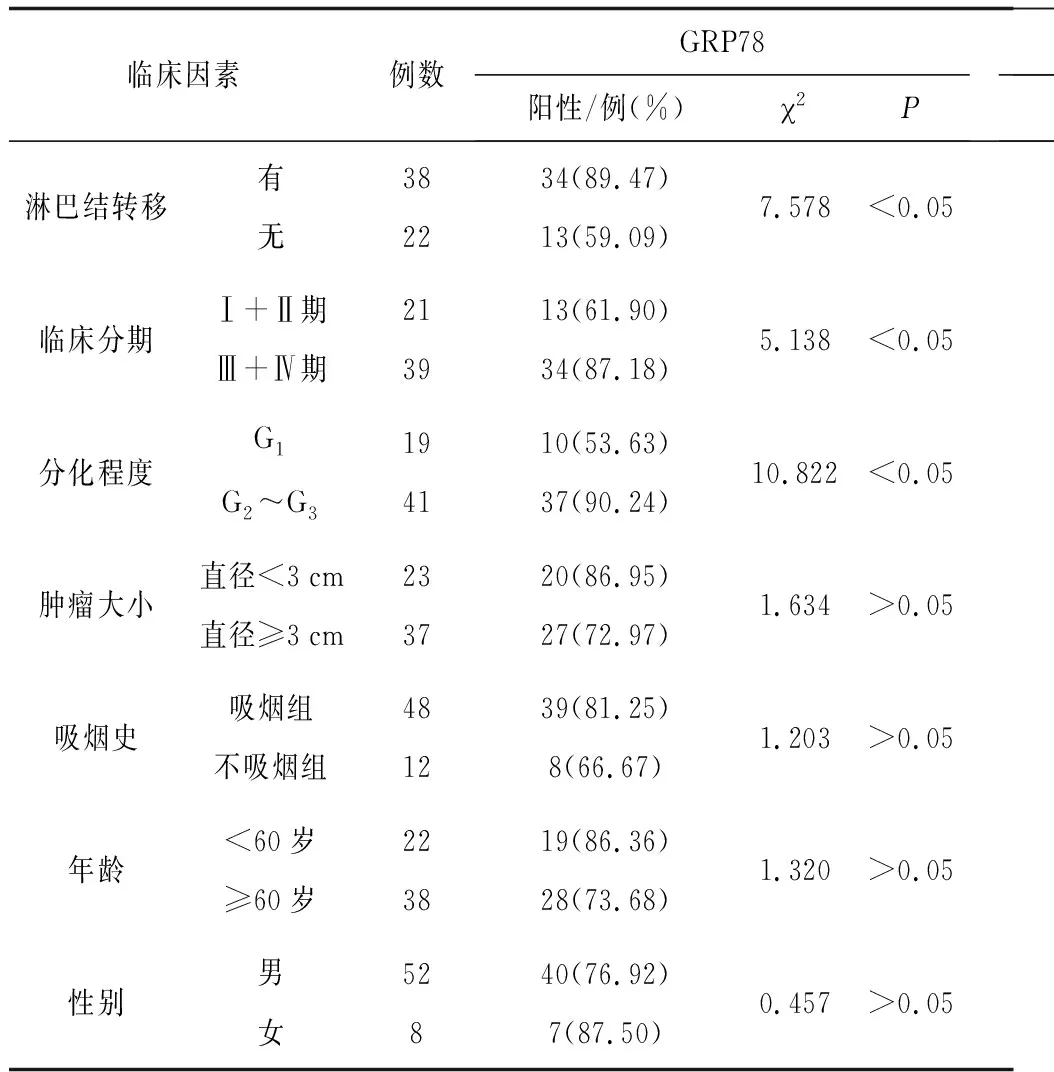
表2 喉鳞癌组织中GRP78、bFGF表达及MVD与临床病理因素的关系
2.5GRP78、bFGF与MVD在喉鳞癌组织中表达的关系 喉鳞癌组织中GRP78阳性表达者MVD值为28.01±3.67,高于GRP78阴性表达者的24.04±4.02,差异有统计学意义(t=2.427,P<0.05)。bFGF阳性表达者MVD值为27.48±2.96,显著高于bFGF阴性表达者的22.74±3.85,差异有统计学意义(t=2.785,P<0.05)。
3 讨 论
肿瘤被称为“永不愈合的伤口”[4]。癌变的产生和发展必须克服几个进化瓶颈,其中癌细胞必须容易增殖,并能同时避免免疫破坏是至关重要的一环[5-6]。通过对肿瘤细胞及其微环境的研究发现,正常微环境稳态系统破坏和癌变密切相关[7],如肿瘤发展的免疫浸润、代谢物的可获得性和肿瘤微环境的应激效应等。正常组织损伤相关的愈合修复机制在肿瘤的形成和转移过程中同样适用:免疫浸润细胞在肿瘤微环境中诱导伤口样炎症,炎性细胞浸润(包括巨噬细胞亚型、调节性T细胞、中性粒细胞和髓源性抑制细胞)[8-9],创造抑制细胞活性的微环境;肿瘤微环境中的高渗透性导致微血管生成应对这些应激反应作出愈合应答[10-11]。
GRP78属于热休克蛋白70家族,其DNA分子序列结构高度保守,是内质网上的一种重要的分子伴侣,作为葡萄糖调节蛋白参与细胞防御系统以及调节内质网Ca稳态[12]。在正常条件下即无内质网应激时处于无活性状态,GRP78与3种负责调节细胞生长、分化、凋亡和信号转导的必需酶即内质网跨膜感受蛋白结合[13-14]。这3种必需酶分别是激活转录因子6(activating transcription factor6,ATF6)、肌醇必需酶1(inositol-requiring enzyme 1,IRE1)和蛋白激酶样内质网激酶(PKR-like ER kinase, PERK)。当细胞内未折叠的蛋白质大量积累,诱导内质网应激时,GRP78与3种跨膜蛋白在未折叠蛋白逐渐堆积产生的强大压力作用下被迫解离,而感受蛋白分离后处于激活状态,导致UPR激活,ATF6、PERK和IRE1上调伴侣的转录,抑制翻译、增强蛋白质折叠、内质网辅助降解(ERAD)和其他功能[15]。过程分为以下几种情况:当内质网内积累的未折叠或错误折叠蛋白通过清理减少后,内质网得以恢复正常功能,保证细胞生存;如果未折叠蛋白的压力没有缓解,UPR将内质网的一部分引导到自噬;如果仍未缓解,则整个细胞就会发生凋亡[16-17],即维持细胞生存与凋亡的动态平衡。同时,在未折叠蛋白质的“挟持”下,GRP78可以逃避内质网“复位”,而随未折叠蛋白质一起转移到细胞质和细胞膜上,出现膜暴露,称为细胞表面CS-GRP78[18]。当内质网应激时,GRP78表达量及转录活性会通过显著增高来维持内质网内环境稳定及钙稳态,其作用机制:“饥饿”时的内环境细胞内通过ADP核糖基化作用使少量营养得以保存,越过“饥年”;转移清除错误折叠蛋白降低内部压力;降低细胞对杀伤性T细胞的敏感性达到阻止细胞凋亡的目的。所以,在细胞受到如“饥饿”等伤害时,GRP78开始扮演重要的防御角色,提高了细胞在各种不利因素刺激下的生存能力。在肿瘤细胞中,GRP78同样扮演保护者角色,其机制有以下几种:通过降低细胞毒性T细胞对肿瘤细胞的杀伤力,产生并提高化疗药物耐药性,从而防止肿瘤细胞被杀伤;参与合成和运输分泌性蛋白;通过介导蛋白质的构型变化,参与构筑生物信号传递旁路系统。肿瘤微环境通过各种机制如灌注不良、生长因子可用性降低、炎症因子刺激、癌细胞高代谢、缺氧和营养缺乏,均导致癌细胞中UPR信号被上调,同时癌细胞向周围正常细胞组织施加“可播散”的UPR信号,通过JNK信号增加生存概率[19]。由于内质网应激和UPR发生时GRP78表达量升高数倍,故其表达量升高可标志UPR发生。综合各种报道,发现下咽癌、肝癌、胃癌、前列腺癌、食管癌等GRP78表达明显增加的患者预后更差[20]。本研究结果显示,喉鳞癌组织中GRP78阳性表达率明显高于癌旁组织,且阳性表达率随肿瘤的分化程度降低而升高,与TNM分期呈正相关,有淋巴结转移者表达率高于无淋巴结转移者,表明在喉鳞癌组织中UPR激活程度与该肿瘤恶性度及侵袭性呈正相关。以上间接说明UPR在喉鳞癌组织中应激程度与肿瘤分化程度以及侵袭性等临床病理因素密切相关。
肿瘤的形成和发展过程中bFGF可能通过以下几种机制扮演促进角色:通过促进瘤床周围新生微血管形成并发散,为肿瘤细胞生长、转移发展提供丰富的营养物质基础。随着喉癌组织生长过程中单位体积内癌细胞增殖过多、凋亡减少,导致肿瘤细胞数量的暴增,短期内耗氧量急剧增高而使周围组织坏死,导致单位体积内肿瘤出现大片炎性改变,伴随产生大量氧自由基以及内环境Ca2+超载;同时大量产生的TNF-α引起血管内皮细胞破坏,发生痉挛导致低灌注出现,直接激活bFGF高表达,诱使剩余内皮细胞进行应对性分裂增殖进行自我修复[21]。此时瘤内单位体积下微血管的大量生成已经为肿瘤下一步发展,即淋巴结转移、周围侵犯提供源动力和途径,因为微血管大量形成足以保证肿瘤继续发展,充足的给养血供得以使瘤体短时间内迅速增大,从而与周围形成巨大压力差,推动或者挤压肿瘤细胞进入瘤体周围微血管、微淋巴管等途径形成淋巴结转移[22]。在肿瘤实体内微血管生长过程中,指向肿瘤中心原始生发区域方向的组织缺氧量、炎性信号、渗透压力、坏死物含量逐渐增高;相反,与之对应位置区域的氧气含量、生长因子、灌注量以及有效养分逐渐减少。本研究结果中,GRP78和bFGF在喉癌组织中均呈现高表达并呈直线正相关关系,且二者表达和喉鳞癌的淋巴结转移、临床分期和分化程度均有关,而与瘤体大小、吸烟量、年龄及性别无关。
综上所述,GRP78和bFGF的高表达很可能是喉癌癌变过程中的重要因素,GRP78可能通过启动UPR激活,导致组织开始自我修复,而bFGF表达促进肿瘤新生血管的形成,从而促进肿瘤的生长及发展转移,两者过度表达可能产生协同作用,保障喉癌细胞快速增殖和转移。GRP78和bFGF可作为判断喉鳞癌转移及预后的指标,为该病的靶向治疗提供了一定思路。
利益冲突:所有作者均声明不存在利益冲突。

