经皮腔内血管成形术治疗自体动静脉内瘘狭窄的疗效及影响因素分析
罗泽恩 刘 勇 曾 宏 施 森 王伟明 胥雄飞 何虎强
西南医科大学附属医院血管外科,四川 泸州 646000
随着人口老龄化的加剧,慢性肾脏疾病发生率逐渐升高,而有效血液透析是维持终末期肾病(end-stage renal disease,ESRD)患者生命的重要方法[1-2]。血液透析通路是ESRD患者维持生存的生命线。而自体动静脉内瘘(arteriovenous fistula,AVF)使用寿命长、感染率低等优点,在2016年发布的墨西哥慢性透析患者贫血的临床实践指南中仍作为首选的血液透析通路[3]。血液透析通路的狭窄及闭塞是造成AVF失功的常见原因,既往多采取修复、转位及人工血管处理,但效果不佳[4]。随着腔内技术的发展和材料学的进步,近年来,采取经皮腔内血管成形术(percutaneous transluminal angioplasty,PTA)治疗,而PTA后第1年通畅率为26%~62%,对患者的透析质量和生活质量仍存在影响[5-6]。但PTA术后可维持通畅时间长于人工血管内瘘[7],本研究探讨PTA治疗AVF狭窄的疗效及影响因素,以期提高AVF通畅率及预防再狭窄发生,现报道如下。
1 资料与方法
1.1 一般资料
收集西南医科大学附属医院2016年4月至2017年3月初次AVF失功后行PTA治疗的ESRD患者临床资料。纳入标准:(1)AVF失功为不能扪及明显震颤、血液流速降低、静脉压升高、上肢水肿或透析时存在疼痛;(2)通过彩色多普勒超声检查提示AVF狭窄及流量<250 ml/min,不能满足正常透析流量。排除标准:人工血管内瘘及合并血栓内瘘。根据纳入与排除标准,最终纳入76例患者,男性41例,女性35例,平均年龄(57.82±15.3)岁;ESRD原发病:36例糖尿病,6例多囊肾,7例肾小球疾病,22例高血压,未知5例;AVF 类型:23例端端吻合,53例端侧吻合;AVF 方向:61例左侧,15例右侧。
1.2 方法
所有患者通过数字减影血管造影(digital subtraction angiography,DSA)进一步确定患者狭窄的部位、长度及病变类型,局部麻醉下行标准PTA手术。根据术前评估狭窄位置选择穿刺方向,首选穿刺静脉段作为入路,对于复杂性病变采取多点穿刺方式。穿刺成功后,置入5~8 F血管鞘后静脉推注0.5 mg/kg肝素。选择泥鳅导丝配合导管通过狭窄闭塞段后,选择普通球囊或高压球囊进行球囊扩张,球囊的直径(4~14 mm)根据邻近狭窄部位正常血管的直径来选择,待病变位置狭窄完全充盈后维持3 min。手术结束前再次进行全程的血管造影,评估狭窄病变解除的情况及回流入上腔静脉血流的流速,确保吻合口听诊可闻及吹风样杂音后拔除血管鞘,穿刺点荷包缝合。PTA过程见图1。
1.3 观察指标及疗效判定
通过留存临床资料统计所有患者狭窄数目、长度和程度;统计PTA术后并发症。轻微并发症经药物或物理治疗后可好转,如血管痉挛、血肿等;主要并发症需手术治疗,如血管破裂、血栓形成等。术后随访36个月,所有患者均在术后1年、2年和3年时到院检查AVF情况。技术成功定义为手术后残余狭窄<30%,临床成功定义为能为患者提供充分的透析,再狭窄为患者经PTA 后出现原有症状,彩色多普勒超声提示流量<250 ml/min和(或)静脉压升高等,经DSA检查,原部位再发狭窄>50%。
1.4 统计学方法
应用SPSS 22.0统计学软件对数据进行分析,计量资料以()表示;非正态分布资料采用M(P25,P75)表示;计数资料以n(%)表示,组间比较采用χ2检验;多因素分析采用Logistic回归分析;以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效
76例患者共111处狭窄,其中23处位于吻合口,7处位于供血动脉,31处位于回流静脉(其中10处位于中心静脉),其余50处均位于近吻合口3 cm静脉端。狭窄长度为16(14,48)mm,狭窄程度为92.5%(87%,94.1%)。经PTA后106处解除狭窄,残余5处狭窄为31%~63%,其中1处狭窄仍可透析使用,故PTA临床成功率为96.4%(107/111),技术成功率为95.5%(106/111)。4例患者术后出现轻微并发症(血管痉挛3例,予以静脉注射30 mg罂粟碱后好转;血肿1例,予以压迫后好转)。3例患者出现主要并发症(血管破裂2例,予以手术修补后好转;血栓形成1例,予以PTA后好转)。
2.2 初级通畅率影响因素的单因素分析
平均随访时间为(24.2±6.5)个月。不同性别和AVF方向、吻合口狭窄、供血动脉狭窄、近吻合口3 cm静脉端狭窄和回流静脉狭窄患者术后1年、2年和3年的初级通畅率比较,差异无统计学意义(P>0.05);不同原发病和中心静脉狭窄并释放支架患者术后1年、2年和3年的初级通畅率比较,差异有统计学意义(P<0.05,表1)。
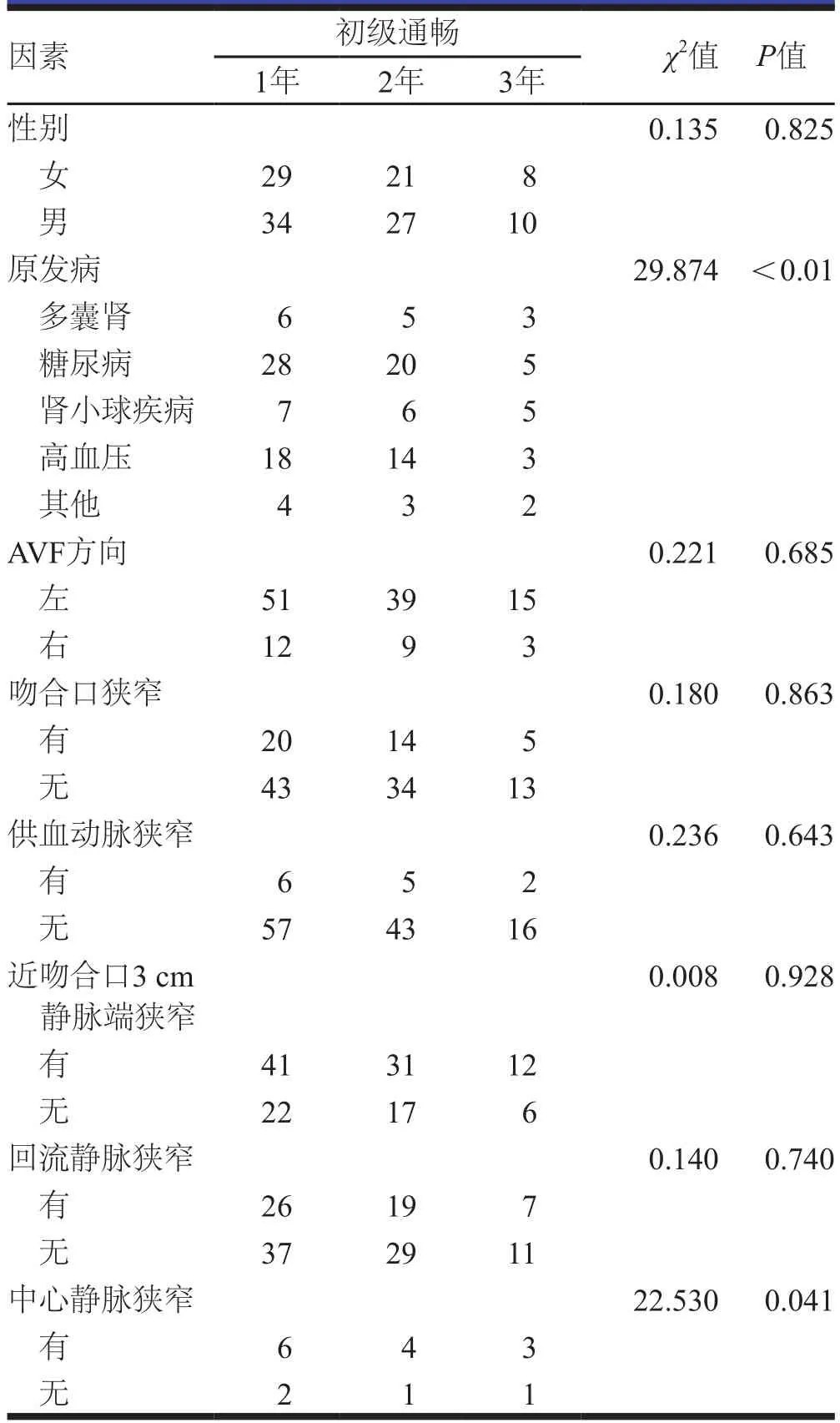
表1 PTA术后AVF通畅率影响因素的单因素分析
2.3 初级通畅率影响因素的多因素分析
以原发病中的多囊肾、糖尿病、肾小球疾病、高血压和中心静脉狭窄情况作为自变量,以初级通畅为因变量进行Logistic回归分析,结果显示,患有糖尿病是PTA术后影响AVF通畅率的危险因素(P<0.05,表2)。中心静脉狭窄由于例数较少无法行多因素分析。
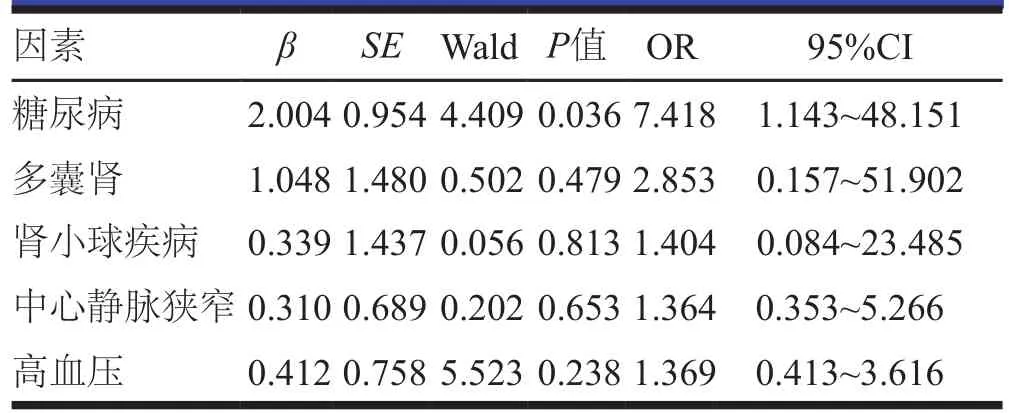
表2 PTA术后AVF通畅率影响因素的多因素分析
3 讨论
ESRD患者需要临时或永久性的高质量血液透析通路来维持生命[8]。在北美和欧洲指南中,AVF作为首选的血管通路,其提供了良好的通畅率和较低的并发症发生率[9-10]。血管通路的再狭窄和闭塞与ESRD的病死率具有直接关系[11],但其发病机制尚不清楚。AVF失功可能与细胞增生、微血管形成、巨噬细胞释放细胞因子,以及内皮细胞和平滑肌细胞一系列的病理生理改变导致血管内膜增生相关[12-13]。当狭窄程度>50%,血液透析率下降,同时继发血栓的风险相应提高[14]。因此,AVF的早期诊断和治疗具有重要意义。
早前研究显示,AVF失功再处理操作难于血管移植[15]。在本研究实际操作中发现:首先由于静脉管壁薄,解剖异常会给临床和影像学诊断、手术操作及疗效带来较多困难;其次狭窄部位多位于供血动脉和上腔静脉之间,某些狭窄导致静脉侧枝出现,而静脉侧枝会影响吻合口的判断及导丝通过;初次通路建立时吻合的角度也会影响导丝穿通能力。本研究结果显示,狭窄长度为16(14,48)mm,狭窄程度为92.5%(87%,94.1%)与既往的报道相似[16],多数狭窄在近吻合口旁,狭窄的中位长度为16(6,143)mm,中位狭窄程度为92.5%(52.0%,97.0%)。
Aktas等[17]研究显示,PTA技术成功率为96.3% ,临床成功率为97.2%;而Yildiz[18]研究显示PTA的技术和临床成功率分别为100.0%和97.0%。而本研究结果显示,PTA的技术和临床成功率分别为95.5%和96.4%,与文献报道基本类似。朱景航等[19]研究发现PTA治疗失功AVF的早期复发率为23%,并确定高龄和糖尿病是早期复发的危险因素。在本研究中,不同原发病和中心静脉狭窄患者术后1年、2年和3年的初级通畅率比较,差异有统计学意义;患有糖尿病是PTA术后影响AVF通畅率的危险因素,这与朱景航等[19]研究结果一致。AVF因血管狭窄而导致失功的患者,PTA具有相当高的技术成功率和优势,同时具有较少的并发症。同时,AVF失功后经过PTA处理后可立即进行血液透析,避免患者因开放手术后需要内瘘的成熟及不必要的中心静脉插管。
研究表明,患有糖尿病是PTA术后影响AVF通畅率的危险因素。目前的研究发现,糖尿病可激活炎性状态、促进氧化应激、诱发骨矿物质代谢紊乱,从而引起血管钙化[20]。此外,合并糖尿病的ESRD患者钙化程度比非糖尿病患者严重,除慢性肾脏疾病危险因素外,ESRD患者还与糖尿病特异性内皮功能障碍、高脂血症、高胰岛素血症、血糖控制不良和组织缺损有关[21]。严重的血管钙化导致血管顺应性降低,从而影响AVF通畅率[22]。本研究合并糖尿病的患者年龄较大,血脂代谢可能紊乱,从而导致血管僵硬或钙化,有待进一步研究。
综上所述,PTA是继传统AVF失功后修复、转位及人工血管植入的又一新技术,并且具有较好的临床疗效。但患者合并患糖尿病是影响AVF初畅通畅率的主要影响因素,但由于本研究为回顾性研究且样本量相对较少,需进一步研究以明确其影响因素,从而提高PTA术后通畅率。

