斑马鱼血管新生相关因子PTPRB的原核表达及其多克隆抗体制备
余艳玲 罗辉 罗洪林 冯鹏霏 肖蕊 张永德 林勇 宋漫玲 潘传燕


摘要:【目的】原核表达斑马鱼(Danio rerio)蛋白酪氨酸磷酸酶受体B(PTPRB)并制备多克隆抗体,为研究斑马鱼PTPRB基因功能及血管发育相关信号传导通路打下基础。【方法】采用无缝克隆技术将斑马鱼PTPRB基因插入原核表达载体pET-B2m构建重组表达质粒,转化大肠杆菌B21感受态细胞后采用IPTG进行诱导表达,然后以诱导表达的融合蛋白免疫大耳兔制备多克隆抗体,并采用Western blotting和ELISA检测多克隆抗体的特异性及免疫效价。【结果】斑马鱼PTPRB蛋白亲水性均值为-0.490,属于亲水性蛋白,且具有较丰富的潜在抗原表位位点,分布均匀,无典型的跨膜区。将斑马鱼PTPRB基因插入原核表达载体pET-B2m成功构建获得重组表达质粒pET-B2-PTPRB,转化B21感受态细胞后经IPTG诱导表达,即获得35.0 kD的融合蛋白。融合蛋白PTPRB主要以包涵体形式存在;以纯化融合蛋白PTPRB免疫大耳兔,其血清抗体效价为1∶2048000,说明采用融合蛋白PTPRB可有效刺激大耳兔产生较强的免疫反應,获得较高效价的PTPRB多克隆抗体。Western blotting检测结果显示,PTPRB多克隆抗体具良好抗原特异性。采用Protein A/G亲和层析柱对制备获得的PTPRB多克隆抗体进行亲和层析纯化,可获得高纯度的多克隆抗体,纯化后的PTPRB多克隆抗体浓度在10 mg/mL以上。【结论】构建的斑马鱼PTPRB基因原核表达载体能高效表达具备良好免疫原性的融合蛋白PTPRB,以融合蛋白PTPRB免疫大耳兔可获得高效价、高特异性的PTPRB多克隆抗体,为研究斑马鱼PTPRB蛋白功能提供有利工具,也为揭示PTPRB在鱼类血管发育中的作用机制提供技术支持。
关键词: 斑马鱼;PTPRB;原核表达;多克隆抗体
中图分类号: S965.819 文献标志码: A 文章编号:2095-1191(2021)04-1090-08
Prokaryotic expression and polyclonal antibody preparation of Danio rerio angiogenesis related factor PTPRB
FENG Peng-fei1, XIAO Rui1, ZHANG Yong-de1, LIN Yong1, SONG Man-ling1,
PAN Chuan-yan1, YU Yan-ling1, LUO Hui2, LUO Hong-lin1*
(1Guangxi Academy of Fishery Sciences/Guangxi Key Laboratory of Genetic Breeding and Healthy Aquaculture, Nanning 530021, China; 2School of Animal Science, Southwest University, Chongqing 402460, China)
Abstract:【Objective】 Prokaryotic expression of zebrafish(Danio rerio) protein tyrosine phosphatase receptor B (PTPRB) and preparation of polyclonal antibodies were conducted to lay the foundation for studying the function of zebrafish PTPRB gene and signal transduction pathways related to vascular development. 【Method】The zebrafish PTPRB gene was inserted into the prokaryotic expression vector pET-B2m to construct the recombinant expression plasmid by seamless cloning technology. The recombinant plasmid was transformed into Escherichia coli B21 competent cells, and induced to express by IPTG. Then the polyclonal antibody was prepared by immunizing rabbits with the induced fusion protein. The specificity and immune titer of the polyclonal antibody were detected by Western blotting and ELISA. 【Result】The average hydrophilicity of zebrafish PTPRB protein was -0.490, which belonged to hydrophilic protein. It had abundant potential epitopes, distributed evenly and had no typical transmembrane region. The zebrafish PTPRB gene was inserted into the prokaryotic expression vector pET-B2m, and the recombinant expression plasmid pET-B2-PTPRB was successfully constructed. The recombinant expression plasmid was transformed into B21 competent cells and induced by IPTG to express a 35.0 kD fusion protein. The fusion protein PTPRB mainly existed in the form of inclusion bodies; the purified fusion protein PTPRB was used to immunize big-eared rabbits, and the serum antibody titer was 1∶2048000, indicating that the fusion protein PTPRB could effectively stimulate the big-eared rabbits to produce a stronger immune response and obtain PTPRB polyclonal antibody with high titer. Western blotting results showed that PTPRB polyclonal antibody has good antigen specificity. High purity polyclonal antibody against PTPRB was obtained by using protein A/G affinity chromatography column. The concentration of the purified PTPRB polyclonal antibody was above 10 mg/mL. 【Conclusion】The constructed zebrafish PTPRB gene prokaryotic expression vector can efficiently express the fusion protein PTPRB with good immunogenicity. High titer and high specificity polyclonal antibody against PTPRB can be obtained by immunizing big-eared rabbits with the fusion protein PTPRB, which provides a tool for studying the function of zebrafish PTPRB protein and a way to reveal the mechanism of PTPRB in fish vascular development.
Key words: Danio rerio; PTPRB; prokaryotic expression; polyclonal antibody
Foundation item:Guangxi Innovation Driven Development Special Project(Guike AA17204080-3,Guike AA182 42031-2); Independent Project of Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture(17-A-01-02, 19-A-01-05)
0 引言
【研究意义】蛋白酪氨酸磷酸酶受体B(Polyclonal antibody to protein tyrosine phosphatase receptor type B,PTPRB)是一种高度混杂R3受体蛋白酪氨酸磷酸酶,可脱去磷酸多个受体酪氨酸激酶(Barr et al.,2009)。PTPRB也是一种具有内皮细胞黏附连接(AJs)的跨膜蛋白,在内皮细胞中特异表达(Nawroth et al.,2002;Emig et al.,2010;Pond et al.,2013)。PTPRB由2215个氨基酸残基组成,拥有18个结构域,包括1个跨膜结构域和1个胞内结构域(Ando and Yamamoto,2009);其功能是对血管内皮细胞钙黏连蛋白(VE-cadherin)及其血管内皮细胞(Vascular endothelial cell,EC)发挥黏着作用(Dominguez et al.,2007)。由于过去有关PTPRB的研究主要集中在血管形成方面,因此也被称为VE-PTP(Vascular endothelial-protein tyrosine phosphatase)(翁星月,2020)。在脊椎动物的发育过程中,PTPRB是血管分支形态发生的负调节因子,通过调节FGFR下游的信号而发挥作用。因此,研究PTPRB蛋白的原核表达,对进一步揭示动物机体的血管发育机制具有重要意义。【前人研究进展】已有研究表明,PTPRB可通过抑制GEF-H1与血管内皮细胞VE-cadherin稳定连接及限制内皮细胞通透性,进而限制AJs的RhoA信号传导和降低VE-cadherin内吞率,最终维持血管稳态(Mellberg et al.,2009;Thomson et al.,2019)。许玲俐(2012)研究发现,PTPRB表达量可影响小鼠视网膜血管分布的均匀程度。霍子荷(2017)研究证实,阿托伐他汀(Atorvastatin)通过促进转录因子SP1表达,以及与PTPRB基因启动子的结合,而促进PTPRB基因表达,进而降低内皮细胞间通透性。Delgado-Bellido等(2020)通过自噬调节VE-cadherin蛋白的降解,证实PTPRB在血管生成拟态发育过程中发挥关键作用。斑马鱼(Danio rerio)属于热带淡水硬骨鱼,因其生长繁殖周期短,且具有与人类高度相似的基因组等特点,常作为重要模式动物应用于发育生物学领域研究(何秋霞等,2009)。斑马鱼PTPRB是一种特异的血管内皮蛋白酪氨酸磷酸酶(PTPs),其基因表达产物的结构与小鼠PTPRB非常相似,说明PTPRB在斑马鱼中也具有PTPs活性(杨少丽等,2009;孙桂金等,2010;钟敏,2011;Souma et al.,2018)。Nicoli等(2010)研究发现,通过激活斑马鱼的MAPK/PIK3信号通路,可有效上调PTPRB和KLF2基因表达,而达到促进血管重构的效果。刘源(2018)通过研究藏茵陈水提物影响斑马鱼血管完整性的信号通路机制,发现斑马鱼胚胎新生血管的生成与PTPRB基因下调表达有关。【本研究切入点】大量研究表明,PTPRB在动物体内起到维持血管稳态的作用,但至今鲜见有关斑马鱼PTPRB抗体的报道,很大程度上限制了对斑马鱼PTPRB基因功能的深入研究。【拟解决的关键问题】通过构建斑马鱼PTPRB原核表达载体,采用IPTG诱导得到融合PTPRB蛋白,经Ni-NTA亲和层析纯化后免疫大耳兔,以期获得具有良好抗原特性的PTPRB多克隆抗体,为进一步研究斑马鱼PTPRB基因功能及血管发育相关信号传导通路打下基础。
1 材料与方法
1. 1 试验材料
原核表达载体pET-B2m和大肠杆菌(Escherichia coli)B21感受态细胞购自武汉金开瑞生物工程有限公司;完全弗式佐剂和不完全弗氏佐剂购自美国Sigma公司;Taq DNA聚合酶、蛋白Marker及内切酶BamH I和Sal I购自Fermentas公司;PVDF膜购自ThermoFisher公司;IPTG购自生工生物工程(上海)股份有限公司;In-Fusion? HD Cloning Kit购自Clontech公司;Ni-NTA亲和层析柱购自GE Healthcare公司;质粒提取试剂盒及胶回收试剂盒购自天根生物科技(北京)有限公司。
1. 2 PTPRB蛋白抗原表位预测及亲/疏水性分析
采用DNASTAR 7.1(https://www.dnastar.com/software/)預测斑马鱼PTPRB蛋白的抗原指数,利用ExPASy(https://web.expasy.org/protscale/)在线预测其亲/疏水性,并以TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测斑马鱼PTPRB蛋白跨膜区。
1. 3 目的基因PCR扩增
根据斑马鱼PTPRB基因编码区(CDS)序列(GenBank登录号NM_001316727.1),采用Primer 5.0设计含有载体序列的扩增引物Pf-PTPREB-F(5'-tttc aaggtccactgggttctcggactatgATCGACAGGCCCCCTGT CCCACCAG-3')和Pf-PTPREB-R(5'-tcagtggtggtggtgg tggtgctcgagtgcggccttaGCCGCTTCGTGGTGCTGA-3')(小写字母为载体序列扩增引物)。PCR反应体系100.0 μL:Taq DNA聚合酶(5 U/μL)1.0 μL,10×Taq Buffer 10.0 μL,dNTP(10 mmol/L)2.0 μL,上、下游引物(10 μmol/L)各5.0 μL,DNA模板2.0 μL,ddH2O补足至100.0 μL。扩增程序:94 ℃预变性4 min;94 ℃ 45 s,52 ℃ 45 s,72 ℃ 45 s,进行28个循环;72 ℃延伸10 min。PCR产物经1.2%琼脂糖凝胶电泳检测并切胶回收。
1. 4 重组原核表达载体构建
对斑马鱼PTPRB基因序列进行大肠杆菌密码子偏好性优化,以BamH I和Sal I对原核表达载体pET-B2m进行双酶切处理,依靠载体与目的基因序列的同源碱基互补配对成环,将斑马鱼PTPRB基因亚克隆至原核表达载体pET-B2m上。筛选阳性克隆送至上海英骏生物技术有限公司测序,测序结果采用MAFFT ver.7(https://mafft.cbrc.jp/alignment/server/)进行多序列比对分析,以确定所插入的基因是否正确。
1. 5 融合蛋白诱导表达
以构建的重组表达质粒pET-B2-PTPRB转化B21感受态细胞,挑取单克隆,接入3.0 mL的LB液体培养基中,37 ℃下200 r/min振荡培养至菌液浑浊(OD600=0.6),加入IPTG至终浓度为0.5 mmol/L,继续37 ℃振荡培养3 h,然后取1.0 mL菌液离心收集沉淀,以100.0 μL的1% SDS重悬菌液后混匀,100 ℃处理10 min,取上清液进行15% SDS-PAGE电泳检测分析。
1. 6 融合蛋白包涵体纯化
以5.0 mL PBS重悬菌液沉淀,并加入蛋白酶抑制剂PMSF,低温超声破碎后5000×g离心15 min,收集沉淀,再以8 mol/L尿素缓冲液溶解沉淀,16000×g离心30 min,取上清液,按Ni-NTA亲和层析柱操作指南进行融合蛋白纯化,并采用SDS-PAGE电泳检测融合蛋白的纯化效果。
1. 7 多克隆抗体制备与鉴定
将纯化后达到抗体制备要求的融合蛋白与等量弗氏佐剂充分乳化,每隔2周免疫大耳兔1次,共免疫5次。首次免疫使用完全弗氏佐剂进行乳化,其他4次则使用不完全弗氏佐剂进行乳化,完成第5次免疫2周后检测免疫抗体效价,待抗体表达稳定后采集大耳兔血清,采用Protein A/G亲和层析柱进行纯化。
1. 8 抗体效价ELISA测定
参照张永德等(2018)的方法,以融合蛋白为抗原,按100.0 μL/孔加入到96孔板中进行抗原包被,再以含2%卵清蛋白(OVA)的BSA室温封闭30 min,PBST洗3次;大耳兔血清按二倍稀释法将1∶2000的原始浓度稀释至1∶8192000,以不同稀释比例的单克隆抗体为一抗,以空白血清为阴性对照,每孔加入100.0 μL,37 ℃孵育1 h后,PBST洗涤3次;每孔加入100.0 ?L IgG,37 ℃恒温孵育45 min,PBST液洗5次;每孔加入100.0 μL TMB显色液,充分显色后加入50.0 μL终止反应液(2 mol/L H2SO4)。计算试验样品孔的P/N,P/N≥2时为阳性(李彦等,2011),阴性对照为无抗体检测孔。
1. 9 Western blotting检测分析
纯化融合蛋白PTPRB经SDS-PAGE电泳分检测离后,湿法转印至PVDF膜上;PBST洗膜3次,封闭液浸泡过夜。加入融合蛋白PTPRB多克隆抗体(大耳兔血清),37 ℃孵育1 h,PBST洗涤3次;加入抗兔-HRP二抗,37 ℃恒温孵育1 h,经PBST洗涤3次后浸入显影液中显色,再浸入定影液中定影,晾干,拍照分析。
1. 10 抗体纯化
采用Protein A/G亲和层析柱,将收集的抗血清与2×PBS平衡的Protein A抗体纯化柱结合4 h,上样混合后,用10倍柱体积的Binding Buffer清洗平衡柱子2次,再以0.1 mol/L柠檬酸进行洗脱,收集洗脱液;洗脱液经处理制样后进行SDS-PAGE电泳检测, -80 ℃保存备用。
2 结果与分析
2. 1 斑马鱼PTPRB蛋白亲/疏水性及跨膜区预测结果
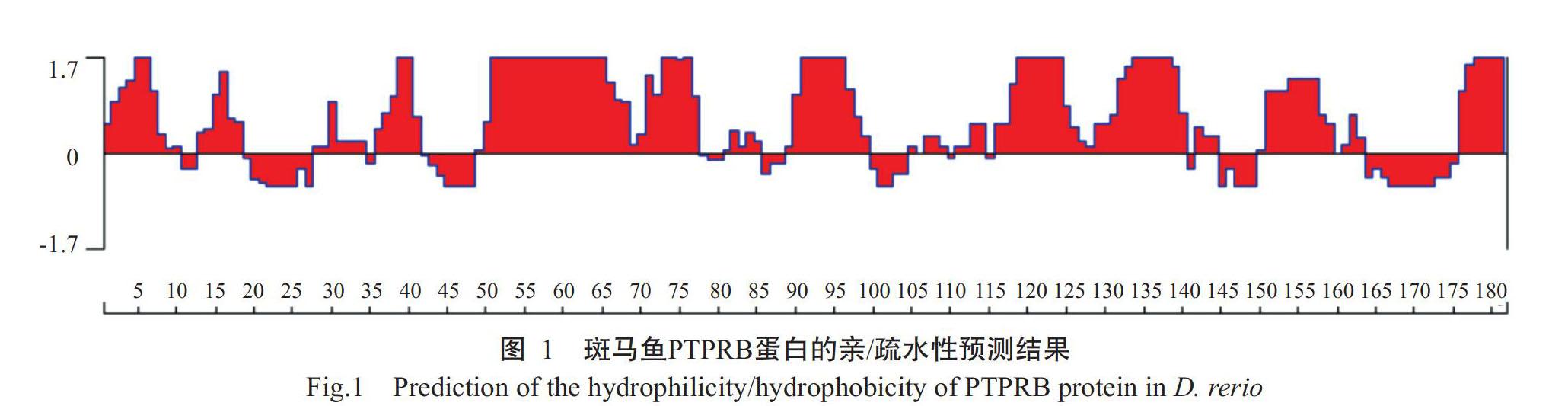
斑马鱼PTPRB蛋白由182个氨基酸残基组成,氨基酸序列中以亲水性氨基酸比例较高,其亲水性均值为-0.490,亲水性氨基酸区段位置分别位于第1~10位、第12~17位、第35~41位、第47~77位、第88~100位、第115~140位、第150~158位和第175~182位(图1),即氨基酸序列亲水性良好。丙氨酸(Ala)、半胱氨酸(Cys)、异亮氨酸(Ile)、亮氨酸(Leu)、甲硫氨酸(Met)、苯丙氨酸(Phe)和缬氨酸(Val)等疏水性氨基酸分别占编码氨基酸总数的7.00%、7.78%、1.00%、9.22%、7.11%、8.11%和9.67%。TMHMM 2.0預测结果显示,斑马鱼PTPRB蛋白不存在跨膜区,其182个氨基酸残基均位于细胞表面,易于表达纯化。
2. 2 斑马鱼PTPRB蛋白抗原性预测结果
采用DNAStar的Protean模块对斑马鱼PTPRB蛋白的抗原指数进行预测,结果发现斑马鱼PTPRB蛋白序列存在较多的抗原表位位点,且部分位点集中形成抗原性较高的区段,主要区段分别位于第2~8位、第12~17位、第28~31位、第35~37位、第38~41位、第51~99位、第116~130位、第131~143位、第147~165位和第175~182位(图2)。这10个区段具有较强的亲水性位点,因此利用斑马鱼PTPRB蛋白制备多克隆抗体具有较高的可行性。
2. 3 斑马鱼PTPRB重组原核表达载体构建及鉴定结果
以Pf-PTPREB-F和Pf-PTPREB-R为引物、重组表达质粒pET-B2-PTPRB为模板,经PCR扩增与1.5%琼脂糖凝胶电泳检测,结果显示在950 bp附近出现特异性的目的条带(图3)。经序列测定及比对分析,确定斑马鱼PTPRB基因已正确插入原核表达载体pET-B2m,即重组表达质粒pET-B2-PTPRB构建成功。
2. 4 融合蛋白PTPRB诱导表达结果
以重组表达质粒pET-B2-PTPRB转化B21感受态细胞,经IPTG诱导表达、离心沉淀及SDS-PAGE电泳检测,结果显示诱导表达菌株在35.0 kD处出现1条明显的表达条带(图4),与预期结果相符,而未经IPTG诱导的菌株在此处未见明显的表达条带。
2. 5 重组蛋白PTPRB表达形式的鉴定结果
重组表达质粒pET-B2-PTPRB转化菌株大量诱导表达后,经离心破碎,收集沉淀和上清液进行SDS-PAGE电泳检测,结果显示在35.0 kD处均获得1条特异性的蛋白条带(图5),但沉淀中的融合蛋白含量明显高于上清液。
2. 6 融合蛋白PTPRB的提取与纯化结果
重组表达质粒pET-B2-PTPRB转化菌株诱导表达的融合蛋白PTPRB经超声波破碎,即获得PTPRB包涵体,纯化后进行SDS-PAGE电泳检测,结果获得1条明显的特异性条带(图6),其大小与预期的目的蛋白(35.5 kD)一致。
2. 7 融合蛋白PTPRB血清抗体的免疫效价
采用ELISA检测纯化融合蛋白PTPRB免疫大耳兔的抗体效价,结果(图7)显示其血清抗体效价为1∶2048000,说明原核表达的融合蛋白PTPRB可诱导大耳兔产生良好的免疫反应,且能获得较高的抗体效价。
2. 8 Western blotting检测结果
采用Western blotting进一步验证纯化融合蛋白PTPRB的特异性,结果如图8所示,10和25 ng纯化融合蛋白PTPRB在48.9 kD附近的相应位置均出现1条清晰的特异性条带,其中25 ng纯化融合蛋白PTPRB出现的条带更清晰,而免疫前阴性血清(对照组)未出现任何条带,说明通过免疫大耳兔制备获得的PTPRB多克隆抗体具有较高的特异性。
2. 9 抗体纯化结果
采用Protein A/G亲和层析柱对制备获得的PTPRB多克隆抗体进行亲和层析纯化,可获得高纯度的多克隆抗体。纯化后的PTPRB多克隆抗体经SDS-PAGE电泳检测,结果获得2条特异性条带(图9),其大小分别为45.0 kD(带纹清晰)和25.0 kD(带纹相对较弱),与PTPRB多克隆抗体的重链和轻链的大小相吻合。纯化后的PTPRB多克隆抗体浓度在10 mg/mL以上,纯化效果良好。
3 讨论
PTPRB可调节血管重构及血管生成,由1个具有c端磷酸化位點的细胞内催化结构域、1个跨膜结构域和1个具有多纤维连接结构域的细胞外结构域组成(Muramatsu et al.,2017)。PTPRB在动物胚胎血管发育中的作用及功能已得到证实(Carota et al.,2019),可通过增强VE-cadherin介导的黏附作用,从而影响血管系统发育(孟梅,2015)。PTPRB在细胞内的信号转导过程中,通过调节细胞内酪氨酸的磷酸化水平,而参与调节内皮细胞的生长与迁移(Delgado-Bellido et al.,2020)。有研究表明,在药物干预作用下斑马鱼胚胎PTPRB基因表达下调,致使VE-cadherin无法去磷酸化,导致内皮细胞的黏附和连接结构破坏,内皮细胞连接异常而抑制斑马鱼新生血管生成(Chen et al.,2018)。此外,PTPRB抗体可通过平衡Tie-2活性和内皮细胞增殖,控制新生小鼠的血管发育(Thomson et al.,2019)。虽然已有研究证实PTPRB在斑马鱼中具有酪氨酸磷酸酶活性(杨少丽等,2009),但其作用机制尚未明确。为此,本研究通过制备兔抗鱼PTPRB多克隆抗体,以期为揭示PTPRB在调节鱼类血管重构及血管生成过程中的作用机制提供技术支撑。斑马鱼PTPRB蛋白亲/疏水性及跨膜区预测结果显示,其亲水性均值为-0.490,属于亲水性蛋白,且具有较丰富的潜在抗原表位位点,分布均匀,无典型的跨膜区,说明对斑马鱼PTPRB进行原核表达与多克隆抗体制备具有可行性。
本研究采用无缝克隆技术构建重组表达质粒pET-B2-PTPRB,并转化B21感受态细胞进行原核表达,获得的融合蛋白分子量约35.0 kD,与理论分子量37.0 kD存在一定差异,可能与斑马鱼PTPRB蛋白在大肠杆菌中的修饰过程及His-Tag的加入有关。SDS-PAGE电泳检测结果表明,在重组表达质粒pET-B2-PTPRB转化菌株的上清液和沉淀中均能检测到约35.0 kD的特异性条带,但沉淀中的融合蛋白含量明显高于上清液,说明IPTG诱导表达获得的融合蛋白PTPRB可能是以可溶性和不溶性的形式同时存在,但主要是不溶性包涵体蛋白。包涵体蛋白是一般基因原核表达常见的形式,是大肠杆菌作为重组菌不可避免的特质(Mitraki et al.,1991)。大量研究表明,外源基因在大肠杆菌中高水平表达时,若新生肽链的聚集速率超过蛋白正常折叠速率就会在菌体内形成不溶且无活性的包涵体(井明艳和孙建义,2004;Rinas et al.,2017)。蛋白表达量也是影响包涵体形成的因素之一,蛋白表达量与包涵体的形成成正比,当蛋白表达量高于细胞总蛋白的2%即导致包涵体形成。包涵体的形成提示通过大肠杆菌B21感受态细胞能高效表达斑马鱼PTPRB蛋白。此外,包涵体的聚集不会使酶或蛋白失活(Novo et al.,2010),在转基因、组织工程及再生医学等领域已得到广泛应用,且无需溶解和重新折叠(柴燕涛等,2016;Tian et al.,2016)。本研究也发现,采用具有包涵体的融合蛋白PTPRB免疫大耳兔,可获得具有较高效价的PTPRB多克隆抗体,即包涵体的存在对抗体制备未产生明显影响。
PTPRB是在斑马鱼中新发现的受体分子,目前尚无抗PTPRB的商业化特异抗体,因此亟待研发出斑马鱼PTPRB多克隆抗体,为进一步研究PTPRB基因的生物功能提供技术支持。本研究以纯化后的融合蛋白PTPRB为抗原对大耳兔进行免疫刺激,其血清抗体效价为1∶2048000,说明采用融合蛋白PTPRB可有效刺激大耳兔产生较强的免疫反应,获得较高效价的PTPRB多克隆抗体。该结论不仅为斑马鱼PTPRB蛋白功能研究提供有利工具,也为深入探究PTPRB在鱼类血管发育中的作用机制提供技术支持。
4 结论
构建的斑马鱼PTPRB基因原核表达载体能高效表达具备良好免疫原性的融合蛋白PTPRB,以融合蛋白PTPRB免疫大耳兔可获得高效价、高特异性的PTPRB多克隆抗体,为研究斑马鱼PTPRB蛋白功能提供有利工具,也为揭示PTPRB在鱼类血管发育中的作用机制提供技术支持。
参考文献:
柴燕涛,姜棋予,谢国明,胡燕,邬顺全,杨锐创,貌盼勇,侯俊. 2016. 包涵体蛋白3种纯化方法的比较[J]. 中国医药导报,13(10):4-6. [Chai Y T,Jiang Q Y,Xie G M,Hu Y,Wu S Q,Yang R C,Mao P Y,Hou J. 2016. Comparison of three methods for purification of inclusion body protein[J]. China Medical Herald,13(10):4-6.]
何秋霞,刘可春,楚杰,王思锋,韩利文,王希敏. 2009. 斑马鱼作为模式生物在心血管疾病研究中的应用[J]. 生命的化学,29(5):721-726. [He C X,Liu K C,Chu J,Wang S F,Han L W,Wang X M. 2009. The application of zebra-fish as a model organism in the research of cardiovascular diseases[J]. Chemistry of Life,29(5):721-726.]
霍子荷. 2017. Atorvastatin促进VE-PTP表达和内皮细胞粘附连接的作用及其机制研究[D]. 苏州:苏州大学. [Huo Z H. 2017. The role and mechanism of Atorvastatin to enhance VE-PTP expression and endothelial adherent junction[D]. Suzhou:Soochow University.]
井明艳,孙建义. 2004. 蛋白质的折叠调控与包涵体的形成[J]. 浙江大学学报(农业与生命科学版),30(6):690-696. doi:10.3321/j.issn:1008-9209.2004.06.020. [Jing M Y,Sun J Y. 2004. Protein folding and the formation of inclusion bodies[J]. Journal of Zhejiang University(Agricultural and Life Sciences Edition),30(6):690-696.]
李彦,牛星,王青娟,牛钟相. 2011. REV重组env蛋白间接ELISA诊断试剂盒的研制[J]. 中国兽药杂志,45(3):26-30. doi:10.3969/j.issn.1002-1280.2011.03.008. [Li Y,Niu X,Wang Q J,Niu Z X. 2011. Development of an indirect ELISA kit to direct REV sera with recombinant env protein[J]. Chinese Journal of Veterinary Drug,45(3):26-30.]
劉源. 2018. 藏茵陈水提物通过血管内皮细胞蛋白酪氨酸磷酸酶抑制斑马鱼血管生成的研究[D]. 成都:成都中医药大学. [Liu Y. 2018. The study of anti-angiogenesis of capillary wormwood herb water extract on zebra fish by targeting vascular endothelial protein tyrosine phosphatase[D]. Chengdu:Chengdu University of Traditional Chinese Medicine.]
孟梅. 2015. VE-cadherin介导的血管内皮细胞粘着连接的调控机制[D]. 苏州:苏州大学. [Meng M. 2015. The regulatory mechanism of VE-cadherin-mediated vascular endothelial cell adherens junctions[D]. Suzhou:Soochow University.]
孙桂金,潘杰,刘可春,王雪,王思锋. 2010. 斑马鱼不同发育时期血管内皮生长因子受体2基因表达的实时定量PCR分析[J]. 安徽农业科学,38(16):8444-8445. doi:10.3969/ j.issn.0517-6611.2010.16.061. [Sun G J,Pan J,Liu K C,Wang X,Wang S F. 2010. Real-time quantitative PCR analysis of vascular endothelial growth factor receptor-2 expression at different developmental stages of zebrafish[J]. Journal of Anhui Agricultural Science,38(16):8444-8445.]
翁星月. 2020. 蛋白酪氨酸磷酸酶受体B在结直肠癌转移中的作用及机制研究[D]. 杭州:浙江大学. [Weng X Y. 2020. The functions of PTPRB in the metastasis of colorectal cancer and its potential mechanism[D]. Hangzhou:Zhejiang University.]
許玲俐. 2012. 高氧诱导小鼠视网膜新生血管过程中不同细胞因子mRNA表达水平的检测[D]. 杭州:浙江大学. [Xu L L. 2012. Expression of angiogenesis related factors in the retina of mouse with oxygen-induced retinopathy[D]. Hangzhou:Zhejiang University.]
杨少丽,薛钦昭,王艳,郭占勇,秦松. 2009. 血管内皮生长因子及其受体在斑马鱼胚胎血管发育中的作用[J]. 生物物理学报,25(1):5-12. doi:10.3321/j.issn:1000-6737. 2009.01.001. [Yang S L,Xue Q Z,Wang Y,Guo Z Y,Qin S. 2009. Roles of vascular endothelial growth factor and its receptors in embryonic zebrafish vascular development[J]. Acta Biophysica Sinica,25(1):5-12.]
张永德,林勇,冯鹏霏,陈忠,杜雪松,黄姻,潘传燕,罗洪林. 2018. 尼罗罗非鱼Lck多克隆抗体的制备及鉴定[J]. 南方农业学报,49(11):2304-2310. doi:10.3969/j.issn.2095-1191.2018.11.27. [Zhang Y D,Lin Y,Feng P F,Chen Z,Du X S,Huang Y,Pan C Y,Luo H L. 2018. Preparation and identification of Lck polyclonal antibody in Nile tilapia[J]. Journal of Southern Agriculture,49(11):2304-2310.]
钟敏. 2011. 斑马鱼造血调控因子的研究进展[J]. 国际输血及血液学杂志,34(1):70-74. doi:10.3760/cma.j.issn.1673- 419X. 2011.01.018. [Zhong M. 2011. Research progress of zebrafish hematopoietic regulatory factors[J]. International Journal of Blood Transfusion and Hematology,34(1):70-74.]
Ando J,Yamamoto K. 2009. Vascular mechanobiology:Endothelial cell responses to fluid shear stress[J]. Circulation Journal,73(11):1983-1992. doi:10.1253/circj.cj-09-0583.
Barr A J,Ugochukwu E,Lee W H,King O N F,Filippakopoulos P,Alfano I,Savitsky P,Burgess-Brown N A,Müeller S,Knapp S. 2009. Large-scale structural analysis of the classical human protein tyrosine phosphatome[J]. Cell,136(2):352-363. doi:10.1016/j.cell.2008.11.038.
Carota I A,Kenig-Kozlovsky Y,Onay T,Scott R,Thomson B R,Souma T,Bartlett C S,Li Y Y,Procissi D,Ramirez V,Yamaguchi S,Tarjus A,Tanna C E,Li C J,Eremina V,Vestweber D,Oladipupo S S,Breyer M D,Quaggin S E. 2019. Targeting VE-PTP phosphatase protects the kidney from diabetic injury[J]. The Journal of Experimental Me-dicine,216(4):936-949. doi:10.1084/jem.20180009.
Chen K,Wang C Q,Fan Y Q,Gu J,Han Z H,Wang Y,Gao L,Zeng H S. 2018. Identification of mundoserone by zebrafish in vivo screening as a natural product with anti-angiogenic activity[J]. Experimental and Therapeutic Me-dicine,16(6):4562-4568. doi:10.3892/etm.2018.6748.
Delgado-Bellido D,Bueno-Galera C,López-Jiménez L,Garcia-Diaz A,Oliver F J. 2020. Endothelial phosphatase VE-PTP participates in vasculogenic mimicry by preven-ting autophagic degradation of VE-cadherin[J]. Frontiers in Oncology,10:18. doi:10.3389/fonc.2020.00018.
Dominguez M G,Hughes V C,Pan L,Simmons M,Daly C,Anderson K,Noguera-Troise I,Murphy A J,Valenzuela D M,Davis S,Thurston G,Yancopoulos G D,Gale N W. 2007. Vascular endothelial tyrosine phosphatase (VE-PTP)-null mice undergo vasculogenesis but die embryo-nically because of defects in angiogenesis[J]. Proceedings of the National Academy of Sciences of the United States of America,104(9):3243-3248. doi:10.1073/pnas.06115 10104.
Emig D,Salomonis N,Baumbach J,Lengauer T,Conklin B R,Albrecht M. 2010. AltAnalyze and DomainGraph:Ana-lyzing and visualizing exon expression data[J]. Nucleic Acids Research,38:W755-W762. doi:10.1093/nar/gkq405.
Mellberg S,Dimberg A,Bahram F,Hayashi M,Rennel E,Ameur A,Westholm J O,Larsson E,Lindahl P,Cross M J,Claesson-Welsh L. 2009. Transcriptional profiling reveals a critical role for tyrosine phos-phatase VE-PTP in regulation of VEGFR2 activity and endothelial cell morphogenesis[J]. FASEB Journal,23(5):1490-1502. doi:10. 1096/fj.08-123810.
Mitraki A,Fane B,Haase-Pettingell C,Sturtevant J,King J. 1991. Global suppression of protein folding defects and inclusion body formation[J]. Science,253(5015):54-58. doi:10.1126/science.1648264.
Muramatsu F,Kidoya H,Naito H,Hayashi Y,Iba T,Takakura N. 2017. Plakoglobin maintains the integrity of vascular endothelial cell junctions and regulates VEGF-induced phosphorylation of VE-cadherin[J]. Journal of Biochemi-stry,162(1):55-62. doi:10.1093/jb/mvx001.
Nawroth R,Poell G,Ranft A,Kloep S,Samulowitz U,Fa-chinger G,Golding M,Shima D T,Deutsch U,V estweber D. 2002. VE-PTP and VE-cadherin ectodomains interact to facilitate regulation of phosphorylation and cell contacts[J]. The EMBO Journal,21(18):4885-4895. doi:10. 1093/emboj/cdf497.
Nicoli S,Standley C,Walker P,Hurlstone A,Fogarty K E,Lawson N D. 2010. Micro RNA-mediated integration of haemodynamics and Vegf signalling during angiogenesis[J]. Nature,464(7292):1196-1200. doi:10.1038/nature 08889.
Novo J B,Oliveira M L S,Magalh?es G S,Morganti L,Raw I,Ho P L. 2010. Generation of polyclonal antibodies against recombinant human glucocerebrosidase produced in Escherichia coli[J]. Molecular Biotechnology,46(3):279-286. doi:10.1007/s12033-010-9303-4.
Pond A C,Bin X,Batts T,Roarty K,Hilsenbeck S,Rosen J M. 2013. Fibroblast growth factor receptor signaling is essential for normal mammary gland development and stem cell function[J]. Stem Cells,31(1):178-189. doi:10.1002/stem.1266.
Rinas U,Garcia-Fruitós E,Corchero J L,Vázquez E,Seras-Franzoso J,Villaverde A. 2017. Bacterial inclusion bo-dies:Discovering their better half[J]. Trends in Biochemi-cal Sciences,42(9):726-737. doi:10.1016/j.tibs.2017.01. 005.
Souma T,Thomson B R,Heinen S,Carota A I,Yamaguchi S,Onay T,Liu P,Ghosh A K,Li C J,Eremina V,Hong Y K,Economides A N,Vestweber D,Peters K G,Jin J,Quaggin S E. 2018. Context-dependent functions of angiopoietin 2 are determined by the endothelial phosphatase VEPTP[J]. Proceedings of the National Academy of Sciences of the United States of America,115(6):1298-1303. doi:10.1073/pnas.1714446115.
Thomson B R,Carota I A,Souma T,Soman S,Vestweber D,Quaggin S E. 2019. Targeting the vascular-specific phosphatase PTPRB protects against retinal ganglion cell loss in a pre-clinical model of glaucoma[J]. eLife,8:e48474. doi:10.7554/eLife.48474.
Tian H S,Zhao Y,Chen N Z,Wu M Y,Gong W Y,Zheng J,Fernig D G,Jungbauer A,Wang D Z,Li X K,Jiang C. 2016. High production in E. coli of biologically active recombinant human fibroblast growth factor 20 and its neuroprotective effects[J]. Applied Microbiology and Biotechnology,100(7):3023-3034. doi:10.1007/s00253-015-7168-y.
(責任编辑 兰宗宝)

