室内灰尘中五溴联苯醚(BDE-99)干扰Dio3影响斑马鱼甲状腺功能调节
尹晓宇,董文静,李嘉伟,齐澈力木格,于永利,杨景峰,董武
内蒙古民族大学动物科学技术学院,内蒙古自治区毒物监控及毒理学重点实验室,通辽 028000
多溴联苯醚(polybrominated diphenyl ethers, PBDEs)是溴化阻燃剂(BRF)类的化学物质,由于其高性能、低成本和独特的理化性质,已成为世界上使用最广泛的阻燃剂之一。它是一类含溴原子的芳香族化合物,根据溴原子在苯环上的取代位置和个数的不同,PBDEs可分为209种同分异构体[1]。虽然,PBDEs作为阻燃剂使用成本低廉,但由于它们在环境中不易降解,且具有较高的生物累积潜力以及潜在毒性,导致它们被归类为新型持久性环境有机污染物[2]。研究者发现,PBDEs在家庭灰尘中、鱼体内和淤泥中大量蓄积,且PBDEs在人体内蓄积,可能会导致胎儿畸形和甲状腺功能失调。Johnson-Restrepo和Kannan[3]比较了室内灰尘和摄入食物中的PBDEs浓度,认为室内灰尘是PBDEs暴露的主要途径。Smielowska和Zabiegala[4]发现,PBDEs沉积在由于重力下落而产生的粉尘(即悬浮颗粒物)上,因此,粉尘是PBDEs的重要储藏环境和来源。Bu等[5]研究发现,BDE-209、BDE-47和BDE-99是室内沉降尘埃中最主要的化合物。Zhu等[6]也发现,室内灰尘被PBDEs污染,并且中国东部地区的PBDEs浓度高于西部地区,城市地区的PBDEs浓度高于农村地区,这表明,社会经济发展对PBDEs污染水平具有重大影响。尘土中的PBDEs很难降解,因此,被联合国环境规划署(UNEP)和联合国工业开发组织(UNIDO)列为持久性有机污染物(POPs),被叫做POP-PBDEs[7],且尘土中的PBDEs易被生物利用并具有生物活性。尘土中的PBDEs可通过呼吸进入肺部,从而进入血液循环,对健康造成一定的威胁。尤其办公室环境中PBDEs的暴露,可能导致上班人群受PBDEs的严重危害[8-9]。
有关多溴联苯醚的毒性机理,可能与改变血液中的甲状腺激素水平及其受体有关,PBDEs对甲状腺功能的影响,主要表现在影响甲状腺素在血清中的水平[10]或甲状腺素调控相关的基因表达。Arkoosh等[11]发现,鲑鱼中BDE-99的摄入会降低血液循环中四碘甲状腺原氨酸(T4)和三碘甲状腺原氨酸(T3)的浓度。Qian等[12]发现,小鼠在妊娠和哺乳期暴露于BDE-209,其甲状腺素脱碘酶的mRNA表达和蛋白表达受到影响,后代血清中的甲状腺激素(THs)水平进而受到破坏,从而可能导致后代小鼠的神经功能受损。Han等[13]发现,斑马鱼亲本暴露于BDE-209,会对F1代产生发育毒性,并破坏后代的甲状腺内分泌系统。
斑马鱼作为实验动物模型,因其具有胚胎透明、发育迅速、便于观察和操作、对药物极其敏感及可利用资源极其丰富等诸多优势,而被广泛应用。使用斑马鱼胚胎评价PBDEs的毒性及其作用机制,具有独特优势。在本研究中,针对家庭及办公室灰尘中的PBDEs含量进行了检测,特别是针对BDE-99进行了研究,评估其对斑马鱼代谢以及相关甲状腺素及甲状腺激素脱碘酶Ⅲ(Dio3)的影响,探讨了BDE-99对甲状腺功能的影响,为今后对PBDEs的研究提供了参考,BDE-99和BDE-47的化合物结构如图1所示。

图1 多溴联苯醚(PBDEs)中BDE-99和BDE-47以及甲状腺激素中三碘甲状腺原氨酸(T3)和四碘甲状腺原氨酸(T4)的化学结构式Fig. 1 The chemical structural formulas of BDE-99 and BDE-47 of polybrominated diphenyl ethers and T3 (triiodothyronine) and T4 (tetraiodothyronine) of thyroid hormones
1 材料与方法(Materials and methods)
1.1 斑马鱼胚胎收集
成年AB系斑马鱼(Daniorerio),在循环水养殖系统中进行繁育(北京爱生科技发展公司),雌雄鱼分开饲喂,每天14 h∶10 h的光∶暗周期。养殖温度(28±1) ℃,pH保持在7.0~7.6之间,电导率保持在440~640 μS之间。实验时挑选出优质健康的性成熟斑马鱼,按照雌雄斑马鱼1∶2的比例放入交配缸中,待第2天早上开灯,斑马鱼见光后开始产卵,并收集胚胎,放入斑马鱼培养液(ZR液)中,并放置在28 ℃恒温培养箱中孵化。
1.2 粉尘样品收集与处理
在2018年5—10月收集并处理企业办公室(电脑较多)和家庭(没有电脑)中4个地点(办公室桌面、办公室地面、家庭桌面和家庭地面)的室内灰尘样品[14](n=80),并且灰尘收集在纤维素套管中[15]。除取样地点不同外,其他取样条件均保持一致。样品过筛至500 μm以下,并储存在-20 ℃。用二氯甲烷和己烷(V∶V=50∶50)萃取约100 mg的粉尘,超声处理后,萃取液使用氮气吹干浓缩。一半萃取液通过GC/MS鉴定阻燃剂[14];另一半蒸干使用100 μL二甲基亚砜(DMSO)(纯度为99.5%,西格玛)溶解定容用于生物监控,DMSO最终浓度<0.1%。
1.3 GC-MS检测
参考Fulton等[16]的方法,使用GC-MS检测灰尘中BDE-99和BDE-47的含量,选择办公室和家庭中2个地点的灰尘进行检测。将灰尘萃取液重新溶于100 mL异辛烷中,并添加BDE-47和BDE-99作为回收率测定标准品。使用配有HP-5MS色谱柱(30 m×0.25 mm×0.25 mm)的Agilent 6850 GC和Agilent 5975C MS进行样品分析。使用氦气作为载气,以脉冲不分流模式进样1 mL样品。最初将GC柱箱设置为80 ℃,以20 ℃·min-1的速度升至100 ℃,保持2 min。然后,将烤箱以30 ℃·min-1的速度加热到220 ℃,再将速率降低到1 ℃·min-1,直到温度达到225 ℃,并在其中保持5 min。然后以5 ℃·min-1的速度将温度升至280 ℃,并且以20 ℃·min-1的速率达到300 ℃,此时为最终温度,保持3 min。入口温度为260 ℃,离子源和四重离子均设置为150 ℃。最终通过色谱图分析所得数据。
1.4 暴露方法
暴露溶液用鱼类养殖系统水对原液进行稀释获得。鱼类养殖系统水为空白对照组,浓度为100 nmol·L-1的BDE-99作为阳性对照组,4个不同地点的灰尘萃取液为实验组。暴露试验在六孔板中进行,每孔放入正常斑马鱼胚胎10粒,并置于28 ℃恒温培养箱(Heratherm IGS180, Thermo Fisher Scientific)中培养,每组进行5次以上的重复试验。暴露时间为4~36 hpf,观察斑马鱼胚胎眼部色素强度变化,用ImageJ对眼部色素沉着水平进行量化。
1.5 BDE-99在斑马鱼体内的转化检测
收集经100 nmol·L-1BDE-99暴露后的斑马鱼胚胎(幼鱼)和经暴露后的幼鱼长成的成年鱼,解剖取出成年鱼肝脏,利用GC-MS检测24 hpf、48 hpf、96 hpf和10 dpf斑马鱼胚胎(幼鱼)和成年鱼肝脏体内的BDE-99和BDE-47的含量。
1.6 整体原位杂交
当斑马鱼胚胎达到实验所需要的发育阶段,将其固定在含4%(w/V)多聚甲醛(分析纯,纯度为98.5%,福晨化学)的磷酸盐缓冲溶液(PBS)中(pH 7.4)过夜,之后用PBS清洗后浸泡于100%甲醇中,可放置于-20 ℃冰箱中储存。整体原位杂交(WISH)是按照Dong等[17]方法进行的。基本原理是斑马鱼胚胎与809个碱基对的斑马鱼Dio3的反义杂交链结合。然后使用以下引物进行克隆并且做Dio3探针(正向引物5’-TAGACGTGCAGCACCGCGGA-3’;反向引物5’-CGCTCCAGCCAGTCTCTGAG-3’),在64 ℃杂交过夜后,胚胎用2×SSC(300 mmol·L-1NaCl,30 mmol·L-1柠檬酸钠,pH 7.0)洗3次,然后用0.2×SSC洗3次,每次30 min。接下来的胚胎是用2%的封闭剂封闭(Roche公司,德国)。然后在4 ℃用3 000×稀释的DIG抗体与碱性磷酸酶偶联(Roche公司,德国);最后,与BM-Purple底物(Roche公司,德国)发色。
1.7 总RNA提取、cDNA生成和荧光定量PCR
使用TRIzol试剂处理完整的胚胎,从整体斑马鱼胚胎中提取总RNA,使用Nano Drop2000测定提取的总RNA浓度。纯化的总RNA立即用于cDNA合成。cDNA的产生用高容量cDNA反转录试剂盒(Applied Biosystems Inc.)完成,反应方法按照厂家说明书进行,cDNA样本使用前将其保持在-20 ℃冷冻。使用TaqMan进行基因表达测定和基因表达分析(Applied Biosystems Inc.;4331182)。反转录加入0.2 ng cDNA后进行反应,与TaqMan Universal PCR Master Mix混合,并使用实时荧光定量PCR仪(7900HT, Applied Biosystems,美国)进行PCR检测,用Sequence Detection System 2.0软件分析,实验方法与步骤基本与Dong等[17]描述的相同。样品的Dio3基因(正向引物5’-AGATGTTCACGCTGGAGTCG-3’,反向引物5’-CGAAGTTGAGGATCAGCGGT-3’)表达数据使用18s RNA作为内参基因(正向引物5’-TCGCTAGTTGGCATCGTTTATG-3’,反向引物5’-CGGAGGTTCGAAGACGATCA-3’),来补偿在胚胎之间RNA量的内在变异性。
1.8 ELISA法检测TT3和TT4水平
挑选出4 hpf的斑马鱼胚胎,经不同浓度的BDE-99暴露至72 hpf,收集0 (对照)、1、10、50和100 nmol·L-1浓度组胚胎各10粒,每个浓度组设立3个重复。用去离子水清洗,弃掉清洗液后,称重,按照每组鱼的质量与PBS(pH=7.2)体积比为1∶20的比例,加入PBS,在0 ℃下进行匀浆,匀浆后在10 000 r·min-1、4 ℃离心5 min,取上清液,用Elisa试剂盒(上海圻明生物技术有限公司)检测斑马鱼体内总T3(total T3, TT3)和总T4(total T4, TT4)的含量[18]。
1.9 统计分析
所有表达数据均表示为平均值±SEM,使用GraphPad Prism software进行统计分析。差异显著性使用单因素方差分析。P<0.05的情况下被认为是统计学上的差异显著。
2 结果(Results)
2.1 办公室及家庭灰尘中PBDEs的化学检测
BDE-99和BDE-47的检出率都是100%,但检出浓度范围较大。BDE-99在办公室和家庭中的检出浓度分别为0.01~159.32 ng·g-1和0.06~49.32 ng·g-1,中间值浓度分别为6.275 ng·g-1和1.835 ng·g-1,BDE-47在办公室和家庭中的检出浓度分别为0.01~148.32 ng·g-1和0.04~49.21 ng·g-1,中间值浓度分别是2.090 ng·g-1和1.860 ng·g-1。结果表明,BDE-99比BDE-47有更高的浓度残留,办公室比家庭有更高的残存(图2)。考虑到可能是办公室的电脑产品比家庭的多,造成了更多的阻燃剂残留。

图2 BDE-99和BDE-47在办公室和家庭的灰尘中的浓度Fig. 2 BDE-99 and BDE-47 concentrations in offices and homes dust
2.2 灰尘中PBDEs毒性效应的初期生物学检测
笔者先前的研究结果表明[19],选择眼部作为评价的标准时,BDE-99能够引起36 hpf斑马鱼胚胎整体色素的降低。同样地,使用灰尘提取物经过100×稀释后,斑马鱼胚胎暴露于灰尘提取物组与BDE-99阳性对照组相似,在斑马鱼胚胎发育到36 hpf时,斑马鱼胚胎眼部色素的沉着显著降低(图3(f)和3(g))。这说明,使用生物学方法可以进行PBDEs的初期高通量筛选。

图3 灰尘提取物降低斑马鱼眼睛色素沉着强度注:胚胎暴露于灰尘提取物和BDE-99 (4~36 hpf);用ImageJ对眼部色素沉着水平进行量化;(a)对照组,(d) BDE-99阳性暴露组,(b)、(c)、(e)和(f)灰尘提取物暴露组,其中,(b)和(c)分别为家庭中地面和桌面的灰尘提取物暴露组,(e)和(f)分别为办公室地面和桌面(电脑附近)的灰尘提取物暴露组,(g)胚胎的色素强度柱状图(每组20个胚胎),*表示与对照组有显著差异(P<0.05),比例尺为100 μm,×100为稀释100倍。Fig. 3 Dust extract reduces eye pigmentation intensity of zebrafishNote: The embryo was exposed to dust extract and BDE-99 (4~36 hpf); ImageJ was used to quantify the level of eye pigmentation; (a) control group; (d) BDE-99 positive exposure group; (b), (c), (e) and (f) dust extract exposure group, where (b) and (c) are the ground and desktop dust extract exposure group in the family, (e) and (f) are respectively exposure group of dust extracts on office floor and desktop (near computer); (g) is the histogram of the pigment intensity of embryos (20 embryos per group); *indicates a significant difference from the control group (P<0.05); the scale bar is 100 μm; ×100 means 100 times dilution.
2.3 BDE-99在斑马鱼体内的转化
PBDEs在动物体内会被代谢,BDE-99在灰尘中的检出率达100%,而BDE-99在动物体内经过脱溴作用主要降解为BDE-47[20]。使用GC-MS检测了BDE-99在不同发育阶段斑马鱼体内的分解代谢情况。试验分别检测了24 hpf、48 hpf、96 hpf和10 dpf斑马鱼胚胎(幼鱼)和成年鱼肝脏中BDE-99的降解情况,结果表明,24 hpf和48 hpf时,无明显降解,BDE-47也没有被明显检测到(图4),这说明,斑马鱼胚胎在此时期对BDE-99几乎无降解作用。进而推测灰尘萃取液对36 hpf斑马鱼胚胎色素的降低作用可能主要由BDE-99引起,而非BDE-47。
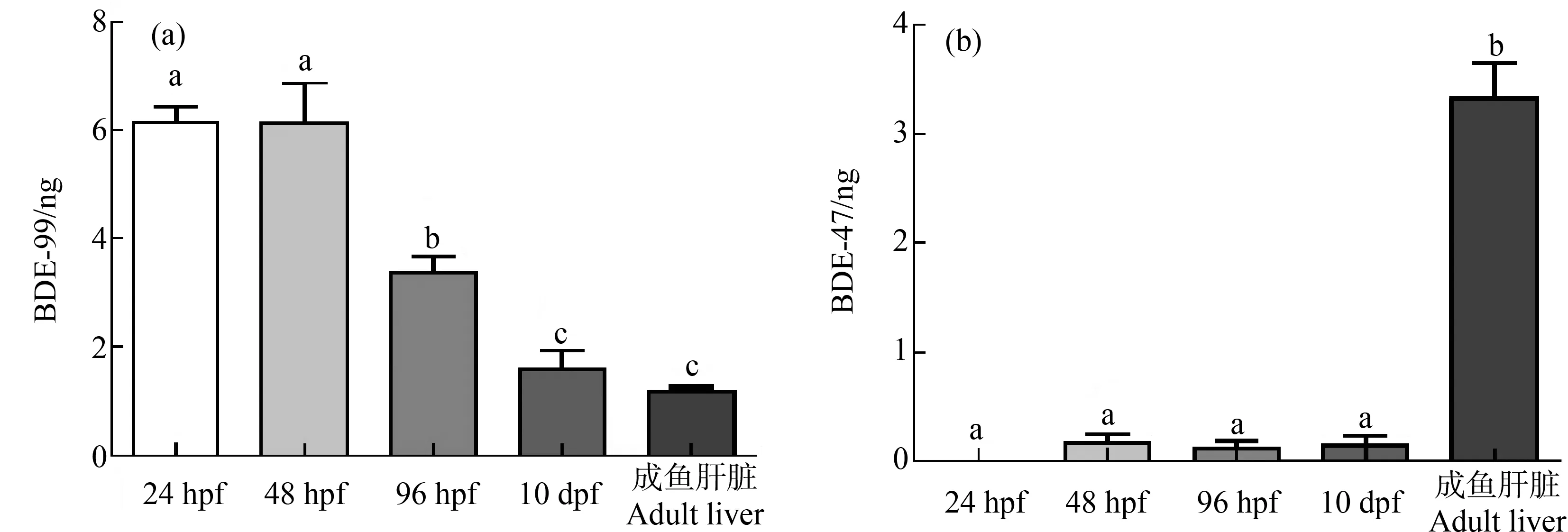
图4 斑马鱼胚胎(幼鱼)和成年鱼肝脏中BDE-99的降解注:将不同发育时期(24 hpf、48 hpf、96 hpf和10 dpf)斑马鱼(或者成年鱼肝脏)制成匀浆,提取溶酶体后作用于BDE-99,然后使用GC-MS检测BDE-99和BDE-47的含量;不同字母表示差异显著(P<0.05)。Fig. 4 Zebrafish embryo (juvenile fish) and adult fish liver degrading BDE-99Note: Zebrafish at different developmental stages (24 hpf, 48 hpf, 96 hpf and 10 dpf) or adult fish liver are made into a homogenate, and lysosomes are extracted and then applied to BDE-99; the content of BDE-47 and BDE-99 are detected by GC-MS; the different letters indicate significant difference (P<0.05).
2.4 BDE-99对Dio3基因表达的影响
为考察BDE-99对斑马鱼胚胎Dio3的影响,将4 hpf斑马鱼胚胎暴露于BDE-99溶液中直至胚胎发育到22 hpf和72 hpf。采用WISH和RT-PCR方法检测了Dio3 mRNA的表达。WISH方法的检测结果证明了暴露于1、10、50和100 nmol·L-1BDE-99的斑马鱼胚胎,其Dio3 mRNA表达有增加趋势,表达位置主要位于原肾管部位(图5(a)~5(e))。RT-PCR定量检测结果表明,Dio3 mRNA表达随BDE-99暴露浓度的增加而升高(1、10、50和100 nmol·L-1)。22 hpf时,BDE-99表现为诱导Dio3 mRNA表达的提高(图6(a)),暴露于10、50和100 nmol·L-1BDE-99后的斑马鱼胚胎,Dio3 mRNA表达均升高了2.47倍以上(P<0.05)。72 hpf时,暴露于BDE-99的斑马鱼胚胎,Dio3 mRNA表达随着浓度增加(1、10、50和100 nmol·L-1)均升高了1.64倍以上(图6(b)),但在统计学上差异不显著(P>0.05)。

图5 Dio3基因表达在斑马鱼胚胎原肾管部位注:胚胎在4~22 hpf暴露于BDE-99;蓝色部位是Dio3表达部位;比例尺为100 μm。Fig. 5 Dio3 gene is expressed in the protorenal duct of the zebrafish embryoNote: Embryos were exposed to BDE-99 from 4 to 22 hpf; the blue part is the Dio3 gene expression part; bar=100 μm.

图6 BDE-99上调了斑马鱼胚胎 Dio3 mRNA表达注:斑马鱼胚胎暴露于0(对照)、1、10、50和100 nmol·L-1的BDE-99,当胚胎发育到22 hpf和72 hpf时,使用RT-PCR检测Dio3 mRNA表达;每组包含10个胚胎,每组3个重复;不同的字母表示显著差异(平均值±SEM,P<0.05)。Fig. 6 BDE-99 up-regulated the expression of Dio3 mRNA in zebrafish embryosNote: Zebrafish embryos were exposed to BDE-99 at 0 (control), 1, 10, 50 and 100 nmol·L-1; when the embryos reached 22 hpf and 72 hpf, RT-PCR was used to detect Dio3 mRNA expression; each group contains 10 embryos, with 3 replicates in each group; different letters indicate significant differences (mean±SEM, P<0.05).
2.5 BDE-99对甲状腺素的影响
斑马鱼胚胎在经过1、10、50和100 nmol·L-1浓度的BDE-99处理后,在72 hpf进行甲状腺素TT3和TT4的检测。与对照组相比,TT3含量在10、50和100 nmol·L-1浓度组都有显著降低,分别降低至对照组的81%、79%和73% (P<0.05) (图7(a)),TT4含量在50 nmol·L-1和100 nmol·L-1浓度组都显著降低,分别降低至对照的84%和85%(图7(b))。
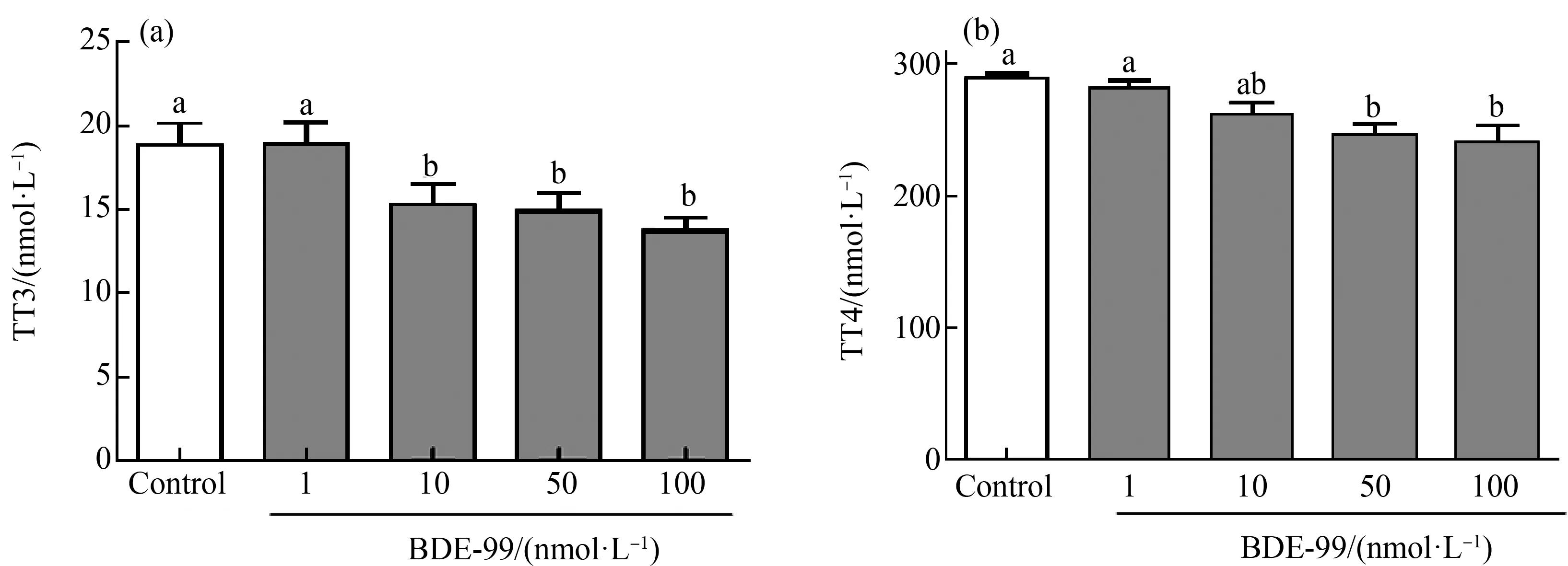
图7 BDE-99降低斑马鱼体内总三碘甲状腺原氨酸(TT3)和总四碘甲状腺原氨酸(TT4)含量注:斑马鱼胚胎暴露于0(对照)、1、10、50和100 nmol·L-1的BDE-99;使用Elisa法检测72 hpf斑马鱼胚胎的甲状腺素含量;每组包含10个胚胎,每组3个重复;不同的字母表示显著差异(平均值±SEM;P<0.05)。Fig. 7 BDE-99 reduces the content of total triiodothyronine (TT3) and total tetraiodothyronine (TT4) in zebrafishNote: Zebrafish embryos were exposed to BDE-99 at 0 (control), 1, 10, 50, and 100 nmol·L-1; the thyroxine content of 72 hpf zebrafish embryos was measured using the Elisa method; each group contains 10 embryos, with 3 replicates in each group; different letters indicate significant differences (mean±SEM; P<0.05).
3 讨论(Discussion)
本研究结果表明,在灰尘中含有BDE-99和BDE-47,且BDE-99的含量大于BDE-47,且办公室灰尘中的BDE-99和BDE-47含量比家庭中的多,可能是由于办公室的电脑产品比家庭应用得更多,电脑附近会释放更多的BDE-99和BDE-47。将斑马鱼胚胎暴露于办公室和家庭灰尘的萃取液中,会导致斑马鱼眼部色素沉着减少,与BDE-99有着相似的现象。已知BDE-99在动物体内能够降解为BDE-47,GC-MS检测结果表明,斑马鱼胚胎内的BDE-99在24 hpf和48 hpf基本无降解,也没有明显检测到BDE-47,进一步说明灰尘萃取液对36 hpf斑马鱼胚胎色素的降低作用主要是BDE-99引起的。将斑马鱼胚胎暴露于BDE-99,结果显示,Dio3表达量升高,TT3和TT4含量降低,这表明,BDE-99会增强Dio3活性,Dio3会介导甲状腺激素的调节,Dio3 mRNA表达量升高导致甲状腺激素分泌减少,对机体代谢造成影响。
Wang等[21]在90%的房屋粉尘中,检测到BDE-47、BDE-99、BDE-153、BDE-18和BDE-209,其中,BDE-209居多。本研究也在灰尘中检测到了BDE-47和BDE-99。Li等[22]在研究中提到,旧计算机相较于新计算机会释放更多的PBDEs。Zheng等[23]在手机和个人计算机表面检测到BDE-209。Lee等[24]的定量物质流分析结果显示,电视和电脑显示器中含有大量的PBDEs。这表明,电子产品会释放更多的PBDEs,本研究也有证实了这一点。
色素沉积的降低与甲状腺激素脱碘酶有一定关联,本研究结果也证实了BDE-99会造成Dio3 mRNA表达量的升高,这可能是眼部色素沉着降低的原因之一。当非洲爪蟾暴露于C-BDE-99(特定放射性49 Ci,即1 813 GBq·(mol·L-1)-1与BDE-99),1.5 d后在视网膜黑色素层中发现了放射性物质,表明眼部区域已经有BDE-99累积,导致色素沉着的降低[25]。Yoo等[26]的研究结果表明,甲状腺激素通过分泌黑素细胞刺激素(MSH)参与黑色素的合成和色素细胞活力的调节,在控制正常色素的形成中起着重要作用。色素沉着的机理很大程度上取决于甲状腺激素。Dong等[27]使用6-羟基-四溴联苯醚(6-OH-BDE-47)对斑马鱼进行染毒,发现6-OH-BDE-47会诱导Dio3 mRNA表达升高。Wang等[28]的研究结果表明,BDE-47显着增加了Dio1和Dio3的表达,并导致T4和T3的水平降低,表明Dio1和Dio3在BDE-47诱导的甲状腺激素代谢中具有重要作用。在本研究中,BDE-99造成斑马鱼胚胎体内Dio3表达量升高,TT3和TT4含量降低,进而导致BDE-99对机体代谢产生影响,也进一步证实了Dio3与机体代谢之间的联系。
综上所述,室内灰尘中含有BDE-99和BDE-47,而电子产品会产生更多的BDE-99和BDE-47,暴露于BDE-99会造成斑马鱼胚胎中Dio3 mRNA表达量升高,进而使TT3和TT4含量降低,这可能是由于BDE-99对Dio3有诱导作用,影响Dio3活性,从而造成甲状腺功能的调节紊乱,影响机体代谢。
◆

