纳米二氧化钛对小胶质细胞Notch信号通路及炎症因子分泌水平的影响
陶一凡,张小强,李琪,孙腾腾,崔丹丹
环境医学工程教育部重点实验室,东南大学公共卫生学院,南京 210000
纳米二氧化钛颗粒(Nano-titanium dioxide, Nano-TiO2)是介于原子、分子和宏观体系之间的一种新型纳米材料,除了具备TiO2基本的特性外,还具备一些特殊的理化性质,例如,屏蔽紫外线的功能强,分散性和耐候性良好。Nano-TiO2可用于化妆品、功能纤维、塑料、涂料和油漆等产品中,可作为紫外线屏蔽剂,防止紫外线的侵害[1]。近几年来,Nano-TiO2在抗菌食品包装材料[2-4]、食品添加剂[5]等方面的应用日益广泛[6]。在我们日常食物中,如咖啡伴侣、口香糖、巧克力、各类硬糖、软糖和奶制品等中均含有的颗粒大小不等的Nano-TiO2[7]。
随着纳米材料的应用越来越广,人们与其的接触机会也大大增加,其安全性问题也引起了人们的关注。相关体内实验研究表明,Nano-TiO2可能会穿过胎盘屏障而影响胚胎的大脑发育[8];可能会损害神经元或神经胶质细胞的形态和功能,从而导致细胞坏死[9];可以通过血脑屏障进入中枢神经系统,引起神经元损伤、神经炎症反应等[10];会使得血脑屏障的通透性增加,维持血脑屏障的紧密连接蛋白ZO-1和Claudin-5表达受到干扰[11];会影响动物的空间学习能力和记忆能力,导致空间记忆的紊乱,这也意味着Nano-TiO2可能在大脑中积累从而导致神经退行性变[8]。
小胶质细胞在大脑发育早期就已存在,几乎均匀分散在整个中枢神经系统当中。小胶质细胞是中枢神经系统中的巨噬细胞,是人体中枢神经系统中的第一道也是最主要的一道免疫防线[12]。小胶质细胞被认为是最敏感的脑病理传感器,一旦发现脑损伤或神经系统功能障碍的迹象,小胶质细胞将经历一个复杂的、多阶段的激活过程,将其转化为“激活的小胶质细胞”[13]。大量活化的小胶质细胞是中枢神经系统内促炎因子和自由基等神经毒性物质的重要来源[12]。不受控制或过度激活的小胶质细胞可能会产生过多的炎性细胞因子、炎性因子和自由基,从而加剧组织损伤和神经元死亡[14]。Nano-TiO2作为纳米材料中广泛使用的消费品,可以通过各种途径进入体内,穿过血脑屏障进入中枢神经系统中[11],而小胶质细胞作为脑内的免疫细胞,Nano-TiO2对小胶质细胞的毒作用机制一直备受关注[15-16]。
Notch信号通路在进化上高度保守,通过相邻细胞之间的相互作用调节细胞、组织、器官的分化和发育。大量研究表明,Notch信号通路可促进细胞的炎症反应、氧化应激和细胞凋亡,且与免疫调节密切相关[17-19]。本研究使用不同浓度的Nano-TiO2染毒小胶质细胞,进而研究Nano-TiO2对小胶质细胞活性、其细胞膜的完整性及炎症因子的分泌情况的影响,重点探讨了Nano-TiO2对Notch信号通路的激活作用,从而更深一步地揭示Nano-TiO2诱导小胶质细胞炎症反应的分子机制。
1 材料与方法(Materials and methods)
1.1 主要试剂
小胶质细胞(BV2)(中国医学科学院基础医学研究所细胞中心);Nano-TiO2颗粒(德国Degussa公司);DMEM高糖培养基(美国HyClone公司);胎牛血清(美国HyClone公司);四甲基偶氮唑盐(MTT)(德国默克Sigma公司);乳酸脱氢酶(LDH)检测试剂盒(南京建成生物工程研究所);双抗体夹心酶联免疫吸附实验(ELISA)试剂盒(上海酶联生物科技有限公司)。
1.2 主要仪器
马尔文粒径分析仪(Zetasizer Nano-ZS90,英国Malvern公司);酶标分析仪(RT-6000,美国Rayto公司);转印电泳槽(DYCZ-40D,北京六一仪器厂);化学发光成像系统(Tanon 5200,上海天能科技有限公司)。
1.3 实验方法
1.3.1 制备Nano-TiO2染毒悬液
使用电子天平精确称量一定量的Nano-TiO2粉末,加入完全培养基配成的母液。使用前超声震荡,根据实验需要稀释成相应浓度。
1.3.2 细胞培养
将小胶质细胞置于含10%胎牛血清的高糖DMEM中,置于37 ℃、5% CO2条件下培养。培养培养至对数生长期时进行实验。
1.3.3 Nano-TiO2颗粒表征
稀释Nano-TiO2母液,使用马尔文粒度分析仪,通过动态光散射检测Nano-TiO2工作溶液中Nano-TiO2的粒径、多分散系数(PDI)和Zeta电位。
1.3.4 MTT法测定细胞存活率
在小胶质细胞培养至对数生长期后,以1×104个·mL-1的浓度接种到96孔培养板中培养。在细胞贴壁后,将它们分为空白组、对照组和Nano-TiO2处理组,浓度分别为15.0、20.0、30.0、40.0和50.0 μg·mL-1。每组有5个复孔,并继续孵育24 h。向每个孔中添加10.0 μL浓度为5.0 mg·mL-1MTT溶液,并继续在培养箱中培养4 h。每孔中加入150 μL二甲基亚砜(DMSO),置于摇床上震荡,使晶体完全溶解。用酶标仪检测吸光度D(560)值并计算细胞活力。
细胞存活率(%)=[D(560)实验组-D(560)空白组]/[D(560)对照组-D(560)空白组]×100%
1.3.5 细胞培养液上清中LDH活性测定
取置于对数生长期的小胶质细胞,以6×104个·孔-1的浓度接种到24孔培养板中培养。细胞贴壁后,加入含有不同浓度(0、15.0、20.0、30.0和40.0 μg·mL-1)的Nano-TiO2的完全培养基,培养24 h后取上清培养液,离心后取上清。设置标准空白孔,在450 nm处测量光密度值,计算LDH活性,并根据LDH试剂盒说明确定细胞膜完整性。
LDH活性(U·L-1)=[(测定孔OD值-对照组OD值)/(标准孔OD值-空白孔OD值)]×标准品浓度×1000
1.3.6 ELISA法检测IL-1β、IL-6和TNF-α分泌水平
取置于对数生长期的小胶质细胞,以6×104个·孔-1的浓度接种在24孔板中培养。细胞贴壁后,分别添加不同浓度的Nano-TiO2的完全培养基(0、15.0、20.0、30.0和40.0 μg·mL-1)。培养24 h后收集细胞培养上清液,离心20 min并取上清液。根据ELISA试剂盒说明进行实验,在450 nm处测量光密度值。根据标准曲线测定样品中IL-1β、IL-6和TNF-α的分泌水平。
1.3.7 Western Blot法检测Notch信号通路相关蛋白表达水平
将处于对数生长期的小胶质细胞以8×105个·mL-1的浓度接种在6孔板中培养。细胞贴壁后,添加不同浓度Nano-TiO2的完全培养基(0、15.0、20.0、30.0和40.0 μg·mL-1),继续孵育24 h。使用RIPA裂解液裂解细胞并提取蛋白质。在4 ℃、12 000 r·min-1离的条件下离心15 min并取上清液。用BCA蛋白质定量试剂盒确定提取的蛋白浓度后,制胶、上样、电泳、转膜,用5%脱脂奶粉封闭2 h,分别加入一抗Notch-1抗体、Hes-1抗体和β-actin抗体(1∶1 000),4 ℃过夜,洗膜,二抗孵1.5 h后,洗膜并曝光显色。使用Image J(v1.47)软件对蛋白条带灰度值进行分析。
设立对照组(不施加任何处理)、抑制剂对照组、DAPT+Nano-TiO2共同处理组(Nano-TiO2干预前1.5 h加(γ-分泌酶抑制剂(DAPT))、Nano-TiO2处理组(40 μg·mL-1)。采用蛋白质印迹法(Western Blot)分别测定各组Notch-1、Hes-1蛋白表达变化情况,用ELISA法测定各组炎症因子分泌水平。
1.4 统计学分析
实验数据表示为均值±标准差。应用SPSS 24.0软件进行统计学分析,多组之间比较采用单因素方差分析(One-way ANOVA)。两两比较时,若方差齐则采用LSD-t检验,若不齐则用Dunnett’s T3检验。趋势分析采用Spearman相关分析,结果以相关系数(r)表示。检验水准取α=0.05。
2 结果(Results)
2.1 Nano-TiO2的表征
Nano-TiO2的平均水合粒径为(73.55±3.29) nm,Zeta电位为(-5.74±0.63) mV,PDI为0.19±0.1,根据上述结果可知Nano-TiO2的混合分散体系较为稳定。
2.2 细胞活力
如图1所示,与对照组相比,Nano-TiO2浓度为40.0 μg·mL-1和50.0 μg·mL-1时,细胞活力显著降低(P<0.05)。不在同浓度的Nano-TiO2暴露条件下,暴露浓度越高,细胞活性越低(r=-0.745,P<0.05)。
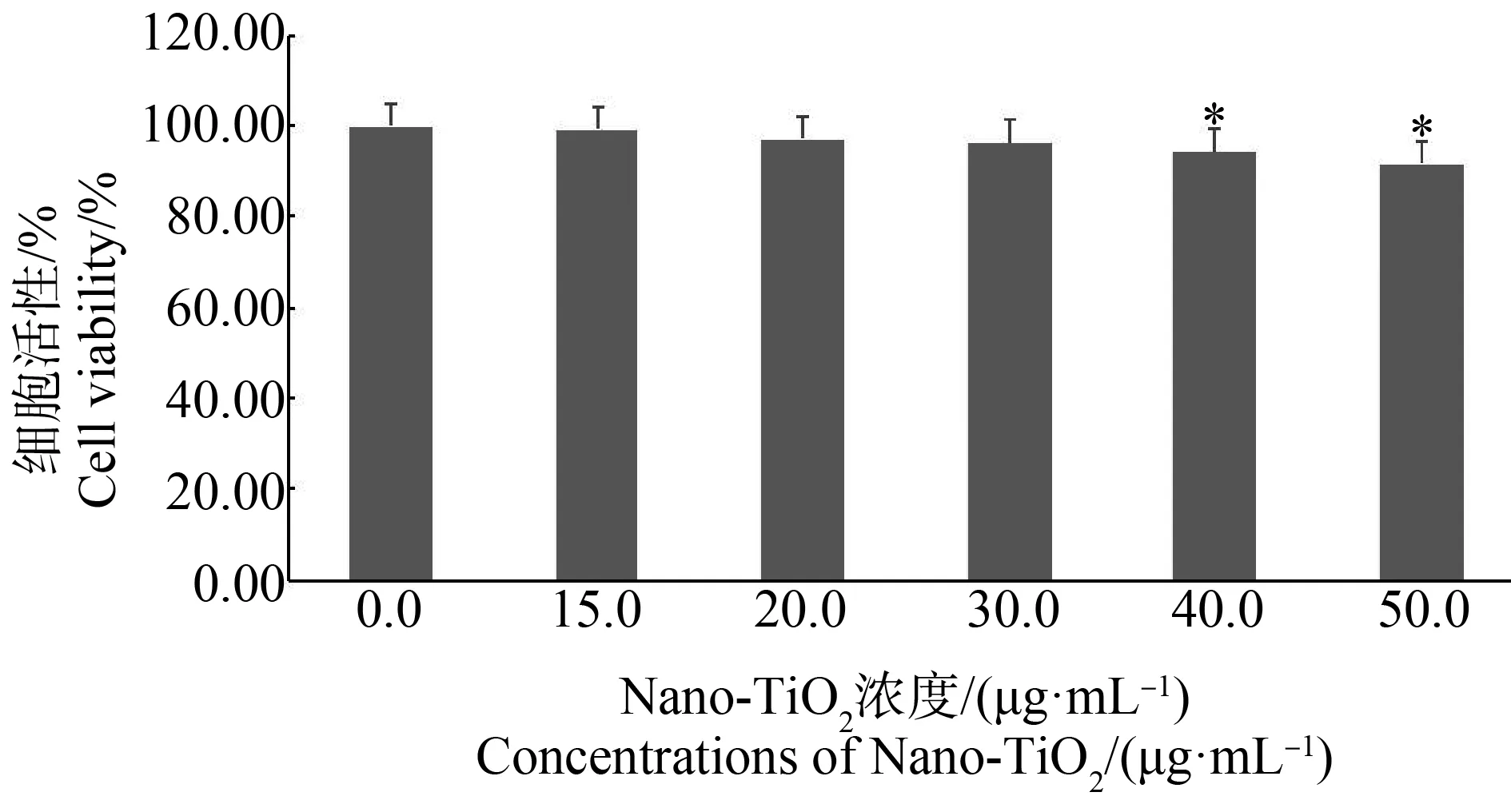
图1 Nano-TiO2对小胶质细胞BV2细胞活力的影响注:*与对照相组比,P<0.05。Fig. 1 Effect of Nano-TiO2 on the cell viability of microglia BV2 cellsNote: *represent P<0.05 compared with the control group.
2.3 LDH活性
如图2所示,与对照组相比,Nano-TiO2在20.0、30.0和40.0 μg·mL-1的浓度时,细胞培养液上清中的LDH活性升高(均P<0.05)。随着Nano-TiO2暴露浓度的增加,细胞培养液上清LDH活性也同时增加(r=0.960,P<0.05)。

图2 不同浓度的Nano-TiO2处理24 h后BV2细胞的LDH活性注:*与对照相组比,P<0.05。Fig. 2 LDH activity of BV2 cells treated with different concentrations of Nano-TiO2 for 24 hNote: *represent P<0.05 compared with the control group.
2.4 TNF-α、IL-1β和IL-6表达水平
如图3所示,与对照组相比,Nano-TiO2在15.0、20.0、30.0和40.0 μg·mL-1的浓度时,细胞上清液中的TNF-α、IL-1β和IL-6分泌水平升高(均P<0.05),剂量-效应关系明显(rTNF-α=0.901,P<0.05;rIL-1β=0.959,P<0.05;rIL-6=0.958,P<0.05)。

图3 不同浓度Nano-TiO2处理24 h后BV2细胞炎症因子分泌水平注:*与对照组相比,P<0.05。Fig. 3 Secretion of inflammatory factors in BV2 cells treated with different concentrations of Nano-TiO2 for 24 hNote: *represent P<0.05 compared with the control group.
2.5 Notch信号通路相关蛋白表达水平
如图4所示,与对照组相比,Nano-TiO2在20.0、30.0和40.0 μg·mL-1的暴露浓度下,Notch-1及Hes-1表达水平升高(P<0.05),且Notch-1及Hes-1蛋白表达水平的改变与Nano-TiO2暴露浓度存在剂量-效应关系(rNotch-1=0.894,P<0.05;rHes-1=0.739,P<0.05)。
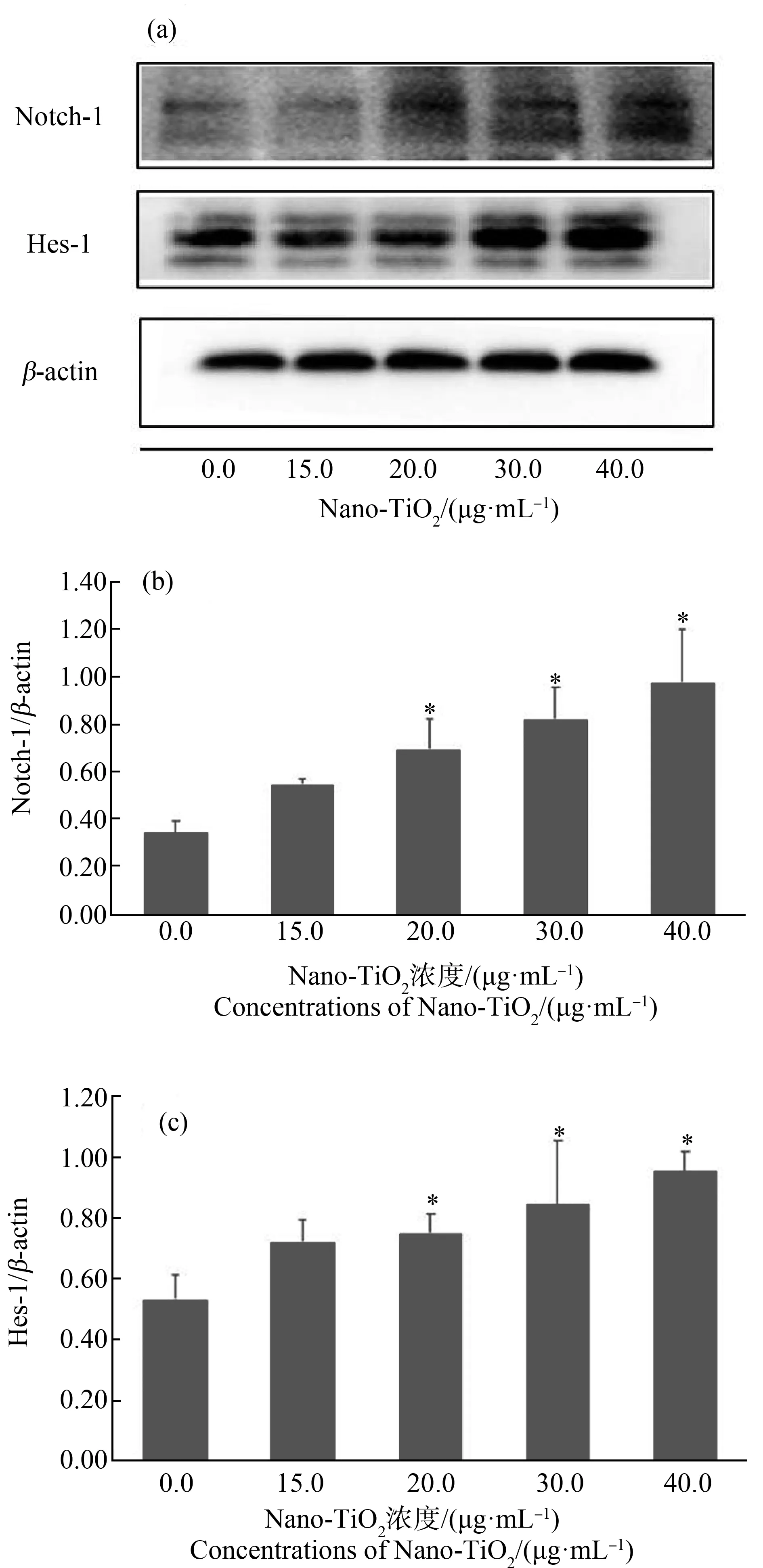
图4 不同浓度Nano-TiO2处理24 h后BV2细胞Notch信号通路相关蛋白表达水平注:*表示与对照组相比,P<0.05;(a),Hes-1、Notch-1蛋白表达(Western Blot法);(b),Notch-1/β-actin灰度值比值;(c),Hes-1/β-actin灰度值比值。Fig. 4 Expression levels of Notch signaling pathway related proteins in BV2 cells treated with different concentrations of Nano-TiO2 for 24 hNote: *represent P<0.05 compared with the control group; (a), Hes-1 and Notch-1 protein expression by Western Blot method; (b), the ratio of Notch-1 to β-actin; (c), the ratio of Hes-1 to β-actin.
2.6 Notch信号通路在Nano-TiO2诱导小胶质细胞产生炎症因子中的作用
如图5所示,在40.0 μg·mL-1Nano-TiO2作用下,Notch-1及Hes-1表达明显增加(P<0.05);加入DAPT后,Notch-1及Hes-1表达水平降低(P<0.05)。与对照组相比,Notch通路抑制剂DAPT(10.0 μmol·L-1)对小胶质细胞TNF-ɑ、IL-6及IL-1β分泌无明显影响。结果表明,DAPT可有效降低TNF-ɑ、IL-6和IL-1β分泌水平(P<0.05)。

图5 γ-分泌酶抑制剂(DAPT)对Nano-TiO2所致Notch信号通路表达及炎症因子分泌的影响注:#表示与对照组相比,P<0.05;*表示与Nano-TiO2暴露组相比,P<0.05;(a),Hes-1、Notch-1蛋白表达(Western Blot法);(b),Notch-1/β-actin灰度值比值;(c),Hes-1/β-actin灰度值比值;(d)~(f),TNF-ɑ、IL-1β和IL-6的分泌水平。 Fig. 5 Effects of γ-secretase inhibitor (DAPT) on the expression of Notch signaling pathway and secretion of inflammatory factors induced by Nano-TiO2Note: # represent P<0.05 compared with the control group; *represent P<0.05 compared with Nano-TiO2 exposure group; (a), Hes-1 and Notch-1 protein expression by Western Blot method; (b), the ratio of Notch-1 to β-actin; (c), the ratio of Hes-1 to β-actin; (d)~(f), the secretion of TNF-α, IL-1β and IL-6.
3 讨论(Discussion)
Nano-TiO2是使用最多的纳米颗粒之一,很多日常生活用品中均有添加。纳米颗粒能够随血液循环进入大脑并穿过血脑屏障,引起血脑屏障损伤、神经炎症反应,从而导致中枢神经系统受损[8-9]。Wang等[17]研究发现,通过检测小胶质细胞的Notch通路的相关效应因子,通过干预Notch信号途径,导致小胶质细胞分泌炎性因子发生改变并且其吞噬作用增强,证明了Notch信号系统对于小胶质细胞的炎性表达有重要调节作用。但目前关Nano-TiO2能否通过激活小胶质细胞里的Notch信号通路,进而导致细胞炎症反应增强的相关研究报道较少。因此本研究采用小胶质细胞暴露于Nano-TiO2颗粒,探讨Nano-TiO2对Notch信号通路的影响,判断Notch信号通路在Nano-TiO2导致小胶质细胞炎症反应水平改变中的作用。
本研究结果表明,小胶质细胞暴露于Nano-TiO2导致细胞活力下降,并存在剂量-效应关系,本研究MTT实验的细胞染毒剂量为15.0、20.0、30.0、40.0和50.0 μg·mL-1,当暴露剂量为50.0 μg·mL-1时,细胞活力明显下降,出现明显的细胞毒性,所以本研究后续实验的细胞染毒剂量为15.0、20.0、30.0和40.0 μg·mL-1Nano-TiO2。
在不同浓度Nano-TiO2暴露条件下,细胞培养液上清LDH活性随Nano-TiO2浓度增加而增加,这说明Nano-TiO2在一定浓度条件下可以对小胶质细胞膜的完整性造成一定程度的破坏。这些结果与Rihane等[15]的研究报道一致。并且其他体内研究也表明,实验动物通过各种给药途径接受Nano-TiO2后,主要器官中Nano-TiO2颗粒的含量增加,进而诱发氧化应激和器官功能障碍[20]。通过饮用水暴露于Nano-TiO2的小鼠肝脏中的8-羟基脱氧鸟嘌呤水平升高,DNA受损[21]。通过管饲法将小鼠暴露于Nano-TiO2后,肝脏、肾脏、脑皮质和海马中的Nano-TiO2含量升高。本研究结果显示,Nano-TiO2浓度为15.0、20.0、30.0和40.0 μg·mL-1,小胶质细胞TNF-α、IL-1β和IL-6表达水平均升高,具有明显的剂量-效应关系,且较低浓度的Nano-TiO2(15 μg·mL-1和20 μg·mL-1)就能刺激小胶质细胞分泌相关炎症因子。Nano-TiO2刺激了小胶质细胞,使其炎症因子分泌增加,使得细胞生存环境恶化,造成细胞自身的持续激活,炎症因子持续释放,进而导致神经炎症及神经元损伤,造成神经毒性结局[22]。
Notch信号通路是参与调节炎症反应通路的重要通路之一。有研究发现,IL-6、TNF-α和IL-1β等炎症因子的表达与Notch信号通路的表达呈正相关[18-19,23]。本研究中,Notch信号通路相关蛋白表达的结果表明,Nano-TiO2暴露引起小胶质细胞中Notch-1和Hes-1表达水平增加,由此说明Nano-TiO2可激活小胶质细胞中Notch信号通路;在Nano-TiO2暴露组中加入Notch信号通路抑制剂DAPT后发现,相较于未加抑制剂的Nano-TiO2暴露组,炎症因子TNF-α、IL-1β、IL-6分泌水平下降,由此可知,Notch 信号通路的激活会促进炎症因子的分泌。有研究表明[18],经脂多糖(LPS)诱导活化后的小胶质细胞大量释放IL-12、TNF-α和iNOS等炎症介质,用DAPT阻断Notch信号通路后,M1型小胶质细胞释放炎症介质减少并向M2型小胶质细胞演变,同时M2型细胞释放抑炎因子IL-10,这提示Notch信号通路参与小胶质细胞炎症的发生发展,这与本研究结果一致。由此我们推断,Notch信号通路与小胶质细胞内炎症因子的分泌有着相关性,Nano-TiO2颗粒可以使小胶质细胞内的Notch信号通路表达增强并促使炎症因子释放增加,Notch信号通路表达增强对小胶质细胞炎症因子分泌水平起到重要作用。
◆

