天津市中心城区集中供应管网末梢水的抗生素耐药基因污染特征研究
梁永兵,李海北,程春燕,师丹阳,陈郑珊,杨栋,孙栋良,邵一帆,李君文,金敏
军事科学院军事医学研究院环境医学与作业医学研究所,天津市环境与食品安全风险监控技术重点实验室,天津 300050
抗生素在治疗人类传染病方面做出了巨大贡献,同时也在农业和畜牧业中应用广泛[1-2],但随之而来的抗生素耐药性问题也越来越严重。世界卫生组织公布了2019年全球健康面临的最大威胁清单,细菌抗生素耐药问题位列第五,而抗生素耐药基因(antibiotic resistance genes, ARGs)作为细菌产生抗生素耐药性的重要遗传基础,已被定义为一种新型环境污染物并对人类健康产生严重威胁[3]。尤其近几年来,随着耐万古霉素肠球菌等超级耐药细菌(super antibiotic resistance bacteria, SARB)不断涌现,其超级耐药基因(super antibiotic resistance genes, SARGs)如blaNDM-1和mcr-1在水中的污染也不容小觑。Khan等[4]在印度和巴基斯坦管网末梢水细菌中发现耐碳青霉烯类基因blaNDM-1,而在中国和美国等水样中检测出耐多粘菌素类基因mcr-1,且该基因能够通过饮用水污染途径定植到小鼠肠道菌群;曹振华等[5]也在南京地区自来水厂出水细菌中检出mcr-1和blaNDM-1。
自然环境中的SARGs主要有细胞内SARGs(intracellular SARGs, iSARGs)与细胞外SARGs(extracellular SARGs, eSARGs)2种存在形式。其中,iSARGs位于细菌内部,可通过基因垂直传播或接合转移、转导等水平转移方式传播抗生素耐药性,而eSARGs独立存在于环境中,是由菌体分泌或者死亡裂解后释放到外部环境中的游离DNA,具有水平转移及转化的风险[6],如Jin等[7]发现,消毒过程中死亡的细菌释放的游离ARGs可转化消毒损伤细菌,从而促进细菌间ARGs的传播与扩散。因此,不管iSARGs还是eSARG,均对水中SARB的传播与扩散具有重要作用,而生活饮用水中iSARGs和eSARG污染,均可能对人类健康造成风险。2019年,我们首次报告管网末梢水除了存在sul1和sul2等胞内ARGs(intracellular ARGs, iARGs)外,还有相关胞外ARGs(extracellular ARGs, eARGs)污染[8],然而,截止目前,还未见管网末梢水中有关eSARGs的污染特征研究。
基于此,本文以天津市中心城区的集中供应管网末梢水为研究对象,通过分析包括blaNDM-1、mcr-1、blaKPC和vanA等SARGs在内的15种ARGs的污染现状,阐明天津市集中供应管网末梢水的ARGs污染特征。本研究将为今后生活饮用水ARGs的风险评估及其控制奠定基础,也为今后能将ARGs监测措施和风险管理策略纳入公共卫生决策系统提供理论依据。
1 材料与方法(Materials and methods)
1.1 主要仪器与试剂
DN-ZY正压过滤器(海宁市能大过滤设备有限公司),BT100-2J蠕动泵(保定兰格恒流泵有限公司),2-16KL台式高速冷冻离心机(德国Sigma公司),ViiA 7Dx荧光定量PCR仪(美国ABI公司),2100P便携式浊度分析仪(美国Hach公司),HQ40d便携式测定仪(美国Hach公司),DR1900便携式分光光度计(美国Hach公司),HH.Bll-500BS型恒温培养箱(天津市天宇实验仪器有限公司);水相微孔过滤膜(北京市北化黎明膜分离技术有限责任公司),SYBR Green荧光定量PCR试剂盒(瑞士Roche公司),Fast DNA Spin Kit for Soil(美国MP Bio公司),DNA纯化试剂盒(天根生化科技(北京)有限公司);营养琼脂培养基、m-Endo培养基、MFC培养基和MUG琼脂培养基等购自北京陆桥技术有限责任公司。
1.2 水样采集
根据天津中心城区的6个行政区域分布,从各区域中随机选取一个采样点进行管网末梢水样采集(图1),水样采集体积为20 L,采样时间为2020年5月,每个采样点采集3次。水样采集后,冷藏条件下迅速运回实验室开展实验。
图1 天津市中心城区采样点分布图注:采样时间及地点如下,采样点① 2020年5月6、13和20日8:00—10:00,天津市和平区大理道;采样点② 2020年5月6、13和20日10:00—12:00,天津市河西区乐园道;采样点③ 2020年5月6、13和20日14:00—16:00,天津市河东区成林道;采样点④ 2020年5月8、15和22日8:00—10:00,天津市河北区黄纬路;采样点⑤ 2020年5月8、15和22日10:00—12:00,天津市红桥区芥园道;采样点⑥ 2020年5月8、15和22日14:00—16:00,天津市南开区水上公园东路。Fig. 1 Sampling sites of Tianjin city centerNote: Sampling time and location were as follows: Sampling site ① 8:00—10:00 on May 6th, 13th and 20th, 2020, Dali Road, Heping District, Tianjin; Sampling site ② 10:00—12:00 on May 6th, 13th and 20th, 2020, Leyuan Road, Hexi District, Tianjin; Sampling site ③ 14:00—16:00 on May 6th, 13th and 20th, 2020, Chenglin Road, Hedong District, Tianjin; Sampling site ④ 8:00—10:00 on May 8th, 15th and 22nd, 2020, Huangwei Road, Hebei District, Tianjin; Sampling site ⑤ 10:00—12:00 on May 8th, 15th and 22nd, 2020, Jieyuan Road, Hongqiao District, Tianjin; Sampling site ⑥ 14:00—16:00 on May 8th, 15th and 22nd, 2020, Water Park East Road, Nankai District, Tianjin.
1.3 水质理化及微生物指标的检测
参照《生活饮用水标准》(GB/T 5749—2006)[9]和《生活饮用水标准检验方法 微生物指标》(GB/T 5750.12—2006)[10]对自来水的理化及微生物指标进行检测。浊度采用便携式浊度分析仪测定;pH值和电导率由HQ40d便携式测定仪测定;余氯和氨氮采用DR1900便携式分光光度计测定;高锰酸钾指数利用DRB200型数字反应器(美国Hach公司)和DR1900便携式分光光度计检测。菌落总数、总大肠菌群、耐热大肠菌群和大肠埃希氏菌分别利用营养琼脂、m-Endo培养基、MFC培养基和MUG琼脂培养基进行细菌培养和计数。每组做3个平行实验。
1.4 细菌的富集及iARGs的提取
细菌的富集及iARGs的提取方法参照文献[11],在正压过滤器中装入孔径0.22 μm的滤膜,利用蠕动泵将20 L水匀速(50 mL·min-1)通过过滤器后,将滤膜取出剪碎,并用100 mL的3%牛肉膏洗脱液浸泡,置于磁力搅拌器中搅拌30 min(4 ℃)后,将细菌悬液收集到50 mL的离心管中;离心(8 000 r·min-1,10 min,4 ℃),弃上清;向沉淀中加入10 mL磷酸盐缓冲溶液(PBS)缓冲液重悬,用Fast DNA Spin Kit for Soil提取DNA后,置于-80 ℃保存待测。
1.5 eARGs的富集与纯化
参照文献[6]的方法,制备核酸吸附颗粒并利用核酸吸附-洗脱方法收集胞外游离核酸。以PBR322质粒作为内参(终浓度为20 GC·mL-1),加入到上述过滤后的管网末梢水中,以50 mL·min-1流速通过装有80~90 g核酸吸附颗粒的过滤柱(直径5 cm、高30 cm),用300 mL洗脱液(15 g·L-1氯化钠、30 g·L-1胰蛋白胨、15g·L-1牛肉粉、3.75 g·L-1甘氨酸、0.28 g·L-1氢氧化钠,pH=9.3±0.2)进行洗脱。将收集的洗脱液通过PES微孔膜过滤器(φ 0.22 μm,美国Milipore公司)后,加入同等体积异丙醇,充分混匀,室温静置16 h;离心(10 000 r·min-1,4 ℃)10 min后,弃上清;用体积分数为70%的乙醇水溶液重悬沉淀并离心(10 000 r·min-1,5 min,4 ℃);弃上清后静置数分钟,使乙醇充分挥发;加入1 mL无菌Tris-EDTA缓冲液(pH=8.0)混匀。利用用DNA纯化试剂盒进一步纯化胞外核酸后,置于-80 ℃保存待测。
1.6 ARGs的定量检测
利用荧光定量PCR技术(quantitative real-time polymerase chain reaction, qPCR)检测15种具有代表性的不同类别ARGs(表1),其qPCR反应体系、反应条件及标准曲线的建立参见文献[11]。引物和ARGs标准品由上海生工有限公司合成,每个基因做3次平行检测并设有阴性对照(DEPC水代替样品模板)和阳性对照(相应ARGs标准品代替样品模板)。
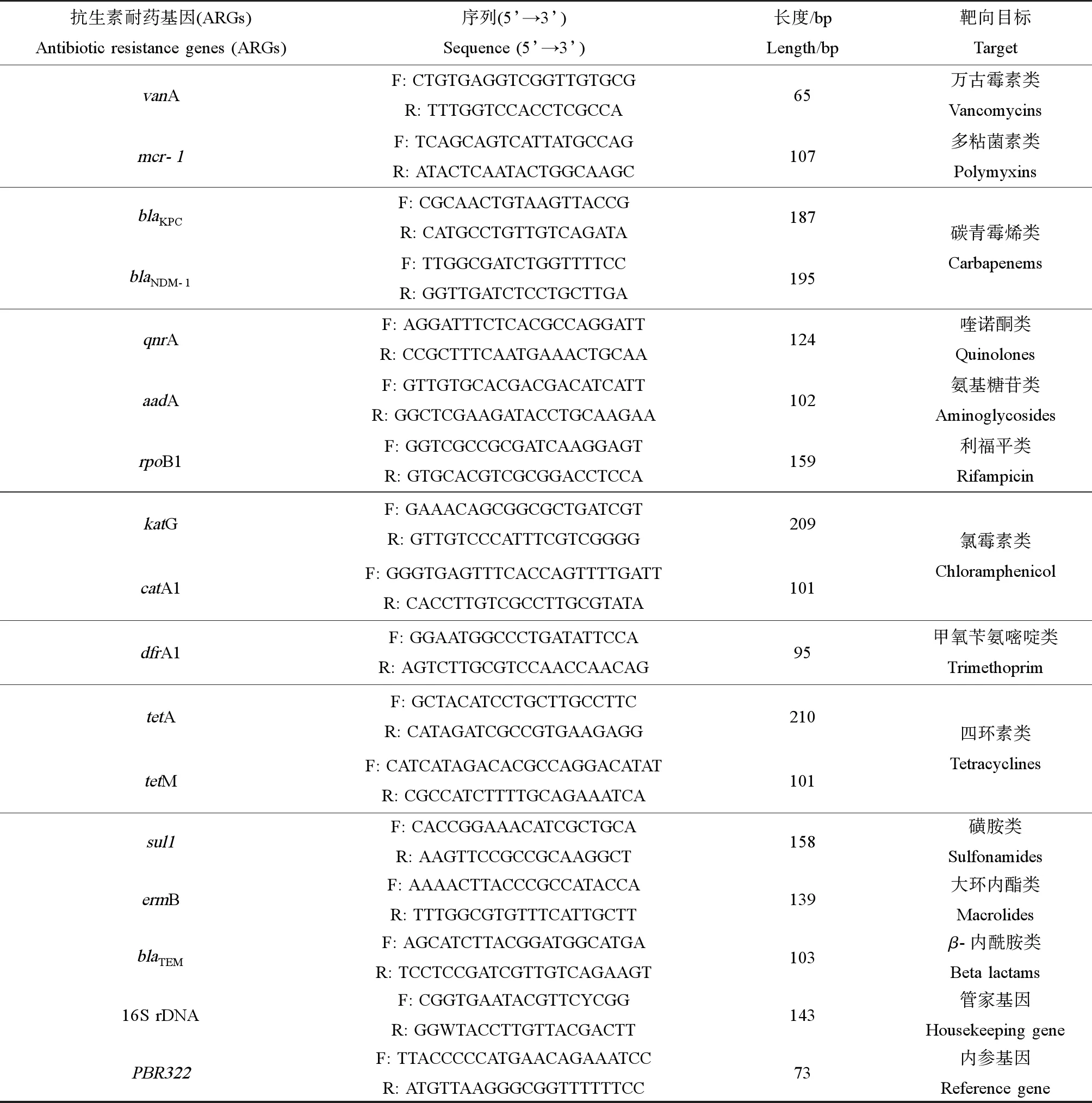
表1 本研究所用引物[11-15]Table 1 The primers used in this study[11-15]
1.7 统计学方法
采用SPSS 18.0软件进行数据统计学分析。其中,数据满足正态性要求的用Paired-Samplet-test检验,数据不满足正态性要求的用Wilcoxon检验,比较多个独立样本的分布差异用Kruskal-Wallis H检验,P<0.05为差异有统计学意义。
2 结果(Results)
2.1 集中供应管网末梢水的水质指标情况
所有待检管网末梢水样的水质指标均符合我国生活饮用水卫生标准(GB/T 5750.12—2006),其中浊度0.1~0.8 NTU、pH 7.8~8.4、余氯0.3~0.7 mg·L-1、电导率278~385 μs·cm-1、氨氮0.35~0.45 mg·L-1、高锰酸盐指数0.50~2.85 mg·L-1、菌落总数均≤1 CFU·mL-1,总大肠菌群、耐热大肠菌群和大肠埃希氏菌均未检出。
2.2 集中供应管网末梢水的ARGs检出频率
在待检的15种ARGs中,除blaKPC未被发现外,其余ARGs均在管网末梢水中检出(表2)。其中,iARGs共检测出13种,且mcr-1、vanA、blaNDM-1、aadA、blaTEM、sul1、tetM、tetA、dfrA1和katG等10种ARGs在所有水样中均被检出,而rpoB1、ermB和catA1只在部分水样中检出,qnrA和blaKPC一直未检出。对于eARGs,共检测出12种,其中,mcr-1、vanA、aadA、blaTEM、sul1、tetM、tetA和dfrA1等8种的检出率为100%,ermB、katG和blaKPC一直未检出,而qnrA、blaNDM-1、rpoB1和catA1等4种ARGs仅在部分水样中检测出。因此,天津市管网末梢水残留细菌的体内外均存在mcr-1、vanA、blaNDM-1、aadA、blaTEM、sul1、tetM、tetA、dfrA1、rpoB1和catA1等11种ARGs污染,其中vanA、mcr-1和blaNDM-1等SARGs尤为值得注意,它们以iARGs和eARGs这2种形态存在于所有水样,另外,ermB和katG仅出现在iARGs中,而qnrA仅出现在eARGs中。
2.3 天津中心城区集中供应管网末梢水的ARGs污染特征
天津市中心城区集中供应管网末梢水的ARGs浓度水平如图2所示,其中,iARGs的相对浓度是水中iARGs的绝对浓度与16S rDNA绝对浓度的比值。由图2可知,aadA、blaTEM和sul1是天津市管网末梢水的主要ARGs,而在SARGs阳性水样中,vanA和mcr-1浓度较高。对于iARGs,aadA相对浓度和绝对浓度均最高(图2(a)~2(b)),平均值分别为0.16 GC·L-1和2.6 ×104GC·L-1;其次为blaTEM和sul1,绝对浓度平均值分别为2.4×104GC·L-1和1.8×104GC·L-1。对于eARGs,aadA绝对浓度同样最高(图2(c)),平均值为7.4×103GC·L-1,其次为blaTEM(平均值6.5×103GC·L-1)以及sul1(平均值4.2×103GC·L-1)。同时,tetM、tetA、dfrA1、vanA和mcr-1也是天津市管网末梢水中含量较高的基因,各基因的胞内浓度平均值为1.9×103~6.9×103GC·L-1,而胞外浓度平均值为2.7×102~1.8×103GC·L-1,以上8种基因总浓度分别占iARGs和eARGs的97.25%和99.18%。
通过对比分析,天津市管网末梢水的iARGs总绝对浓度为eARGs的3.8倍(图2(d))。同时,还发现除了qnrA只在eARGs中被检出外,同一种ARGs的胞内绝对浓度均高于胞外(P<0.05)。如blaNDM-1的胞内绝对浓度平均值为1.2×103GC·L-1,而胞外含量极低,平均值仅为2.0 GC·L-1;mcr-1的胞内绝对浓度平均值为4.2×103GC·L-1,而胞外浓度仅为266 GC·L-1。
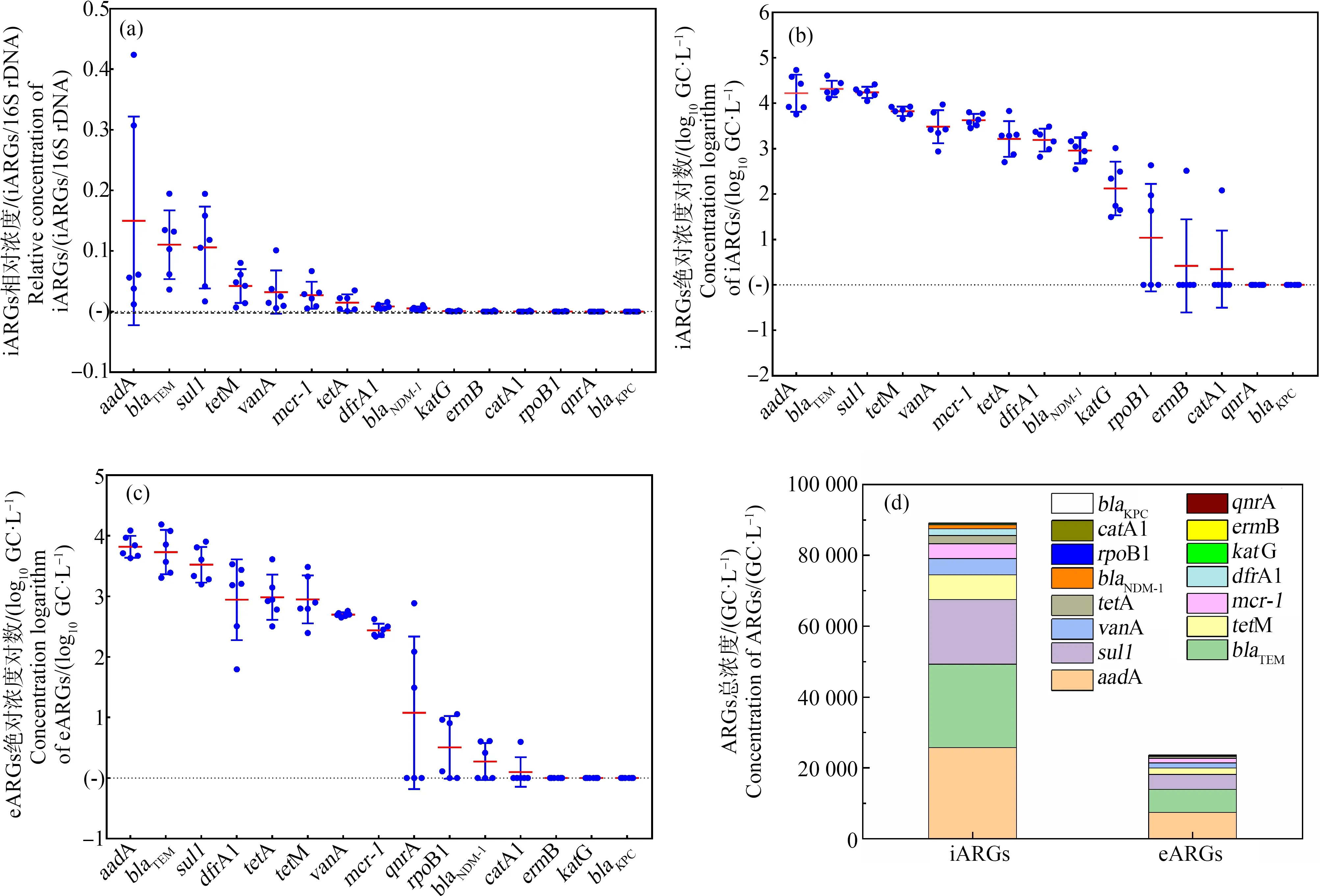
图2 天津市中心城区集中供应管网末梢水的ARGs浓度(n=18)Fig. 2 The concentration of ARGs in the terminal tap water in city center of Tianjin (n=18)
2.4 天津中心城区不同区域集中供应管网末梢水的ARGs污染特征
如图3所示,各区水中iARGs总绝对浓度为5.8×104~1.1×105GC·L-1,且各区之间无统计学差异(P>0.05)(图3(a)),但其相对浓度却有统计学差异(P<0.05)(图3(b)),其中,河西区iARGs相对浓度最高,达到0.99;红桥区最低,河西区为红桥区8倍。同时,不同区域水中检测出的ARGs种类不同。其中,vanA、mcr-1、blaNDM-1、aadA、blaTEM、sul1、tetM、tetA和dfrA1等在各区水样均能检出,rpoB1仅在河东区、河北区和红桥区检出;ermB仅在河北区检出;catA1仅在河西区检出。
对于eARGs,各区总绝对浓度为9.9×103~3.6×104GC·L-1,且各区之间无统计学差异(P>0.05)(图3(c)),但不同区域的ARGs种类不尽相同。aadA、blaTEM、sul1、tetM、mcr-1、vanA、tetA和dfrA1等在各区水样均能检出,而qnrA在和平区、河西区和河东区检出;blaNDM-1在和平区、河西区和河北区检出;rpoB1在和平区、河西区和河东区检出;catA1仅在河东区检出。
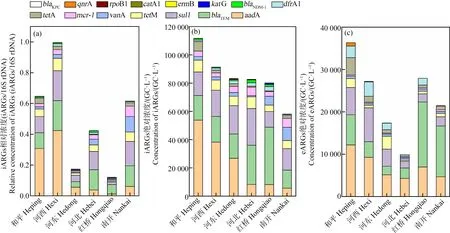
图3 天津市中心城区不同区域集中供应管网末梢水的ARGs浓度(n=3)Fig. 3 The concentration of ARGs in the terminal tap water in various districts of city center of Tianjin (n=3)
3 讨论(Discussion)
管网末梢水存在iARGs的污染,其原因可能有以下几点。(1)水源水本身普遍存在ARGs污染。天津城市供水主要靠引江水和滦水[16]。Zhang等[17]对15种抗生素及5种ARGs进行检测,在长江采集的所有水样中均检出。王若楠等[18]从长江水分离出mcr-1携带菌,且其耐多粘菌素的半抑制浓度较高。水源水ARGs污染会增加其在管网末梢造成污染的风险[19]。(2)自来水存在的抗生素污染促进了细菌产生抗生素耐药性。张新波等[20]对天津市供水系统抗生素分布特征进行研究,发现无论是自来水厂出水还是管网末梢水,都普遍存在6类10种抗生素的污染。(3)自来水厂处理工艺会导致ARGs富集。天津市自来水厂主要采用氯化消毒,而越来越多的研究表明,氯化消毒在一定条件下加剧ARGs污染,如Shi等[21]发现氯化消毒后,水中β-内酰胺类和四环素类等ARGs相对浓度上升,Jin等[7]报道,氯化消毒可以通过促进质粒自然转化而加强ARGs跨细菌种属传播。(4)细菌消毒剂抗性/抗生素耐药性的共选择作用。侯爱明等[22-23]从氯消毒饮用水系统中收集了150株耐氯存活细菌,发现80%氯损伤非苛养细菌对抗生素具有多重耐药性,其机制可能与细胞膜药物外排泵表达升高有关。(5)供水管网生物膜对ARGs的富集。生物膜细菌通常会分泌大量聚合物,使管网末梢水中的微生物富集,形成三维网状结构,在共同抵御不良外界环境的同时更加大了ARGs水平转移的风险[24]。(6)管网新旧、采样点与水厂距离等原因也会导致不同区域管网末梢水ARGs污染程度不同[25-26]。
同时,在本研究中,我们发现管网末梢水普遍存在eARGs污染。eARGs是耐药菌活体分泌或死后释放的一种污染物,它们可通过自然转化和转导的方式传递抗生素耐药性,且不需要活体供体细胞[27]。同时,消除这些eARGs比杀死抗生素耐药菌困难得多[28]。如Roller等[29]报道,即使被二氧化氯灭活了流感嗜血杆菌(灭活率为6个对数),细胞内DNA仍是完整的胶状。Jin等[7]发现,尽管耐药菌在氯化作用后已经有效死亡,但它们释放的eARGs仍保留生物学活性并可通过转化进入其他细菌,而且,只有在超高剂量消毒剂使用情况下才能使之完全降解。鉴于eARGs易传播和难降解的特点,管网末梢水中的eARGs污染不容忽视。
值得关注的是,本研究还发现管网末梢水中存在iARGs和eARGs这2种形态的vanA、mcr-1和blaNDM-1等SARGs。vanA是耐万古霉素的ARGs,同时还可使细菌对环丙沙星、左氧氟沙星、莫西沙星、青霉素和替考拉宁耐药性[30],这是较早发现的多重耐药SARGs。mcr-1和blaNDM-1是近年来发现的新型ARGs,前者具有被称为抵御细菌耐药性“最后一道防线”的多黏菌素类抗生素的耐药能力,后者可使细菌表达β-内酰胺类抗生素水解酶,对除多黏菌素外的所有抗生素均有耐药性[5],故携带mcr-1和blaNDM-1的耐药菌往往无药可治。研究表明,SARGs能够通过饮用水污染途径定植到小鼠肠道菌群[4],再加上SARGs兼具易传播、难降解和多重耐药的特点,水中SARGs污染将对人类健康产生潜在威胁,因此,管网末梢水中SARGs带来的健康风险及公共卫生危害应当引起我们的关注与重视,这也对提高国家饮用水标准、改进自来水厂处理工艺带来了挑战。
◆

