拉曼光谱技术检测川芎嗪对视网膜色素上皮细胞氧化应激损伤的保护作用
谢婷,陈阳,陈文奕,赖巧玲,曹改改,许云超,黄焱
1.福建医科大学医学技术与工程学院眼视光学系,福建福州350004;2.福建医科大学医学技术与工程学院医学检验学系,福建福州350004;3.福建师范大学医学光电科学与技术教育部重点实验室,福建福州350004
前言
视网膜色素上皮(Retinal Pigment Epithelium,RPE)细胞是血‐视网膜屏障的重要组成部分,具有参与视循环代谢,不断吞噬视网膜光感受器外节段,维持视功能和视网膜结构发育等重要作用。RPE 细胞耗氧量高,多不饱和脂肪酸比例高。作为视网膜大量代谢产物跨膜运输的重要通道,为了使光感受器能顺利地将光刺激传递给双极细胞,RPE需持续不断地将光感受器无法转化的全反式视黄醇处理、加工为11‐顺式视黄醛后再转运给光感受器,这一过程进一步增加了RPE 细胞内活性氧自由基(Reactive Oxygen Species,ROS)的清除负担[1]。当RPE 细胞内ROS 生成和清除机制不平衡时,ROS 所诱导的氧化应激损伤将导致RPE 细胞变性,致发光受体死亡,最终造成视力丧失[2]。近年来研究表明,中药川芎的有效成分川芎嗪具有扩张血管、改善微循环、减少氧自由基损伤、抗氧化等作用[3],但其对RPE 细胞的保护作用尚不清楚。到目前为止,虽然许多技术已被证实可用于检测和分析细胞与其环境之间的体外相互作用,例如流式细胞仪技术、四甲基偶氮唑盐微量酶反应比色法、电子显微镜技术,但这些传统技术无法准确描述细胞在自然状态下与药物的相互作用与结合位点。基于非弹性散射的拉曼光谱是检测活细胞的理想光学平台[4]。它能根据来自蛋白质、核酸、脂类、碳水化合物和无机晶体的特定信号来评估生物样品的整体分子组成。此外,拉曼光谱作为一种先进的指纹分析工具,可在单细胞水平监测RPE 细胞的氧化损伤,并从分子水平评估抗氧化损伤药物的保护效果。本课题组先前采用实验室自建的显微拉曼系统结合激光光镊对RPE细胞进行过光谱采集[5]。虽然光镊所形成的三维光学势阱能够无损伤地囚禁和操纵悬浮在液体中的单个活细胞并实现生化动力学过程的实时跟踪,但该自建系统的光谱分辨率为4~5 个波数,分辨率较低,活体临床检测可行性低。故在先前研究的基础上,本文利用更高分辨率显微拉曼系统对先前的实验进行补充,重新采集并分析3组细胞的拉曼光谱,评估川芎嗪对过氧化氢所诱导的RPE 细胞氧化损伤的保护作用,进一步探索川芎嗪抗氧化的作用机制,为相关临床研究提供重要的理论依据。
1 材料和方法
1.1 细胞培养和处理
人RPE细胞(ARPE‐19)(Jennio Biotech,中国)采用含有10%胎牛血清(Hyclone, GE Lifescience, 美国)、1%青霉素及1%链霉素的改良伊格尔培养基(Dulbecco Modified Eagle Medium,DMEM),于37oC、5%CO2保温箱中培养。取处于对数生长期的细胞接种于9 个直径9 mm 的培养皿中,并将其分为3 组(每组3 皿),分别为对照(NC)组、氧化应激(OS)组和保护(LP)组。为了建立合理的氧化应激模型,当细胞约50%汇合后,更换培养液,除NC组外,OS组、LP组均添加终浓度为200 μmol/mL 的H2O2,孵育24 h 后LP 组细胞加入200 μmol/mL 的川芎嗪(Sigma‐Aldrich,美国),再培养24 h后用磷酸缓冲盐(PBS)缓冲液洗涤2 次,以消除培养基影响,最后用胰酶将细胞消化下来以进行后续的实验。
1.2 细胞活力测定
采用MultiskanGO(Thermo,USA)微板法测定细胞内ROS的含量,选择5个浓度梯度的细胞悬液作为筛选的最佳浓度,取1 mL每皿消化下来的细胞悬液,利用细胞计数法将细胞密度稀释至3~5×104/mL 后,吸取100 μL/孔已经稀释的细胞悬液于96 孔板中培养,每皿3个复孔。孵育24 h后,去培养基,用PBS缓冲液洗涤2 次,最后按体积比10:1 加入新鲜培养基和CCK‐8 试剂(Beyotime Biotech, 中国)。CCK‐8 培养2 h 后,将处理好的细胞样品置于96 孔板上,在450 nm 波长下测量可间接反映活细胞数量的吸光度和光密度值。
1.3 细胞活性氧测定
2’,7’‐二氯荧光素二乙酸(DCFH‐DA)是一种非极性燃料,在细胞内活性氧和其他氧化物的作用下可转化为高荧光的2’,7’‐二氯荧光素(DCF)。将每组的RPE 细胞与5µmol/L DCFH‐DA 在37 ℃避光条件下孵育30 min 后,加入PBS 缓冲液2 mL 洗涤2 次后,更换新的DMEM 培养基。最后使用荧光显微镜(IX71,Olympus,日本)测量荧光强度。
1.4 拉曼光谱测定及数据处理
本研究采用InVia 微拉曼系统(Renishaw Corporation, England)对目的细胞进行拉曼光谱采集。以20 mW 功率下产生782 nm 波长的多元件高功率二极管作为激励源,记录范围为400~1 800 cm‐1,每个细胞标本扫描累积时间为20 s,分辨率为1 cm‐1。为了保证单细胞的最佳定位,先用20 倍的物镜对细胞进行聚焦,随后再小心地切换到50 倍的物镜。整个扫描过程聚焦到细胞样品的激发光束直径约5 μm,小于细胞直径。为了确保聚焦区域完全覆盖细胞,在每个细胞的3 个不同点处均采集光谱。实验中对每个细胞样品所测得的3 条光谱先进行荧光背景去除,再将其分别取平均,归一化处理之后用于代表不同组别样品。
采集结束后采用SPSS statistics 20(IBM Inc.,芝加哥)软件对3 组RPE 细胞的拉曼光谱进行数据处理。整个过程主要分为以下两个步骤:首先考虑到重复实验时微拉曼系统的状态可能不同,先将所得的光谱根据曲线下面积进行归一化,以消除系统本身的影响;再将每组细胞的全光谱作为数据源,应用决策树(Decision Tree, DT)和主成分分析法(Principle Component Analysis,PCA)进行数据分析。本研究所使用的DT 模型是基于SPSS 软件的分类与回归树(Classification and Regression Tree, CART)算法。CART 分析主要包括3 个重要部分:(1)特征选择。本文采用基尼指数来测定纯度指数,基尼系数越低,纯度越高。(2)利用二进制拆分过程构建最大树,尽可能多地描述训练数据集。(3)树的修剪。决策树的过度生长可能会导致过拟合,因此需要对拟合模型进行修剪,并通过交叉验证来选出最优树。最终利用PCA进行特征峰的识别[6]。
2 结果与讨论
2.1 川芎嗪可逆转氧化应激所导致的细胞损伤
利用荧光显微镜通过测量DCFH‐DA 荧光探针的氧化产物DCF的荧光强度来测定细胞内ROS的累积量(图1)。如图1b 所示,OS 组的DCF 产物明显多于NC 组和LP 组。通过比较LP 组与NC 组光密度值,还发现川芎嗪可抑制氧化应激环境下RPE 细胞ROS 的产生。不仅如此,细胞活性检测发现OS 组的细胞存活率约为NC 组的(70.7±0.84)%。川芎嗪的干预使得LP 组细胞的存活率上升至NC 组的(83.5±0.31)%。但ROS抑制RPE细胞增殖活性的作用机制以及川芎嗪抗氧化作用位点尚不清楚,需要借助拉曼光谱技术来进一步探索。
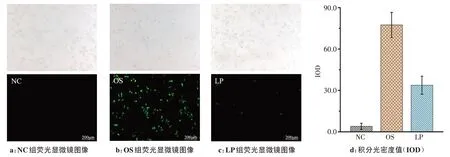
图1 RPE细胞中活性氧自由基水平的示意图Fig.1 Representative diagrams of reactive oxide species(ROS)levels in retinal pigment epithelium(RPE)cells
2.2 3组细胞平均拉曼光谱的外形比较
本研究共获得3组细胞拉曼光谱共50例,其中NC组细胞特征光谱15例、OS组特征光谱15例、LP组特征光谱20例。3组细胞拉曼光谱峰位归属及分子结构见表1。在400~1 800 cm‐1范围内可见不同组细胞拉曼光谱呈现多个谱峰,且形态相近。为了更直观地测定氧化损伤RPE细胞与正常RPE细胞之间的光谱差异,将3组细胞平均光谱进行两两对比,最终所获得差异性光谱显示,不同组细胞间的拉曼光谱存在一定差异(图2)。在量化每个光谱波段的强度值变化后,不同的光谱区域呈现出不同的变化趋势。例如,H2O2干预后,750~1 000 cm‐1和1 325~1 410 cm‐1区域的峰值强度呈负向变化趋势,而1 000~1 140 cm‐1和1 430~1 490 cm‐1区域的峰值强度则呈正向变化趋势(图2b)。
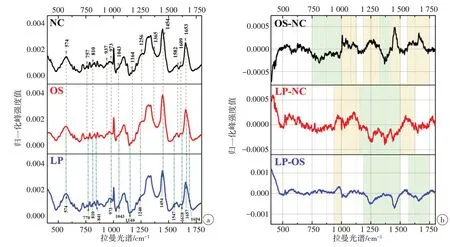
图2 归一化的平均拉曼光谱和差异光谱Fig.2 Normalized mean Raman spectra and difference spectra
2.3 RPE细胞拉曼光谱的多元统计学分析
应用PCA对所获得的拉曼光谱数据进行PCA变换,发现前9 个主成分可表达98%的原始信息,且由于主成分1(PC1)和主成分2(PC2)的特征方差贡献率最大,最终选择用前两个主成分的载荷图及得分散点图来代表原始数据的光谱信息(图3)。图3a 和3b 所示的PC1 和PC2 载荷图,包含了用于计算类别区分的频谱特征信息。图3e 为3 组细胞拉曼光谱主成分分析后得到的聚类散点图。虽然不同组与其他组均存在部分重叠,但仍可明确不同组之间确已存在分离趋势(如图中箭头所示)。不仅如此,图3c 和图3d 中PC1 及PC2 的得分箱式图也证实了OS 组、NC 组和LP 组之间的差异性,OS 组PC1 与PC2 得分值与NC 组及LP 组相比,差异均具有统计学意义(P<0.05)。每张拉曼光谱1 492 个数据点中可提取出57个主成分,将不同组提取出的主成分通过两两比较来建立决策树模型,并采用交叉验证方法对鉴别模型进行检验。基于CRT 算法的决策树模型的原理是通过确定一系列if‐then 逻辑关系,形成一组层次规则,用树图表示所有可能结果的概率分布,从而达到对研究对象进行准确预测或正确分类的目的[7]。在交叉验证过程中,所构建的决策树能量化每条光谱谱带的重要性,以确定每个模型中最重要的预测因子。表2总结了各鉴别模型的准确率,结果显示每个模型的分类准确率都在90%以上,甚至有一半以上模型的分类准确率达到100%,表明此鉴别模型预测能力良好,即使是轻微的光谱差异都能被正确分类。
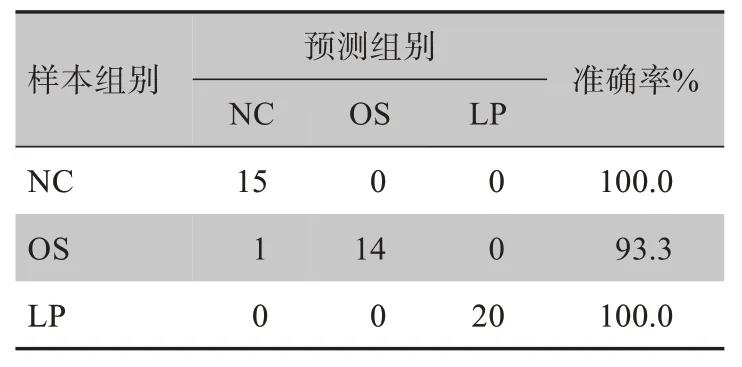
表2 3组细胞分类模型的混淆矩阵Tab.2 Confusion matrix for the classification model of 3 groups of RPE cells

图3 前两个主成分的得分图Fig.3 Score plots of the first two principal components
基于峰位归属的相似性、化学键(振动模式的差异)或生物功能,对同一类别的谱带进行配对。最终根据不同组细胞间谱带强度的变化及其所属的基团和化学键,来进一步探索视网膜氧化应激潜在的生物标志物。拉曼光谱的峰强度比作为一种有效的方法已应用于许多生物样品拉曼光谱数据的分析中[8]。首先将OS 组和LP 组全拉曼光谱的峰强度值分别与NC 组相比,再从所得到的比值中挑选出几条相对强度差异最突出的谱带(图4)。
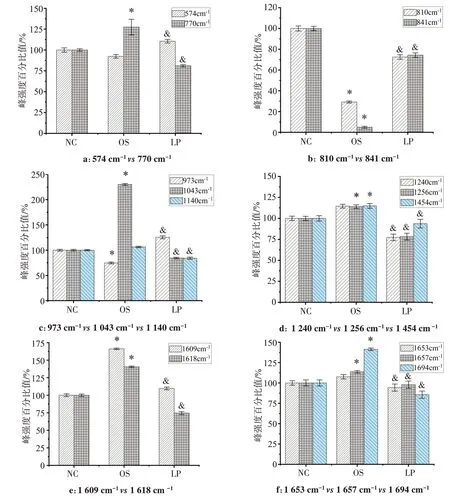
图4 拉曼光谱的峰强度比值Fig.4 Peak intensity ratios of Raman spectra
对比OS 组与NC 组,发现虽然两组之间的拉曼光谱显著差异在DNA、蛋白质和脂质类型的分子中都有涉及,但主要集中在蛋白质分子上。视网膜氧化应激生物标志物及年龄相关性黄斑变性代谢组学特征的相关研究表明[9‐10],脂质和氨基酸含量和结构的变化确实与氧化应激所引起的眼底病变密切相关。结合图4证明氧化应激位点主要位于某些氨基酸和脂类中。有证据表明,ROS 在细胞生长、分化、凋亡、基因表达等重要信号通路中起重要作用[11]。
过氧化氢所诱导产生的RPE 细胞的抗氧化防御机制失代偿主要表现在氨基酸谱带峰强度比的变化上。例如,加入过氧化氢干预后,归属于各氨基酸的770、1 043、1 256、1 609、1 618、1 694 cm‐1谱带的峰强度明显增强。尤其是归属于脯氨酸及谷氨酸的1 043 cm‐1谱带,其峰强度增幅达到125%。该实验结果证实了氧化应激反应影响了酪氨酸、苯丙氨酸、脯氨酸和色氨酸等氨基酸的“C=C”振动模式。黑色素是RPE细胞中重要的抗氧化成分,且黑色素的合成需要黑色素细胞利用苯丙氨酸、色氨酸、酪氨酸等物质进行合成。此外,脯氨酸在RPE 代谢中的重要性也已得到了证实[12‐14]。一旦脯氨酸分解代谢遇到异常,RPE 细胞的葡萄糖代谢和谷胱甘肽的产生就受到影响,最终使RPE 细胞的抗氧化能力受到损害。因此,我们推测H2O2所产生的大量ROS改变了氨基酸的含量和结构,影响氨基酸的代谢,最终阻断抗氧化物质的产生、能量代谢和蛋白质合成。不仅如此,H2O2诱导的氧化应激反应也对脂质产生影响,如归属于磷酸二酯的810 cm‐1谱带和归属于甘油三亚油酸酯的840 cm‐1谱带,两者的峰强度在ROS 的作用下呈显著下降趋势,且降幅超过70%。此现象证实H2O2的干预使细胞内脂质氧化反应和氧自由基反应失衡。但抗氧化剂川芎嗪的加入不仅逆转了归属于脂质的810 和840 cm‐1谱带峰强度比值的变化趋势,还使得H2O2干预后显著提高的归属于各氨基酸谱带的峰强度值有所下降,如770、1 043、1 609 cm‐1等。故推测川芎嗪对H2O2所造成的一系列氧化应激损伤具有较强的保护作用,其抗氧化的作用靶点可能与脂类相关。另外值得注意的是,分别归属于酰胺I和酰胺Ⅲ的谱带1 694、1 240 和1 256 cm‐1,其峰强度值在川芎嗪的作用下出现不同程度的下降。这与我们之前得到的结果不同。表明氧化应激没有引起RPE 细胞内酰胺的脱酰胺化,反而是在添加川芎嗪后酰胺峰强度比发生了变化。最后,我们还发现ROS 也可能影响RPE细胞的DNA核酸碱基,如谱带1 256、574、1 454 cm‐1。
3 结论
本文利用InVia微拉曼光谱系统对过氧化氢所诱导的人RPE细胞氧化应激损伤进行了指纹分析。结果表明,H2O2干预后,RPE细胞ROS水平升高,存活率降低。添加抗氧化剂川芎嗪后,细胞ROS水平显著降低,细胞活力测试结果也显示川芎嗪能抑制细胞活力的下降。光谱结果显示,施加H2O2干预的细胞与对照组细胞拉曼光谱的差异主要体现在归属于氨基酸和脂质分子的谱带上。根据所影响的氨基酸类型,推断氧化应激可能会影响RPE细胞黑色素合成、葡萄糖代谢和抗氧化剂的产生等生理过程。此外,川芎嗪的加入逆转了归属于脂质的谱带峰强度值的变化趋势,故推测脂类是川芎嗪发挥抗氧化作用的重要靶点。与此同时,我们还发现川芎嗪可能使RPE细胞内的酰胺发生脱酰胺化。综上,本研究使用无创无标签拉曼光谱技术,揭示了H2O2和抗氧化剂川芎嗪潜在的作用靶点,为更好地探究视网膜RPE细胞氧化应激的损伤机制奠定了基础。同时,为今后抗氧化药物的研究和开发提供了一个新的方向。进一步证明了基于分子水平的拉曼光谱技术是视网膜相关疾病生物标志物检测的有效手段。

