肿瘤治疗电场的微观机制及临床应用进展
杨丽姝,刘丽珠,韩波
哈尔滨医科大学附属第一医院肿瘤科,黑龙江哈尔滨150001
前言
肿瘤治疗电场(Tumor Treating Fields,TTFields)是一种便携式设备,利用非侵入式一次性传感器阵列提供低强度、中频、交变电场,对细胞施加物理力,干扰肿瘤细胞有丝分裂,抑制肿瘤生长,但对于静止期细胞没有作用。TTFields 由以色列理工学院Yoram Palti首倡,2004年以色列研究人员Kirson 等[1]发表首篇主体论文,报道TTFields对肿瘤细胞有丝分裂的干扰作用以及对小鼠体内黑色素瘤的抑制作用;之后的多项体外、体内和临床研究则显示了其良好的安全性和可靠的抗肿瘤作用[2‐6]。2007年TTFields 通过欧盟CE 认证;2011年美国食品药品监督管理局(Food and Drug Administration, FDA)批准NovoTTF‐100A 系统(产品Optune)用于治疗复发胶质母细胞瘤(Glioblastoma,GBM)[7];2015年FDA 批准其用于治疗新诊断GBM[8];2019年FDA 批准NovoTTF‐100L 系统用于治疗局部晚期或转移性恶性胸膜间皮瘤(Malignant Pleural Mesothelioma,MPM),这是15年来FDA 批准的首款MPM 疗法[9]。美国国立综合癌症网络[10]和我国脑胶质瘤诊疗规范均推荐TTFields 用于GBM 的治疗[11]。2020年5月,中国国家药品监督管理局批准TTFields 产品爱普盾上市,用于新诊断和复发GBM 的治疗,这是15年来中国内地首个获批的GBM 疗法。本研究将对TTFields 这一新的抗肿瘤治疗方式的生物学原理进行综述。
1 电生理学基础
TTFields不是直接使用电流治疗肿瘤,而是使用电场。电场由电荷产生,场强方向从正电荷指向负电荷,而处于电场中的电荷也会受到电场力的作用。在恒定均匀电场中,带电离子可沿着电场方向流动,而极性分子(也称偶极子)则只能沿着电力线方向排布。交变电场中,电场力在相反方向上交替变换,带电粒子的运动方向也交替变换形成离子流振荡,而偶极子则会发生旋转振荡(图1a)[2]。非均匀交变电场可对极性分子施加电场力,迫使它们向高场强处移动,这个过程称作介电泳。活体细胞内的离子、带电分子、偶极子、细胞器和细胞膜均对电场和电流有反应,并可产生电场和电流,这些电活动在许多生物学过程中起着关键作用。低频电场(1 kHz 以下)通过膜去极化刺激可兴奋组织,刺激骨生长并加速骨折愈合[2];高频电场(高于1 mHz)的主要生物学效应为组织加热[2];中频电场(100 kHz~1 mHz)随着电场方向变换频率的增加,电场力对带电离子和偶极子的净效应几近于零,对于静止期细胞没有作用,而对于处于有丝分裂期的细胞,TTFields将产生不均匀细胞内电场,干扰染色体和细胞质分离[2]。
2 TTFields的微观机制
2.1 干扰细胞有丝分裂导致细胞出现应激、凋亡和增殖抑制
TTFields 通过干扰处在有丝分裂期细胞的染色体分离、卵裂沟(Cell Cleavage Furrow,CCF)形成和细胞质分离,阻断细胞有丝分裂并导致细胞破坏。在有丝分裂期中期,染色体均匀分布于赤道平面,后期通过纺锤体微管的活动实现染色体分离,同时中线纺锤体形成、CCF 组装并激活内陷使细胞逐渐呈哑铃形;进入末期,CCF 缩窄加深,胞质分离,完全分裂为两个子细胞(图2a)[12]。TTFields 处理的细胞可以顺利进入有丝分裂期的中期形成赤道板,但在中期之后,电场力通过干扰微管蛋白的聚合和解聚来干扰微管的组装和拆卸,导致赤道板上的姊妹染色单体不能正常分离,无法进入有丝分裂后期,有丝分裂被迫停止[1]。在中期结束时,CCF的准确定位和收缩是胞质分裂的必要条件[12],而TTFields能使后期中线纺锤体结构出现异常,使CCF 不能在正确位置组装形成并启动收缩,大部分细胞将呈现异常膜收缩,部分细胞可短暂形成CCF 但也会迅速退缩,导致尚未分离的子代细胞迅速合并成双核细胞。所以,TTFields处理的细胞在有丝分裂结束后,将会出现大量双核或多核的核异常细胞(图2b)[12]。在有丝分裂的后期和末期,细胞呈哑铃形,使得TTFields 施加在细胞内的电场力呈类似沙漏样的不均匀分布,CCF处场强最高,不均匀电场会对所有细胞内离子、偶极子和胞质细胞器施加单向电场力(图1b)[2],在几分钟内将它们拉向并堆积在CCF 处(介电泳现象),从而干扰细胞质分离并最终导致细胞破坏[1‐3]。
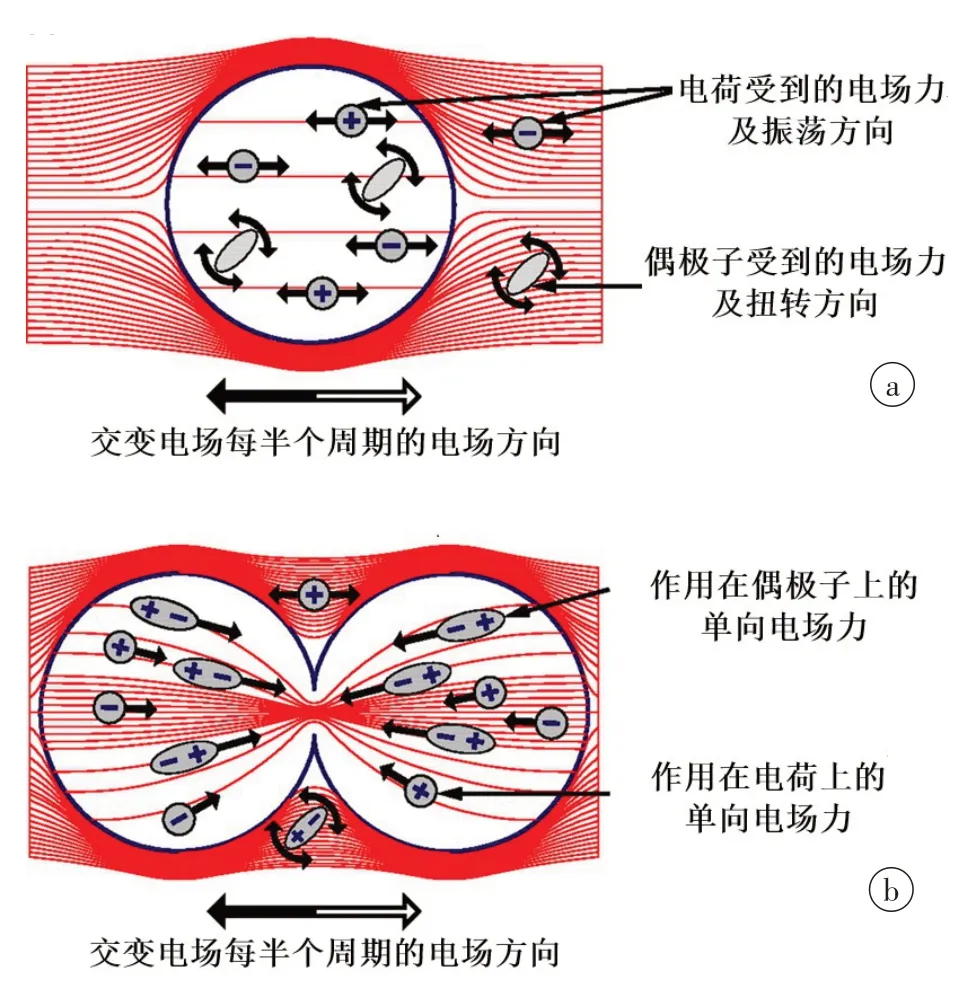
图1 交流电场在静止(a)和分裂(b)细胞内及周围的分布Fig.1 Alternating electric field distribution in and around quiescent(a)and dividing(b)cells
TTFields 暴露后,会出现许多大细胞、含有空泡的细胞和多个核细胞,并出现膜起泡、破裂和许多小的膜泡,类似于有丝分裂后凋亡细胞死亡,随后的细胞增值也会显著减少,其效应可持续到TTFields暴露终止后的72 h[1],这表明经TTFields 处理的细胞即使存活下来也将发生G0/G1期阻滞,无法再次进入细胞周期[13]。有实验观察到TTFields暴露后,P53+/+细胞的DNA 合成将明显受到抑制,无法进入S 期,细胞凋亡也会增加;而P53‐/‐细胞的DNA 合成不会明显减少,凋亡增加不明显。这种P53依赖性的分子机制目前尚不清楚,但提示TTFields的疗效可能受到患者肿瘤遗传因素影响[12]。
2.2 TTFields作用的靶分子
TTFields 对于有丝分裂细胞的特异性作用依赖于其对具有高偶极矩的分子施加旋转、扭转应力的能力,参与调节细胞有丝分裂的高偶极矩蛋白质分子是TTFields 抗肿瘤活性的潜在靶点[2‐3],如微管蛋白、Septin蛋白复合物、丝/苏氨酸蛋白激酶Plk1、非肌肉肌球蛋白II(Non‐muscle Myosin II,NM II)和纤维型肌动蛋白(F‐actin)。
微管是由微管蛋白α/β‐tubulin 二聚体组成的极性长管状细胞[14],TTFields 处理的分裂细胞中,位于伸长的微管顶端附近的微管蛋白二聚体同时受到电场力和极性微管尖端的作用力,如果电场力小于微管尖端作用力,微管蛋白二聚体将正常排列在微管上,反之则不能,这会导致染色单体不能正常分离且变得分布无序,使有丝分裂终止于有丝分裂中期[1]。
Septin 蛋白复合物由Septin2、6 和7 组成,其偶极矩2 711Debyes (D)相比蛋白质中位偶极矩542.66 D高出5 个标准差,偶极矩方向垂直于蛋白质纵轴方向[15]。在有丝分裂后期,Septin 蛋白复合物被苯胺招募到中线纺锤体和CCF,通过横向相互作用力自行组装成纤维网格以稳定后期中线纺锤体的微管结构,并界定CCF 的收缩界限(图2a)[12]。TTFields 可迫使强偶极子Septin蛋白复合物发生旋转,使其在中线纺锤体和CCF 的定位明显减少[12],并且无法彼此结合形成纤维网格,导致参与收缩的细胞膜无法被限制在赤道板周围CCF 的位置,只能出现紊乱的细胞膜收缩,不能完成胞质分裂(图2b)[12]。
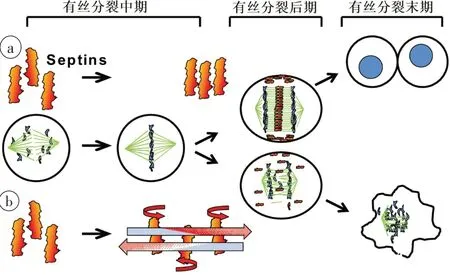
图2 TTF作用导致有丝分裂破坏的模型Fig.2 Model for TTFields action leading to mitotic disruption
丝/苏氨酸蛋白激酶Plk1在细胞周期进程中具有重要作用,包括中心体成熟、有丝分裂启动、染色体分离和胞浆分离等,Plk1 主要定位于中心体,并可随着细胞周期变化定位于不同的亚细胞结构。Plk1 在G2 期和M 中期富集于着丝粒上,M 后期染色体分离后则易位于中线纺锤体[16]。经TTFields 处理的细胞其后期中线纺锤体中Plk1 水平并不发生变化,表明后期中线纺锤体结构能够形成,但Septin蛋白复合物不能定位于此[12]。
NM II是驱动CCF 收缩的主要成分,苯胺与上皮细胞转化序列2(ECT2)结合后,再与Septin复合物结合并招募NM II至后期中线纺锤体和CCF,当其被调控蛋白RhoA 活化后可与肌动蛋白协同作用促进CCF 收缩[17‐18]。TTFields 处理的细胞中,被招募到CCF的NM II呈无序分布,在CCF外还可见其条索状和斑点状分布,无法驱动CCF收缩[12]。
F‐actin束位于膜下的细胞皮层,是细胞成功分裂必需的成分,由Septin 复合物招募其定位于CCF。Septin 蛋白复合物在经TTFields 处理的细胞中不能正确定位,这将导致F‐actin 无法在中线积累并驱动CCF收缩[12]。
计算蛋白质偶极矩需要已知其完整晶体结构,目前除Septin 蛋白复合物的晶体结构已知外,Plk1、ECT2 或苯胺等调节因子的完整晶体结构尚未得知[2]。
3 TTFields的影响因素
3.1 TTFields对不同细胞的作用
由于静止期细胞内没有如微管蛋白等极性大分子,细胞也不会呈现哑铃形,TTFields在静止细胞内形成均匀的细胞内电场,不会出现介电泳现象(图1a)[2],所以TTFields 对于静止期细胞没有作用。有实验表明TTFields 作用后的静止细胞的形态和功能仍保持完整[1]。接种于小鼠皮内的黑色素瘤经TTFields 处理后,病理学分析可见广泛坏死、核溶解性碎片及碎片聚集,而其周围的真皮结构形态完整未见损伤[1],提示TTFields 仅作用于快速分裂的细胞。低频电场可激发神经和肌肉引起心律失常和癫痫,而在频率大于10 kHz 的交变电场中其兴奋作用会显著降低,不会引起神经和肌肉的兴奋。在动物实验和临床应用中,无论短期或者长期应用TTFields,都未观察到心脏或神经活动异常的迹象[2]。
对于快速分裂的正常细胞,如骨髓造血细胞和肠粘膜细胞,理论上可能受到TTFields的破坏。骨和骨髓具有高阻抗特性,大腿骨髓腔内的场强相比其周围组织低100倍,可保护位于骨髓腔的造血细胞不受电场力影响;肠粘膜细胞复制周期相比肿瘤细胞慢得多,肠道运动不断改变小肠粘膜细胞与电场的相对方向,可进一步降低TTFields对小肠粘膜细胞的破坏力[2]。接受TTFields 的患者和暴露于比有效抗肿瘤剂量高3 倍场强的实验动物身上,均未发现TTFields相关的造血和消化道粘膜毒性[2]。
3.2 影响TTFields敏感性的因素
电场频率、场强、方向和暴露时间均影响肿瘤细胞对TTFields 的敏感性。细胞和动物实验表明不同细胞对不同频率TTFields敏感,有研究人员计算了分裂细胞中1 μm 可极化球形粒子所受的力与细胞半径、膜厚度和细胞质电导率的函数关系发现,最佳TTFields频率与细胞大小成反比,人胶质瘤细胞的最佳频率为200 kHz,其他细胞的最敏感TTFields 频率一般是100~200 kHz[9,19]。TTFields 对增值细胞的破坏具有强度依赖性,即场强越大,TTFields作用越强。在最优频率下,小鼠黑色素瘤细胞和大鼠胶质瘤细胞分别在1.35 V/cm 和2.25 V/cm 电场强度下完全停止增殖[1],人非小细胞肺癌和人乳腺癌细胞需要的电场强度则更大[2]。电场在空间任何一点都有确定的方向,与电荷和极性元件施加的电场力方向一致。细胞分裂轴方向与电场方向的夹角会影响TTFields的敏感性,夹角越小作用越强,平行时最强,垂直时最弱[1]。由于分裂轴是随机取向的,单一电场方向的TTFields 抑制作用较小,每隔0.25~1.00 s 按顺序应用多个电场方向可使更多细胞的分裂轴与电场力方向平行,从而受到TTFields 最强的作用,使肿瘤的生长抑制增强[2]。在使用VX‐2的肿瘤动物模型中以及接受连续TTFields治疗复发性GBM的患者和乳腺癌转移患者中均观察到,暴露于TTFields 连续4 周后肿瘤才开始缩小。GBM 生长动力学模型也表明与化疗不同,TTFields 必须连续应用至少4 周,才能实现肿瘤的生长稳定和逆转[20]。
3.3 化疗可提高TTFields敏感性
化疗药物阿霉素和环磷酰胺通过破坏细胞DNA的模板活性来杀灭增殖期内的各期细胞,以S期最为敏感,这与TTFields 不同;紫杉醇使微管蛋白二聚体不易解聚从而增加微管的长度及偶极矩,TTFields作用力也随之增加,导致细胞对TTFields 的敏感性提高,所以,化疗药物与TTFields 同时暴露对肿瘤细胞的增值抑制可能有相加或协同作用[5]。化疗药物单独处理后的细胞其增殖率在24~48 h 内几乎能完全恢复,而化疗联合TTFields可导致细胞增殖完全的不可逆性抑制[5]。联合暴露使剂量‐反应曲线左移,IC50(50%的细胞增殖被抑制的药物浓度)降低,显著减少化疗药物剂量(低于1~3 个数量级的药物浓度)后对肿瘤细胞增值仍能达到相同水平的抑制[5]。体内外实验均证实对于兔肾脏VX‐2 肿瘤、卵巢癌和非小细胞肺癌,TTFields联合紫杉醇化疗可提高疗效且不增加毒性[3‐4]。替莫唑胺与TTFields 联用能显著提高新诊断GBM 患者疗效且不增加药物剂量和毒性,这已在临床试验中得到证实[5‐6]。
4 临床试验
TTFields 于1998年在EF‐02 试验中首次用于人体,6 例经过多线治疗后的晚期癌症患者在应用TTFields 后没有严重的毒副反应并观察到一定的疗效[21]。EF‐07是2004年开始的对10名复发和10名新诊断GBM 患者应用TTFields 的单臂预临床试验,两组的无进展生存期(Progress Free Survival,PFS)和总生存期(Overall Survival,OS)与历史数据对照均显著获益[2,5]。EF‐11是2006年开始的TTFields第一个随机对照III 期临床试验,结果显示对于复发GBM,单用TTFields 与化疗相比有提高客观有效率和降低死亡风险的趋势,并明显改善患者的生活质量[7],进一步分析则表明每天使用TTFields 超过18 h 的患者有OS 获益[22]。EF‐14 是2009年开始的针对新诊断GBM 患者的随机、开放标签的多中心III 期临床试验,结果显示在接受标准的手术和同期放化疗之后在替莫唑胺(Temozolomide, TMZ)维持化疗的基础上同时应用TTFields 与单独TMZ 维持化疗相比,联合TTFields 显著改善了PFS(7.1月vs4.0月,P=0.001)和OS(20.5月vs15.6月,P=0.004),5年总生存率由5%提高至13%(P=0.0037)[23]。亚组分析表明平均每日使用TTFields 时间达22 h 以上的患者中位OS 可达24.9月,5年生存率达29.3%[6]。TTFields 在真实世界的数据中也证实了其良好的安全性、耐受性以及显著的生存获益和生活质量的改善[24]。唯一的不良反应是TTFields 换能器阵列下的局部皮肤刺激,考虑为潮湿、散热受阻、毛孔阻塞、水凝胶和医用胶带的化学刺激等综合因素引起,可以通过应用类固醇软膏和周期性更换电极位置得到良好的解决[2,23]。目前对新诊断GBM 患者将TTFields 的应用提前到与TMZ 同期放化疗,同时进行I/II 期临床试验[25]。
TTFields 在其它癌症中的应用也开展了临床研究。在一项单臂多中心II 期临床试验中,41 例晚期非小细胞肺癌患者接受TTFields 联合培美曲塞作为二线治疗,中位OS 达13.4 个月,与单药培美曲塞的历史对照相比,疗效显著提高[26]。2013年开始的EF‐20 试验纳入了40 例新诊断的局部晚期或转移性胰腺癌患者接受TTFields 联合吉西他滨或吉西他滨加紫杉醇治疗,结果显示与单纯全身化疗的历史数据相比,未观察到严重不良事件增加,证明TTFields联合全身化疗治疗晚期胰腺癌是安全、可耐受的,目前针对晚期胰腺癌的随机III期临床研究(PANOVA‐3)正在进行中[27]。2014年开始的EF‐22 是一项多中心单臂II期临床试验,纳入31 名复发卵巢癌患者,给予TTFields联合紫杉醇周方案治疗,PFS达8.9个月[28]。STELLAR 是一项2015年开始的多中心单臂II 期研究,纳入80 名组织学确诊不能切除的MPM,在培美曲塞加铂类化疗同时联合应用TTFields,试验显示未观察到全身毒性增加,中位OS 为18.2月,优于历史对照的12.1月,并因此被FDA 批准用于治疗局部晚期或转移性MPM[9]。
目前还有很多前瞻性随机对照的III期临床试验正在进行当中,EF‐24 开始于2016年,拟纳入300 例组织病理为鳞癌的晚期非小细胞肺癌患者,检测TTFields 联合化疗在该人群中的疗效和安全性[29];EF‐25 开始于2017年,拟纳入270 名发生1~10 个脑转移病灶的非小细胞肺癌患者,在立体定向放射外科治疗后随机给予TTFields 或者观察,以测试TTFields对于非小细胞肺癌脑转移患者的疗效、安全性和神经认知结果[30];INNOVATE‐3 开始于2017年,拟观察早期复发的铂类耐药卵巢癌患者使用TTFields联合紫杉醇周方案的疗效[28]。此外,还有一些II期试验正在进行中,以研究TTFields对小细胞肺癌脑转移[31]、晚期肝癌[32]、复发性脑膜瘤[33]、高危少突胶质瘤[34]、儿童高级别胶质瘤和室管膜瘤[35]的疗效。
5 总结与展望
作为一种局部应用的非侵袭性抗肿瘤新疗法,TTFields特异性作用于有丝分裂细胞,对于静止期细胞无影响,可用于治疗多种癌症,目前的基础研究和临床研究均显示了TTFields可靠的安全性、耐受性和令人鼓舞的疗效。对其进行深入的生物学研究有助于了解不同瘤种的TTFields最优参数,从而使其发挥最大的疗效。积极开展临床试验,探索TTFields在不同病种,与放疗、化疗、免疫治疗和靶向治疗等手段联合应用的可能性和最佳方式,有助于让更多患者有机会接受这一抗肿瘤新疗法,从而增加医生和患者的抗肿瘤治疗的选择并有可能改善现有的抗肿瘤疗效。

