不同保护剂对大鼠肾脏冻融法脱细胞的影响
罗嗣昌,胥义
上海理工大学生物系统热科学研究所,上海200093
前言
器官移植已成为治疗器官疾病末期最有效的方法之一,每年都能拯救无数的患者。但当前供体器官不足的共性问题导致许多患者在等待供体过程中死亡[1]。另外,异体移植也可能因免疫系统的反应,致使移植患者需要长期服用免疫抑制剂[2]。随着组织工程和再生医学的发展,利用干细胞与器官支架再生器官可能能够成为器官移植的来源[3‐4]。Meezan等[5]首先提出去污剂脱细胞的方法,并证实脱细胞后的细胞外基质能保留超微结构的不溶性成分。Ott等[6]通过在脱细胞大鼠肾脏接种干细胞构建具有一定功能的肾脏,让再生肾脏作为供体器官成为可能。脱细胞支架已将细胞及DNA 等物质洗脱干净,再生器官后能够避免肾脏移植所引发的免疫抗原反应[7‐9]。
常用的脱细胞方法有洗脱剂洗脱法[10]、酶处理法[11]、冻融法[12]等。离子型洗脱剂SDS对细胞的洗脱效果较好,但同时会将肾脏内的许多其他物质一起洗脱,造成细胞外基质各成分的损失[13];非离子型洗脱剂Triton‐100对细胞外基质的损伤较小,但细胞的洗脱效果不佳,很难将肾脏内部的细胞成分完全洗脱干净[14]。酶解法利用生物酶进行洗脱工艺处理,但研究表明,尽管酶解法能够特异性去除细胞中DNA等成分,其单独洗脱效果不好[15]。冻融法脱细胞利用冻融过程溶解细胞,再通过洗脱剂进行细胞的洗脱。冻融法能更有效地溶解组织和器官内的细胞,冻融过程不会显著增加组织中细胞外基质蛋白的损失[12]。但有研究表明,冻融过程中出现的冰晶、产生的热应力等都可能影响生物组织冻融后的结构完整性[16‐17]。常采用添加低温保护剂的方式来控制冰晶生长,并成功应用于多种生物材料低温保存过程[18‐20]。渗透性低温保护剂甘油和二甲基亚砜(Dimethyl Sulfoxide,DMSO)是当前低温保存中非常常见的低温保护剂,能够帮助一些生物材料在一定低温条件下长时间保存;而海藻糖和麦芽糖作为非渗透性冷冻保护剂,越来越多的科学家将之用于低温生物领域。但从文献调研来看,不同保护剂辅助冻融脱细胞目前主要是在肝脏冻融法脱细胞方面取得较好效果[12],而肾脏冻融法脱细胞方面鲜有应用和探讨。
鉴于此,本研究初步探索几种常用的保护剂及浓度对大鼠肾脏冻融法脱细胞支架的血管网络完整性、DNA 残留、细胞外基质的保留和力学性能等影响,有望为后续肾脏冻融法脱细胞工艺优化提供重要依据。
1 材料和方法
1.1 实验动物及试剂
成年雄性SD 大鼠48只(上海杰思捷实验动物中心,清洁级),体质量200 g 左右,按清洁级标准喂养。磷酸盐溶液(PBS)(上海励瑞生物科技有限公司),甘油(国药集团化学试剂有限公司),DMSO(国药集团化学试剂有限公司),海藻糖(国药集团化学试剂有限公司),麦芽糖(国药集团化学试剂有限公司),Triton X‐100(国药集团化学试剂有限公司),Microfil造影剂(美国Flow Tech 公司),HE 染色盒(上海赛新生物科技有限公司),Masson 染色盒(上海赛新生物科技有限公司),Weigert 染色盒(上海赛新生物科技有限公司),弹性蛋白抗体(武汉三鹰生物技术有限公司),三羟甲基氨基甲烷(Tris‐Hcl)(上海励瑞生物科技有限公司)。
1.2 实验方法
1.2.1 脱细胞方法实验组分为未添加保护剂组、10%v/v甘油组(溶媒为双蒸水)、10%v/v DMSO组(溶媒为培养基)、5%w/v麦芽糖组(溶媒为PBS)、5%w/v海藻糖组(溶媒为PBS),新鲜组未经冻融法脱细胞过程处理。
利用麻醉剂将实验大鼠深度麻醉后通过十字解剖法露出腹腔,并将左肾及主动静脉裸露,进行主动脉插管,冲洗血液后灌注保护剂,将大鼠肾脏解剖离体,然后放置于‐20 ℃冰箱中进行冷冻。12 h 后在37 ℃温水中进行水浴复温,然后利用蠕动泵对肾脏用0.3%Triton X‐100 以0.4 mL/min 的流速灌注24 h,PBS灌注2 h。
1.2.2 实验检测分析方法(1)血管造影。利用造影剂对大鼠肾脏血管网络进行固化,并利用CT 进行扫描,通过CT 三维重构评估冻融法脱细胞肾脏血管网络完整性及血管损伤情况。(2)染色切片及免疫组化。利用HE 染色切片检测脱细胞支架DNA 残留情况,利用Masson 染色切片和免疫组化检测胶原及弹性蛋白保留情况[21]。(3)蛋白质定量分析。利用考马斯亮蓝法定量检测冻融法脱细胞肾脏支架蛋白质的含量。(4)力学性能分析。利用动态力学分析仪(Dynamic Mechanical Analyzer,DMA)对大鼠冻融法脱细胞肾脏支架进行力学性能测试,通过压力测试曲线得出样本的弹性模量,从而评估冻融法脱细胞大鼠肾脏支架力学性能。
2 实验结果
2.1 不同保护剂对血管网络完整性的影响
血管网络完整性检测是利用造影剂灌注进入肾脏内部血管,待造影剂固化后利用CT扫描观察从而得到血管网络图,如图1所示。图1a为大鼠肾脏新鲜对照组血管网络,从中可以清晰地看到正常大鼠肾脏完整的血管网络;图1b为不加载保护剂的冻融脱细胞肾脏支架血管网络,可以发现其血管网络损伤比较严重;加载10%甘油和5%麦芽糖这两组的血管网络也都损伤比较严重;但10%DMSO和5%海藻糖这两组的血管网络相对比较完整。其中甘油和DMSO为渗透性保护剂,麦芽糖和海藻糖为非渗透性保护剂。从血管造影结果来看,加载不同保护剂对冻融法脱细胞支架的血管网络作用效果不同,不同类型保护剂均有可能对冻融法脱细胞支架血管网络有保护剂作用。
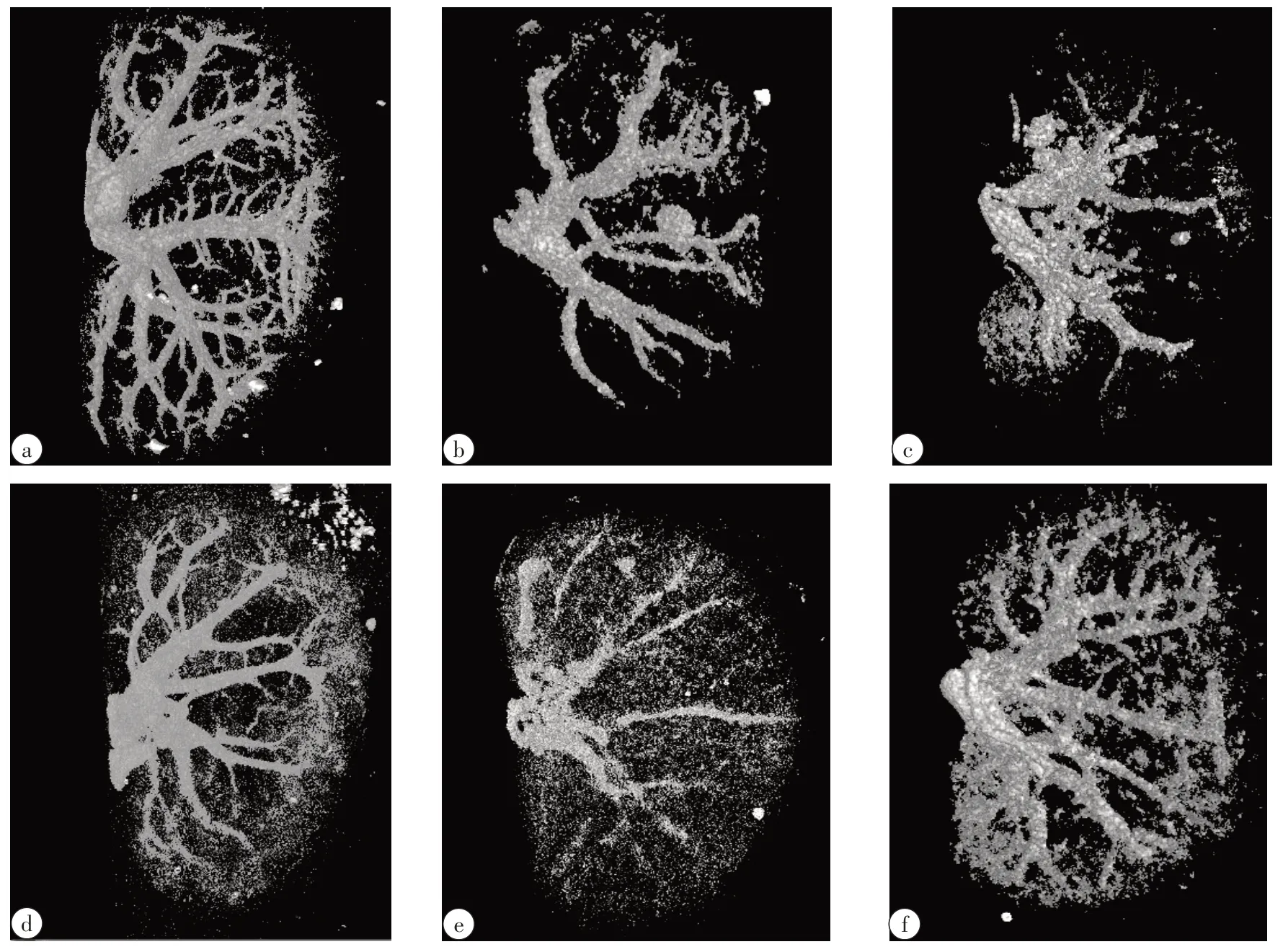
图1 加载不同保护剂大鼠肾脏冻融脱细胞支架的血管造影Fig.1 Angiography of the decellularization scaffolds of rat kidney obtained by freeze-thaw method with different cryoprotective agents
2.2 不同保护剂对细胞及DNA残留的影响
HE 染色是一种能够判定组织中是否还残留DNA 及细胞核等物质的重要手段。如图2所示,新鲜组的HE 染色能看到完整的细胞核;未添加保护剂组蓝色区域较多,但基本没有成形的细胞核,说明冻融过程基本将细胞溶解了;10%甘油组视野内基本看不到细胞核但仍存在部分蓝色区域;10%DMSO 组也存在较多的蓝色区域,说明支架内还残留比较多DNA 成分;5%麦芽糖组蓝色区域比较明显;5%海藻糖组视野内基本看不到细胞核且蓝色区域较少,说明脱细胞效果较好。从HE 染色切片来看,5%海藻糖DNA 残留相对最少,即加载5%海藻糖组的脱细胞效果最好。从血管网络来看,10%DMSO 和5%海藻糖的保存最为完整,但5%海藻糖脱细胞效果更好,这说明在加载不同保护剂的冻融法脱细胞方案中,血管网络更加完整并不意味着脱细胞效果更好。在本研究中,5%海藻糖在血管网络保存比较完整的同时其脱细胞效果也相对较好。

图2 大鼠肾脏冻融脱细胞前后的HE染色(×100)Fig.2 HE staining of rat kidneys before and after freeze-thaw decellularization (×100)
2.3 不同保护剂对细胞外基质的影响
Masson染色是检测胶原纤维含量的一个重要方法。其中胶原是细胞外基质的重要组成部分。图3所示为新鲜对照组和不同实验组的Masson染色切片结果。将新鲜对照组和不同实验组进行对比可以发现,在不加载保护剂和加载不同保护剂的条件下,Masson染色的蓝色着色区域大小基本相同。冻融法脱细胞的冻融过程对细胞外基质成分的损伤是有限的,即使多次冻融也不会增加其损伤[12]。非离子型洗脱剂Triton‐100的洗脱过程对细胞外基质中胶原含量的损伤也是非常小的。所以冻融法脱细胞能比较完好地保留大鼠肾脏的胶原,加载保护剂与否,冻融法脱细胞也不会造成胶原含量的损伤。
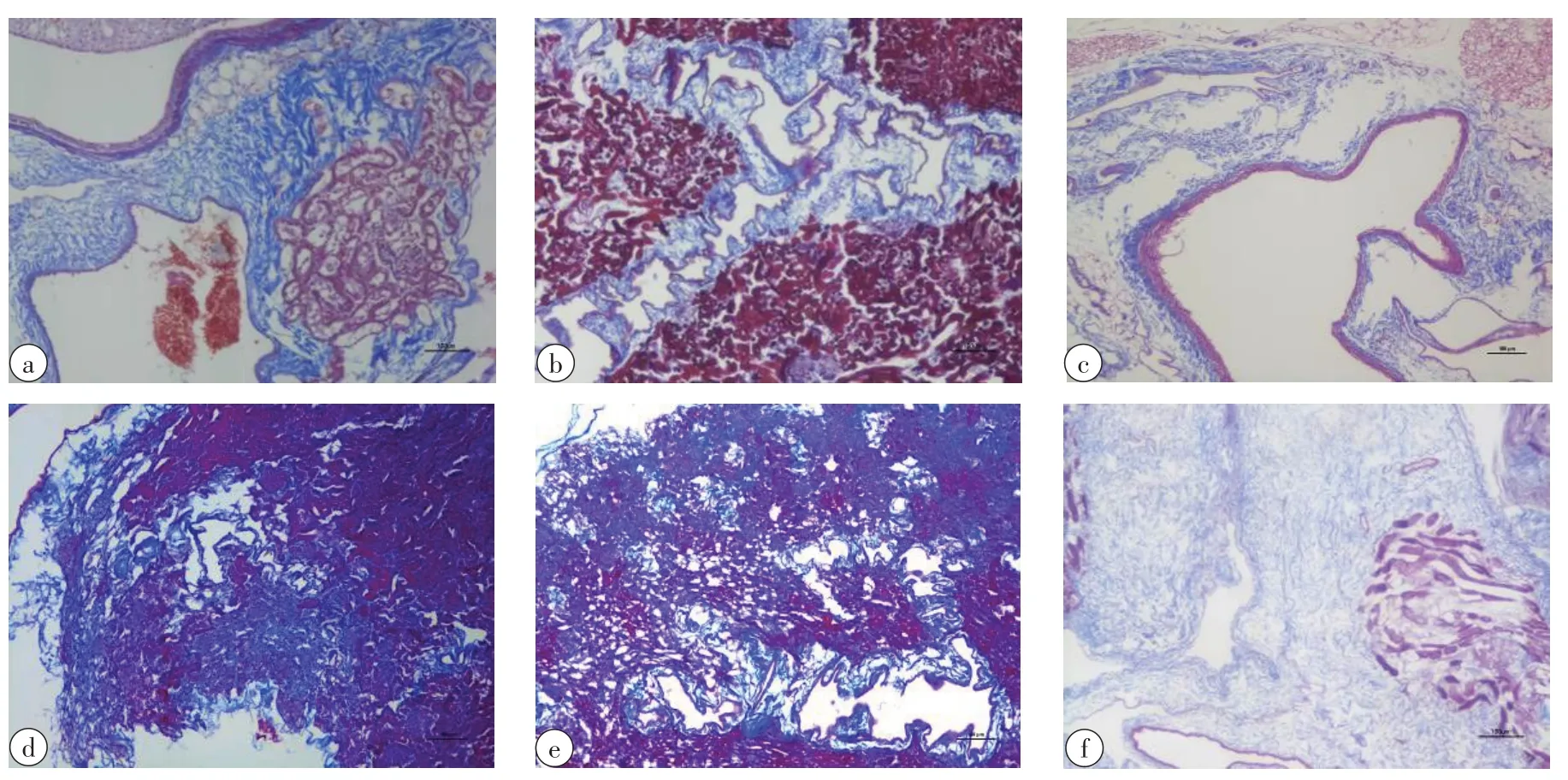
图3 大鼠肾脏冻融脱细胞前后的Masson染色(×100)Fig.3 Masson staining of rat kidneys before and after freeze-thaw decellularization (×100)
免疫组化能够对特异性蛋白进行着色,从而检测特异性蛋白的含量。本实验利用弹性蛋白抗体对大鼠肾脏脱细胞支架进行弹性蛋白免疫组化染色。弹性蛋白是维持脱细胞支架正常形态的重要成分,在后续的再细胞化再生器官中起着非常重要的作用。如图4所示,通过对新鲜对照组和不同实验组结果观察可以发现,加载不同保护剂的弹性蛋白染色区域大小基本相同。这与Masson切片染色结果是相同的,说明冻融法脱细胞的冻融过程对弹性蛋白的损伤也是有限的。冻融法脱细胞对弹性蛋白的含量也不会造成损伤。

图4 大鼠肾脏冻融脱细胞前后弹性蛋白免疫组化(×100)Fig.4 Elastin immunohistochemistry of rat kidneys before and after freeze-thaw decellularization (×100)
通过考马斯亮蓝法可进行蛋白质的定量检测。如图5所示,通过对新鲜对照组与实验组进行误差分析可以发现实验组与新鲜组均存在显著性差异,说明实验组在冻融脱细胞过程中还存在一定的蛋白质损失,导致这个结果可能是因为在冻融法脱细胞后细胞内的蛋白质与细胞及DNA等物质一起被灌注洗脱出肾脏。但两者并没有数量级上的差异,且除新鲜对照组外其他实验组之间的蛋白质定量数据不存在显著性差异,这说明在冻融及Triton X‐100 灌注洗脱过程中蛋白质并没有发生明显的损失。脱细胞支架内部的蛋白质等物质的完整对后续的再细胞化有着十分重要的作用。从当前结果来看,冻融法脱细胞能基本保留大鼠肾脏细胞外基质大部分蛋白质等物质。
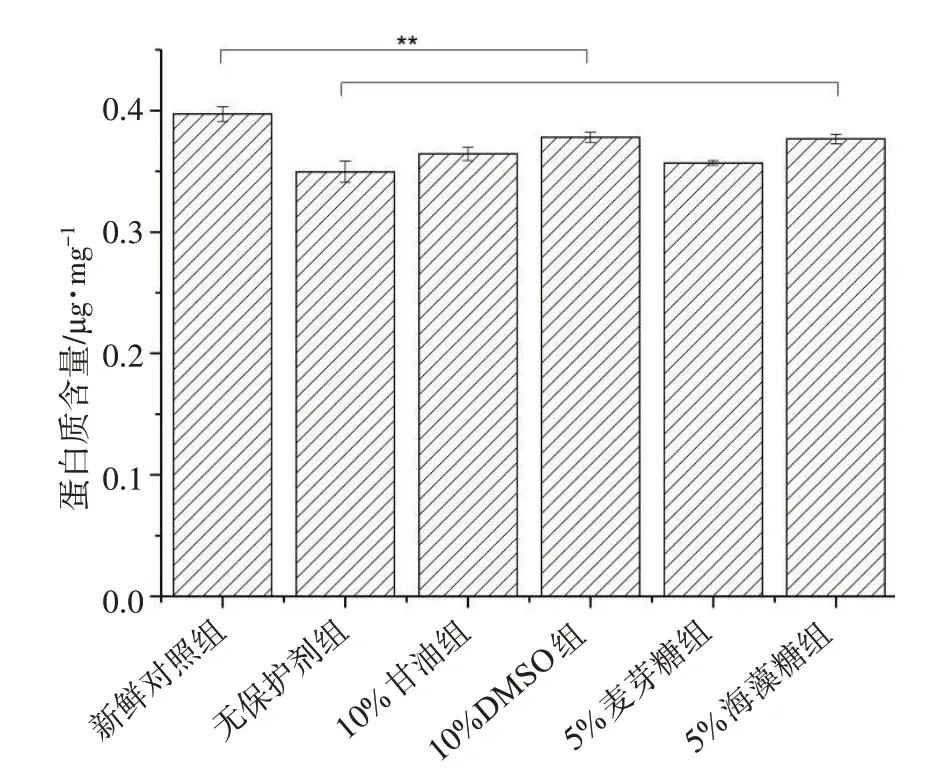
图5 新鲜对照组及实验组蛋白质定量检测(重复实验组数n=3)Fig.5 Quantitative detection of protein contents in control group and experimental groups(the number of repeated experimental groups was 3)
通过对实验样本的胶原染色、弹性蛋白免疫组化以及蛋白质定量可知冻融脱细胞大鼠肾脏支架的胶原、弹性蛋白以及所有蛋白质等细胞外基质成分基本能够得到完整保留。细胞外基质的完整保留对再细胞化有着非常重要的作用,有利于再生器官的制备。
2.4 不同保护剂对力学性能的影响
图6为利用DMA 所得压力曲线,图7为通过数据计算所得弹性模量。对比图7各组弹性模量数据可以发现,新鲜对照组与各实验组与之间存在着显著性差异,说明大鼠肾脏经过冻融法脱细胞处理以后其内部力学性能发生了较大的变化。其中,渗透性保护剂中DMSO 组的弹性模量数据相对比甘油组的结果要好,非渗透性保护剂中海藻糖组相比麦芽糖组结果好。这与血管网络完整性的规律是一致的,说明可能大鼠肾脏脱细胞支架网管网络结构越完整,其力学性能会更好。对比DMSO 和海藻糖组的数据可以知道,10%DMSO 组的弹性模量略微大于5%海藻糖组。从HE染色结果可知,10%DMSO组的细胞及DNA 残留相对更多,这可能是造成10%DMSO 组弹性模量大于海藻糖组的原因。大鼠肾脏脱细胞支架内部细胞的洗脱和血管网络受到一定的损伤,可能是其力学性能发生变化的主要原因。通过对不同保护剂的力学性能分析可知,冻融脱细胞支架相较于新鲜肾脏,其力学性能会发生较大变化。结构更加完整的脱细胞支架更有利于再生成再生器官,但力学性能的变化会与脱细胞支架的结构有怎样的相关性,还需进一步研究。
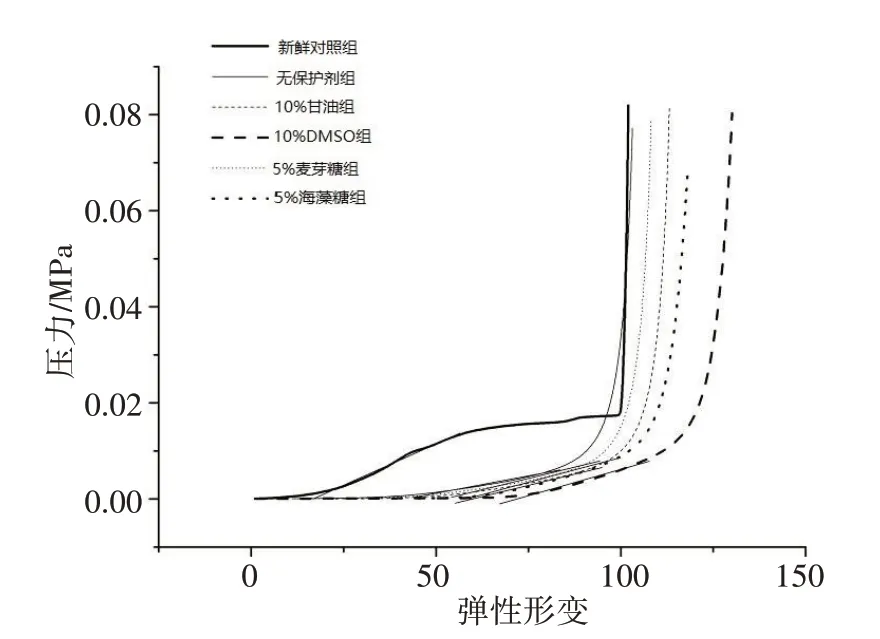
图6 新鲜对照组和实验组压力曲线Fig.6 Pressure curves of control group and experimental groups

图7 新鲜对照组和实验组及弹性模量(重复实验组数n=3)Fig.7 Elastic modulus of control group and experimental groups(the number of repeated experimental groups was 3)
3 结论
本研究利用加载两种渗透性和两种非渗透性保护剂来探索不同保护剂对大鼠肾脏冻融脱细胞的影响。通过CT 三维重构,发现渗透性保护剂10%DMSO和非渗透性保护剂5%海藻糖对冻融脱细胞支架的血管网络均能保存得比较完整。但通过HE染色切片发现,5%海藻糖对细胞的洗脱效果更好,10%DMSO和10%甘油、5%麦芽糖的洗脱效果较差。从Masson切片染色和弹性蛋白免疫组化及蛋白质定量检测来看,冻融法脱细胞支架的细胞外基质成分基本能完整保留。综合来看,加载5%海藻糖的冻融法脱细胞能够制备更好的脱细胞支架,有望成为再细胞化的脱细胞支架材料。
通过加载低温保护剂来辅助冻融法脱细胞是因为低温保护剂对生物材料在低温条件下有抑制冰晶的作用。但冻融法脱细胞要利用冰晶溶解细胞,同时也要利用低温保护剂保护大鼠肾脏内部血管网络等结构。虽然本研究对不同保护剂辅助冻融脱细胞进行了分析,但还不能完全避免器官内部血管网络结构的损伤并将细胞洗脱干净,还需要更深入地研究低温保护剂种类及浓度和冻融工艺对冻融法脱细胞肾脏支架的影响。

