基于脑网络组图谱的首发‐未服药抑郁症白质结构网络研究
吴华旺,佘生林,郑伟,吴逢春,3
1.广州医科大学附属脑科医院影像科,广东广州510370;2.广州医科大学附属脑科医院精神科,广东广州510370;3.广东省精神疾病转化医学工程技术研究中心,广东广州510370
前言
网络两个基本要素为节点和边。在网络构建的过程中,最为关键的一步是如何去定义网络的节点[1]。在脑网络研究中,节点即为脑区。理想的节点应为节点的脑功能同质性,其权衡了节点之间的异质性与空间节点之间的相互关系[2]。脑网络组图谱不仅包含了210 个精细的大脑皮层脑区与36 个皮层下核团亚区结构,而且还定量描绘了不同脑区亚区的解剖与功能连接的模式,并且对每个亚区进行细致的功能描述,相比传统的布罗德曼图谱精细4~5倍,具有客观精准的边界定位[3]。抑郁症(Major Depressive Disorder,MDD)的脑网络研究目前尚未取得一致性的结果。在全局网络属性分析上,有研究发现小世界属性在MDD 患者组与健康对照组存在统计学上的组间差异[4‐6],而在较大样本的研究中并没有发现小世界属性存在组间差异[7‐8]。MDD 脑网络的结果除了受到药物、病程等干扰因素影响之外,其中最关键的因素可能是在构建脑网络时采用了粗糙的解剖图谱去定义网络的节点。因此,本研究目的是采用精细的脑网络组图谱定义脑网络的节点,去考察首发‐未服药MDD 是否存在脑白质结构网络拓扑属性的异常。基于以往磁共振成像在局部结构、功能以及脑网络水平上的结果,我们假设在此精细的脑网络图谱上,MDD 在脑网络水平上发生了异常改变。
1 资料与方法
1.1 研究对象
本研究19 例MDD 患者(MDD 患者组)和30 例健康对照者(健康对照组)均在广州医科大学附属脑科医院收集。MDD的临床诊断由精神科医师根据精神疾病的诊断和统计手册临床结构式访谈(the Structured Clinical Interview of the DSM‐IV, SCID)病人版纳入,符合DSM‐IV关于MDD的诊断标准,排除与其他精神疾病的共病诊断,首次抑郁发作且从未服用任何抗抑郁药物。MDD患者的抑郁严重程度采用汉密尔顿抑郁量表评分24 项(the 24‐item Hamilton Rating Scale for Depression,HAMD)。健康对照组采用SCID 非病人版进行筛查,排除了其目前及既往无DSM‐IV 轴I 的精神疾病诊断,且两系三代无精神疾病的家族史。本研究经过广州医科大学附属脑科医院伦理委员会同意开展,所有被试均经过详细解说本研究方案并且签署书面的知情同意书。被试的临床资料见表1。
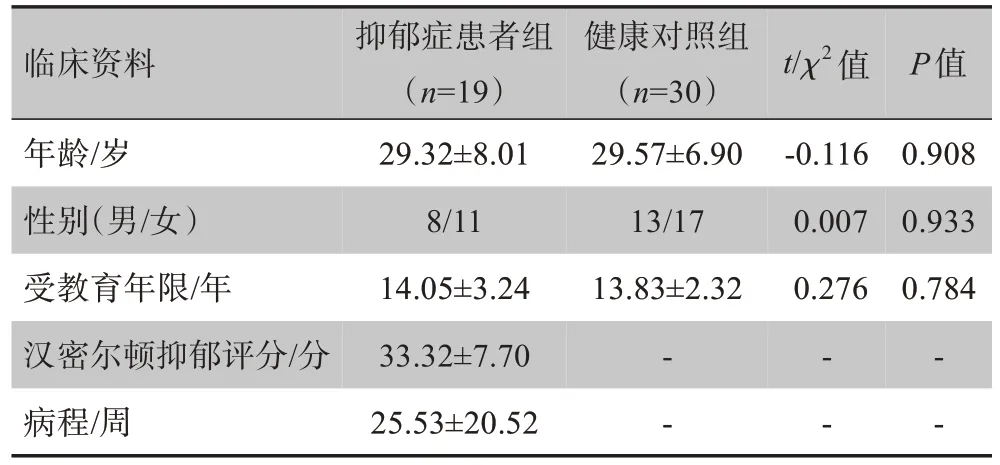
表1 MDD组与健康对照组临床资料比较Tab.1 Demographic and clinical data of major depression disorders(MDD)group and healthy control(HC)group
1.2 扩散及结构磁共振数据采集
磁共振数据的采集在广州医科大学附属脑科医院的飞利浦3.0 T磁共振扫描仪上完成。扩散张量成像的数据采集使用单次激发自旋回波‐平面回波序列。扫描参数如下:重复时间=10 067 ms,回波时间=92 ms,翻转角=900,视野=(256×256)mm2,扫描矩阵=128×128,B0 采集一次,B 值1 000 s/mm2,在32 个非共线方向上施加扩散敏感梯度场,层厚2 mm,无间隔连续扫描,共扫描75 层,体素大小为(2×2×2)mm3。同时采集高分辨率的T1结构磁共振数据用于DTI 数据的配准。扫描序列及参数如下:三维T1加权的快速场回波序列;重复时间=8.2 ms;回波时间=3.7 ms;反转时 间=1 100 ms;反转角=7°;视野=(256×256)mm2;采集矩阵=256×256;层厚=1 mm,无间隔扫描;体素大小=(1×1×1)mm3;矢状位扫描,共188层。
1.3 扩散磁共振数据预处理及网络构建
所有DTI 数据预处理在PANDA 工具包上完成[9],包括:(1)数据格式转换;(2)裁剪图像;(3)剥头皮并得到全脑的MASK;(4)头动和涡流校正;(5)张量估算:对校正之后的图像中每个体素进行张量重建,计算出每个体素的各向异性分数(Fractional Anisotropy, FA);(6)全脑纤维束追踪,采用Trackvis软件的FACT 算法[10]进行确定性纤维追踪出全脑的白质纤维束,纤维束追踪的终止条件为:两个相邻体素的特征向量角度小于45°,FA值小于0.2。
脑网络组图谱将整个大脑半球分割成246 个脑区(每侧大脑半球各123个脑区),每一个脑区为脑网络中的一个节点。每一个脑区与全脑其他脑区进行确定性的纤维追踪,假如两个脑区之间连接的纤维束大于等于3,我们便认为其存在结构连接[11‐13]。然后得到每个个体的246×246 大脑白质结构网络的连接矩阵。
1.4 脑白质结构网络分析
对节点i和节点j之间纤维数的连接大于等于3,则连接矩阵在(i,j)元素的值eij=1;否则,eij=0。对于每一个被试,我们得到一个二值的246×246 连接矩阵。最后采用图论的方法分别计算每个被试脑白质结构网络的拓扑属性,其中包括全局网络属性的聚群系数、最短路径长度和小世界属性,网络效率和局部节点属性的节点度、节点介数、节点效率。所有的网络分析部分在GRETNA软件包上完成[14]。最短路径长度是描述网络内部结构非常重要的一个参数,它度量的是网络的全局传输能力。网络的最短路径长度表示的是网络中任意两个节点对的最短路径(最少边数)的平均值。聚群系数是描述网络局部特征的重要参数,表示网络中某一个节点i的邻居之间相互成为邻居的可能性,它度量的是网络局部信息的传递能力。其中某一个节点i的聚群系数Ci的值等于它的邻居中实际存在的连边的数目(ei)除以最多可能存在的边数的比值。小世界网络是一种介于规则网络和随机网络之间的网络,与随机网络相比,它具有较大的聚群系数(γ=Creal/Crandom>>1,其中real表示真实网络,random 表示随机网络)和近似的最短路径(λ=Lreal/Lrandom~1)。在满足以上两个指标的同时,小世界标量δ=γ/λ用于度量小世界特性(δ>1),其值越大,说明小世界属性越强。网络的效率反映的是网络的信息传输的能力,包括全局效率Eglob和局部效率Eloc。节点度表示与该节点直接相连接节点的数目或节点相连的边数,其衡量的是单个节点在网络中的重要性。节点介数是每个节点对其它所有点对之间最短路径的贡献,其反映了相应节点在整个网络中的作用和影响力。节点效率为节点在网络中的信息传递的能力。
1.5 统计学分析
1.5.1 全局和局部结构网络属性为了确定脑网络全局网络属性和局部节点属性是否存在显著的组间差异,采用非参数置换检验并且将性别、年龄作为协变量进行多元线性回归,以排除每个脑网络拓扑属性中性别、年龄的干扰因素,置换次数为10 000次。P<0.05为差异有统计学意义。
1.5.2 结构网络的连接分析采用基于网络的统计(Network‐Based Statistic, NBS)[15]方法去评定MDD患者组与健康对照组的脑白质结构网络中解剖连接的异常。首先,在每一条边上,进行两组间的双样本t检验,以确定那些结构连接存在差异,阈值设置为P<0.05(未校正)。这将得到在此阈值上的最大可能存在解剖连接矩阵的边或子网络。然后对在此基础之上得到的阈上解剖连接或子网络进行非参数置换检验,最后确定那些连接或子网络存在异常,置换次数10 000次。P<0.05为差异有统计学意义。
1.5.3 结构网络指标与临床资料的相关分析对于那些具有统计学差异的脑结构网络的拓扑属性,进一步分析这些指标与MDD 患者的临床指标(HAMD 评分和病程)之间的关系,并将性别、年龄作为协变量进行多元线性回归分析,以排除性别和年龄的干扰因素。
2 结果
MDD患者组和健康对照组的脑白质结构网络都表现出小世界属性,即具有和相应随机网络相近的平均最短路径和较大的聚群系数。网络的全局属性,如最短路径长度、聚群系数、标准化最短路径长度、标准化聚群系数、小世界标量以及网络效率在两组之间无统计学差异(P>0.05),见表2。网络的局部属性,如节点度、节点介数以及节点效率在两组之间存在统计学差异(P<0.05,未校正),主要位于双侧海马旁回、双侧基底节、双侧顶下小叶、左侧中央后回、左侧中央旁小叶、右侧颞中回、右侧顶上小叶、右侧岛叶、右侧枕叶皮层腹中部、右侧扣带回以及右侧丘脑(图1~图3)。在NBS 的分析中,没有发现MDD 患者组与正常对照组存在组间差异连接的边或子网络。进一步的相关分析结果表明右侧顶上小叶、右侧岛叶的节点介数与病程呈正相关,右侧丘脑、左侧海马旁回的节点介数、左侧海马旁回节、右侧顶下小叶的节点度和HAMD评分呈正相关(图4)。

表2 抑郁症患者组与健康对照组在全局网络属性上的比较Tab.2 Comparison of global network properties between MDD group and HC group
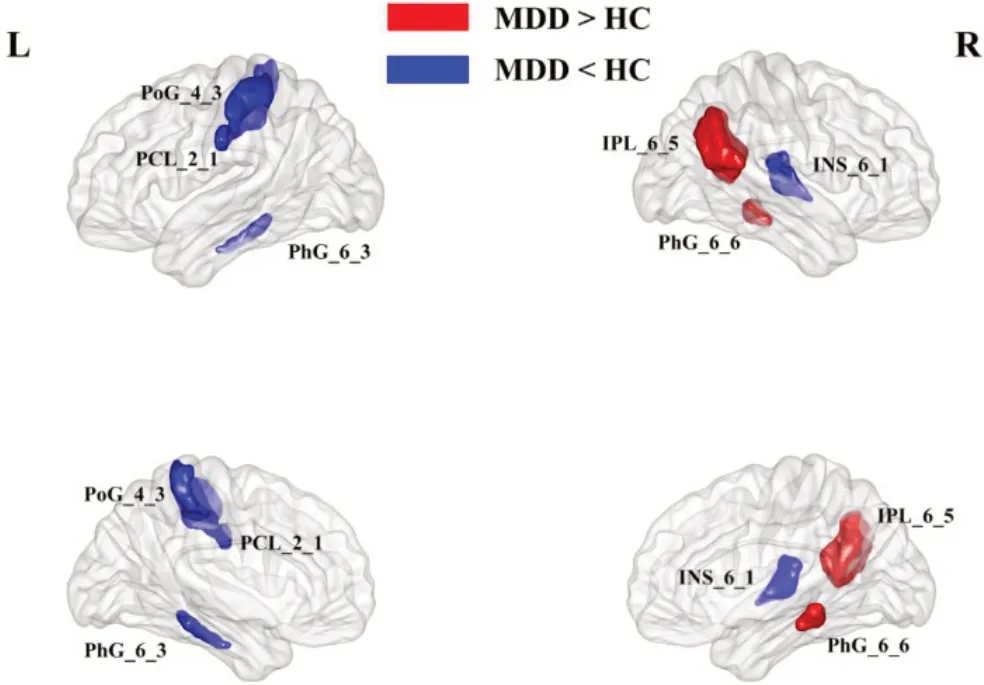
图1 MDD患者组与健康对照组节点度的差异分布图Fig.1 Distribution of nodal degree differences between MDD group and HC group

图2 MDD患者组与健康对照组节点介数的差异分布图Fig.2 Distribution of node betweenness differences between MDD group and HC group
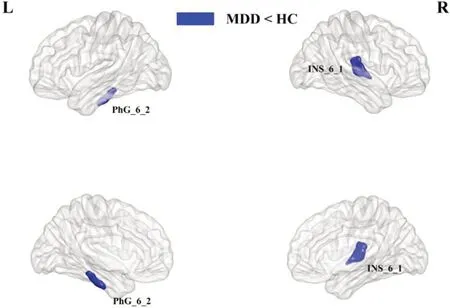
图3 MDD患者组与健康对照组节点效率的差异分布图Fig.3 Distribution of nodal efficiency differences between MDD group and HC group

图4 MDD患者组异常节点属性与临床资料的相关图Fig.4 Correlation between abnormal nodal properties and clinical data in MDD group
3 讨论
本研究采用基于面向脑网络计算的新的脑网络组图谱、扩散张量磁共振成像、确定性纤维追踪以及基于图论的方法,考察了首发‐未服药MDD患者的白质结构网络改变。结果发现,MDD 患者组和健康对照组的脑白质结构网络均存在小世界属性,但在全局网络拓扑属性以及网络的连接上未发现组间差异,而在局部节点网络拓扑属性上具有显著差异,这些差异部位主要位于双侧海马旁回、双侧基底节、双侧顶下小叶、左侧中央后回、左侧中央旁小叶、右侧颞中回、右侧顶上小叶、右侧岛叶、右侧枕叶皮层腹中部、右侧扣带回以及右侧丘脑。进一步的相关分析结果表明MDD 患者在右侧顶上小叶、右侧岛叶的节点介数与病程呈正相关,右侧丘脑、左侧海马旁回的节点介数,左侧海马旁回、右侧顶下小叶的节点度和HAMD评分呈正相关。
人脑是世界上最复杂的系统之一,包含各种不同的脑区以及他们之间相互的解剖或功能连接。在健康人群中,该系统不管在功能磁共振成像还是结构磁共振成像的脑网络研究中均发现存在小世界属性,即与随机网络相比,它具有较短的路径长度、较高的聚群系数。本研究同样发现在MDD 患者组和健康对照组中均存在小世界属性,但并没有发现以上指标及全脑的连接边存在组间差异。这与以往MDD 白质结构网络的大部分研究结果相一致[7‐8]。但也有报道MDD 的脑网络的小世界属性受到了破坏[4‐6]。我们认为其可能的原因如下:首先,来自于样本本身的原因,MDD 是一类异质性较强的情绪障碍性精神疾病,药物和病程是影响结果最重要的两个因素,在研究中采用的是首发‐未服药MDD 患者,病程在两年以内,在理论上受到更长的病程,药物的长期不利的影响,MDD大脑更趋于随机网络,纵向的研究有望进一步去验证此结果;其次,来自脑网络计算方法学的因素,如不同的节点或边的定义对脑网络结果的影响[16],本研究采用精细的脑网络组图谱去定义脑网络计算的节点,理论上更加精细且准确,更加有利于挖掘MDD 网络的异常模式;最后,MDD 在不同的病程中表现出不同的异常全局脑网络模式,在病程的早期有可能受到疾病的影响较少,随着病程的延长,其不利的影响越来越大,更趋于随机网络。今后采集不同病程的数据有望解答此问题。
MDD的局部节点的网络属性,如度、介数或效率受到了破坏,主要发生于双侧海马旁回、双侧顶下小叶、右侧顶上小叶、双侧基底节、左侧中央后回、左侧中央旁小叶、右侧颞中回、右侧岛叶、右侧枕叶皮层腹中部、右侧扣带回以及右侧丘脑。海马旁回参与许多重要的认知功能,如长程记忆、工作记忆以及知觉。既往对于MDD 的结构磁共振成像的研究发现MDD 患者的双侧海马旁回的体积异常[17]。对于首发‐未服药MDD 患者的结构或功能网络研究亦发现海马旁回存在局部网络属性异常[4,6],本研究与之前报告相一致,而且发现了其亚区存在异常,但其具体的神经机制有待于进一步考察。顶叶的联合皮层由顶间沟分为顶上小叶和顶下小叶两部分,顶下小叶在视觉、听觉和运动介导的躯体感觉信息发挥着关键的作用,而且为默认网络的重要节点。而顶上小叶在躯体感觉与视觉运动的整合、运动学习、空间知觉、心理旋转以及记忆等起着重要的作用。既往研究表明MDD 患者不仅在顶下小叶的局部自发的神经元活动异常[18‐19],而且其功能连接中同样发生异常[20‐21]。目前还未发现在网络的水平上MDD 患者的顶下小叶发生改变。具有自杀企图的MDD 患者在右侧顶上小叶磁化传递率降低[22],右侧顶下小叶在MDD中的短程功能连接密度降低[20],对于首发‐未服药MDD 的个体结构网络同样发现右侧顶下小叶的局部节点效率降低[4]。早期的磁共振波谱学及形态学研究均发现MDD 患者的基底节存在代谢和结构上的异常[23‐24],而且静息态的功能磁共振研究发现,MDD 患者在基底节的低频振幅增加[25]。中央后回属感觉运动网络的重要脑区,吸烟使MDD 患者的左侧中央后回的皮层厚度更加变薄[26]。MDD 患者的左侧中央旁小叶局部网络属性异常,与以往的结构磁共振发现灰质体积增加[27],皮层厚度增厚[28]相一致。右侧颞中回、右侧岛叶同属于听觉网络,默认网络和突显网络。局部自发神经元活动研究发现,MDD 患者在右侧颞中回的比例低频振幅增高[29],右侧岛叶和全脑的功能连接存在异常[30]。枕叶皮层的MDD 研究相对较少,脑磁图的源分析发现右侧枕叶与MDD 发生有非常大的关系[31],静息态的研究发现MDD 患者在右侧枕叶的低频振幅降低,可能与小脑的功能连接异常有关系[25]。右侧前扣带回在MDD患者中存在结构或功能上的异常[32‐36],且在白质结构网络上存在异常[7‐8]。有研究表明MDD 与额叶‐纹状体‐丘脑‐皮层的神经环路的异常有关,而且丘脑在其中发生重要作用[37]。我们的研究结果发现在大脑的多个脑区的精细亚区存在网络属性的增高或降低,与文献报道的结构或功能磁共振结果相一致,说明这些脑区在MDD 发生的神经生物学机制中起着双向的调节作用,即相互协同或拮抗作用。
相关分析的结果发现MDD 患者的右侧顶上小叶、右侧岛叶的节点介数降低与病程呈正相关,右侧丘脑节点介数降低,左侧海马旁回的节点介数增加,左侧海马旁回,右侧顶下小叶的节点度增高和HAMD 评分呈正相关。这些节点属性降低或增高的相关性结果更进一步说明这些脑区对于MDD 的发生存在双向调节作用。
本研究尚存在一些不足或局限性需要我们解决。首先,我们构建的结构连接的脑网络是基于确定性纤维追踪的算法进行构建的连接,由于追踪算法的局限性,对于纤维交叉部分的纤维便会停止追踪,会降低计算连接的敏感性,下一步我们将采用概率的纤维追踪有望解决此问题;其次,我们只对病程在两年以内的MDD 患者进行研究,病程对于脑网络结果的影响目前并不清楚,今后将采集不同病程的MDD数据有望解决此问题;最后,我们目前采用的首发‐未服药的样本较少,有可能统计效率不够,今后将在大样本上进一步的去验证本结果。

