巢蛋白与肿瘤发生发展
应勤健,苗贤媛,崔晓颖,龙 丹,付志璇,罗 聪
(1.台州市肿瘤医院内镜中心,浙江 台州 317500;2.宁波市杭州湾医院,浙江 宁波 315000;3.嘉兴学院附属医院,嘉兴市第一医院,浙江 嘉兴 314000;4.中国科学院大学附属肿瘤医院暨浙江省肿瘤医院,中国科学院肿瘤与基础医学研究所,浙江 杭州 310022)
1 巢蛋白(Nestin)的结构及其基本功能
在真核细胞中,细胞骨架包含3个主要的丝状成分:肌动蛋白微丝、微管和中间丝。Nestin是一种Ⅵ类中间丝蛋白,包含1 621个氨基酸,相对分子质量大约为177 400。它由一个短N端(8个氨基酸)、一个罕见的长C端(>1 400个氨基酸)和连接两者的中央杆(α螺旋杆)组成,见图1[1]。其中,α螺旋杆区域由4个线圈(蓝色)及3个连接器(L1,L12和L2)连接而成,而短N端的存在使Nestin需要其他中间丝蛋白,如波形蛋白共同组装成高阶结构[2-3]。
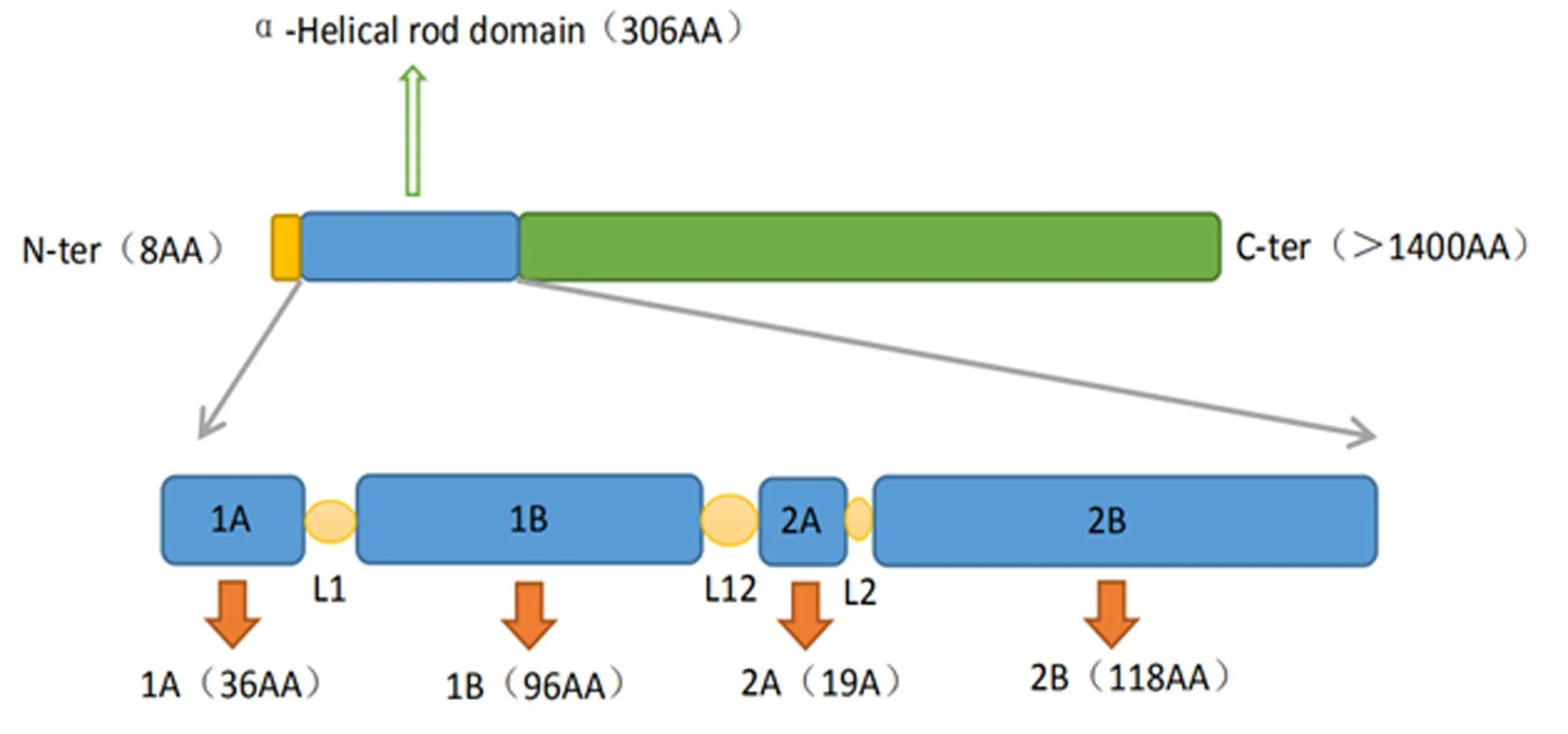
图1 巢蛋白分子的结构 橙色:N端区域的“头”;蓝色:α螺旋杆区的中央杆部;绿色:C端区域的“尾”
Nestin起初单纯被作为神经上皮干细胞的一个标记物,后来也被认为是间充质干细胞(mesenchymal stem cells, MSCs)的标志物之一,但在神经系统以外其他组织细胞也表达Nestin,如胰岛细胞、骨骼肌细胞、睾丸、毛囊以及骨髓的非造血部分等[4-5]。另外,Nestin被发现在心脏修复、血管重构及神经修复等方面也发挥了重要作用。Nestin的上调能够对心肌进行补救性纤维化,在心脏缺血后Nestin阳性神经祖细胞/干细胞迁移到梗死区域参与相应血管生成和神经生成,从而修复受损心肌[6-7]。
近年来,研究发现在多种恶性肿瘤,如神经胶质瘤、肺癌、乳腺癌及结肠癌中,Nestin的表达较正常组织显著升高。肿瘤的生长与转移依赖于肿瘤新生血管形成, 检测肿瘤组织的微血管密度(microvessel density, MVD)不仅可以定量地反映肿瘤血管生长情况, 还能预示肿瘤生长、转移和复发趋势,是一种评估预后的有效方法[8-9]。CD31、CD34和Ⅷ因子是常见的肿瘤血管内皮细胞标志物,常被用作检测MVD,通常CD34较其他两者更敏感,但CD34在肿瘤新生小血管的检测中存在局限性[10]。Nestin被发现在黄体毛细血管内皮细胞和内皮祖细胞增殖中表达显著升高,而成熟内皮细胞中无Nestin表达,并且在肿瘤细胞分泌因子的影响下,Nestin被血管壁周细胞和平滑肌细胞动员到新生血管中,参与血管的稳定,它可能是一种新型的血管标志物,可以特异性识别肿瘤新生血管[11-12]。
2 Nestin与肿瘤
2.1Nestin与胶质瘤 胶质瘤是颅内最常见的恶性肿瘤,恶性程度高、生长快、侵袭性强且容易复发,总体预后差,肿瘤干细胞在胶质瘤的增殖、侵袭和转移中起着重要作用,被认为可能是高级别胶质瘤治疗后复发的根本原因[13]。研究发现Nestin在胶质瘤肿瘤干细胞中高度表达,并且与胶质瘤患者的不良预后密切相关,Nestin可能是胶质瘤肿瘤干细胞的标记物[14-15]。
一项涵盖了Nestin阳性的胶质瘤患者897例和对照的704例meta分析显示,Nestin表达水平与胶质瘤患者组织学分级呈正相关,特别是对于WHO分级Ⅲ级和Ⅳ级以上的胶质瘤患者,Nestin阳性可能提示其不良预后,Nestin被视为胶质瘤患者总体生存期(overall survival, OS)和无疾病生存期(progression-free survival, PFS)的预测指标[13,16]。另外,在胶质瘤小鼠实验中发现,Nestin表达下调可抑制胶质瘤细胞的侵袭和增殖,通过将Nestin shRNA注射至实验小鼠的瘤体内抑制Nestin表达,结果发现实验组小鼠肿瘤生长速度明显低于对照组,阻断胶质瘤中Nestin表达能显著减慢肿瘤的生长速度[17]。胶质瘤肿瘤干细胞中的Nestin可能成为其药物治疗新靶点。
2.2Nestin与肺癌 Nestin的表达水平与非小细胞肺癌(non small cell lung cancer, NSCLC)的分化程度、淋巴结转移、TNM分期、肿瘤大小等相关,并且Nestin可能是NSCLC患者的独立预后因素。一项关于NSCLC和Nestin的meta分析显示,Nestin表达阳性与NSCLC患者OS缩短显著相关,尤其是肺腺癌(adenocarcinoma, AC)和大细胞神经内分泌癌,但在鳞癌(squamous cell carcinoma, SCC)患者中似乎没有观察到这种相关性,这可能与纳入研究的SCC患者过少有关[18-19]。
研究表明,Nestin可通过多条途径介导NSCLC的发生发展,其中Brognard等[20-21]研究发现Akt抑制剂可使Nestin的表达明显降低,通过负调控Nestin的上游靶点SOX2,可以降低Nestin mRNA和蛋白的表达,从而抑制AC细胞增殖和转移。因此,通过Akt- SOX2-Nestin途径抑制Nestin的表达可能为治疗肺癌提供有效的新思路。另外,Nestin也可能通过Nestin-keap 1-Nrf2途径介导NSCLC细胞的抗氧化能力[22-23]。Nrf2是氧化还原平衡的主要调节因子,能促进抗氧化酶的生成,降低Nrf2的表达能起到抗肿瘤的作用及提高化疗的敏感性[24]。当细胞处于氧化应激时,通过Nestin负调控下游因子Keap1,Nrf2的泛素化降解会随之减少,Nestin对肿瘤细胞抗氧化能力的作用正是通过影响Nrf2来实现的。Nestin能与Keap1的Kelch结构域相互作用,与Nrf2竞争性的结合Keap1,形成复合物,从而阻止Keap1对Nrf2的泛素化降解,促进了抗氧化酶的生成。同时,Nrf2的敲除也降低了Nestin的表达,Nrf2可能是Nestin的下游靶基因[25]。
小细胞肺癌(small cell lung cancers, SCLC)患者的肿瘤细胞中也可表达Nestin,其表达水平略高于NSCLC患者,能够抑制SCLC肿瘤细胞的凋亡,敲除Nestin后,SCLC肿瘤细胞侵袭能力明显下降[26]。但目前Nestin SCLC中的研究较少,相关研究的样本量存在限制,有关Nestin在SCLC中的作用仍需进一步探索。
2.3Nestin与乳腺癌 乳腺癌是女性最常见的恶性肿瘤之一,大约25%的早期乳腺癌患者接受(新)辅助化疗后5年内复发,其中三阴性乳腺癌(triple breast cancer, TNBC)是其中预后最差,侵袭性最强的亚型,并且目前临床上治疗手段有限,缺乏特异性生物学标志物。但研究表明,Nestin在TNBC和部分激素受体阳性型乳腺癌中表达明显增加,与其临床病理和免疫组化特征密切相关,可能是TNBC的特异性标志物之一,并且与其预后密切相关[27-28]。研究发现Nestin可能与TNBC肿瘤细胞分化水平、细胞增殖标志物Ki-67表达有关,Nestin和Ki-67表达双阳性可能强烈预示着乳腺癌的侵袭性特征和不良预后[29-30]。另外,在具有高复发风险因素如淋巴结阳性、组织学分级高、疾病进展的TNBC中,Nestin阳性表达水平更高[31-32]。
不仅如此,Nestin或许可作为ER弱表达乳腺癌的一种新型诊断标志物。ER弱表达是乳腺癌一个相对少见的亚群,其特征是ER表达在1%~10%[33]。一部分ER弱阳性病例与腔内肿瘤比较,表现出不同的基因表达模式,这部分患者生物学行可能更倾向于TNBC,预后较ER高表达乳腺癌更差,但目前临床上缺乏特异性免疫组织化学基础标记[34]。研究表明,通过检测Nestin在肿瘤细胞的表达,不论ER表达水平,能够从ER弱阳性乳腺癌患者中筛选出生物学特性倾向TNBC的患者,从而给与及时有效的临床干预[35-36]。
Nestin表达也可能与较高的乳腺癌转移概率密切相关,这一发现为乳腺癌转移后治疗提供了新思路[37]。研究人员构建了乳腺癌脑转移(breast cancer brain metastases, BCBM)的小鼠模型,通过溶瘤病毒靶向杀伤表达Nestin的肿瘤细胞,并释放Vstat120 (BAI1的细胞外片段)后能够显著提升BCBM小鼠的存活率[38]。另外,对Ⅲ期SBG0102临床试验的239例转移性乳腺癌患者预后进行随访,结果发现Nestin表达阳性的患者使用吉西他滨联合多西他赛与多西他赛单药相比,总体生存率明显提高。Nestin/INPP4B可能是核苷类似物在乳腺癌患者中获益的有效预测因子,为临床药物选择提供参考[39]。
2.4Nestin与消化道肿瘤 胃肠道间质瘤(gastrointestinal stromal tumors, GIST)是发生于胃肠道最常见的间叶源性肿瘤,通常把从食管到直肠的非上皮非淋巴造血组织的以梭形细胞分化为主的肿瘤称为胃肠道间质瘤[40]。Nestin可能通过调节线粒体动力学和改变细胞内ROS水平在GIST的发生发展中发挥重要作用,下调Nestin的表达可以将部分GIST患者的肿瘤细胞内线粒体功能状态恢复到非恶性细胞的表型特征[41]。GIST免疫组化结果中CD117和 CD34是诊断GISTs的重要的特异性生物标记物,但敏感度存在限制[42]。大量研究表明,Nestin在GIST中处于高表达状态,是一种较敏感的诊断标志物,与CD117和CD34可以联合检测GIST可提高诊断率,尤其对于部分CD117阴性的GIST患者,Nestin具有重要诊断意义[43]。此外,Nestin与肿瘤分级和肿瘤大小之间存在显著相关性,而与间质瘤良性恶性、细胞异型性、生长速度以及侵袭深度之间没有明显关联,Nestin可能不能作为判断GIST良恶性的有效指标[44-45]。目前对于Nestin在胃肠间质瘤中的作用尚不明确,有待于进一步研究证实。
定位于结肠癌肿瘤小血管的Nestin可能与结直肠癌患者与肿瘤细胞增殖和转移密切相关,随着Nestin表达增加,复发及远处转移风险明显升高,预后越差。有细胞学实验研究发现,Nestin在人结直肠癌(colorectal cancer, CRC)组织中的mRNA表达明显高于正常组织,并且抑制肿瘤小血管内皮细胞中Nestin的表达后,CRC肿瘤细胞的增殖和迁移受到明显影响[46]。Chabowski通过CRC比较Nestin阳性微血管密度(Nestin+ MVD)与CD34阳性(CD34+ MVD)在结直肠癌患者中的预后价值,结果发现,Nestin+ MVD在预测CRC患者疾病复发方面呈阳性趋势,而CD34+ MVD则无此价值,这表明与CD34相比,Nestin的预后价值更高[47]。Nestin可能是CRC中相较CD34更可靠的血管生成评价指标和预后指标。
另外,目前同样在食管鳞癌、胃腺癌以及胰腺癌等消化道肿瘤组织中发现,Nestin表达也有升高的趋势,可能与其增殖、凋亡、迁移和预后密切相关。但Nestin在消化系统肿瘤内的研究偏少,仍需进一步深入研究。
Nestin作为部分肿瘤细胞及肿瘤干细胞中的独特标志物,被认为与胶质瘤、肺癌、乳腺癌等肿瘤生长、迁移、侵袭和转移密切相关,并且参与了肿瘤血管内皮细胞的生长,促进肿瘤血管生成。靶向抑制Nestin能够更好的杀灭肿瘤细胞及肿瘤干细胞而不影响正常细胞,今后可能成为治疗肿瘤的一个新型靶点,产生更多的临床价值,使更多的患者受益。目前Nestin在大部分肿瘤中的作用机制未完全阐明,仍需进一步探索,通过对Nestin在肿瘤中的进一步研究,可以为我们深入研究肿瘤发生发展机制提供方向。

