Spata2-CYLD去ASC线性泛素化抑制NLRP3炎症小体活化
吴丹丹,蒋小丽,张双艳,李文果,杨晓东
(上海交通大学医学院 上海市免疫学研究所,上海 200025)
炎症小体是近年来发现的一类由PRR参与组装的多蛋白复合物。作为固有免疫的重要传感器,它能够识别PAMP和宿主来源的(内源性)危险信号,招募并活化蛋白酶Caspase-1,诱导细胞焦亡和促炎细胞因子IL-1β以及IL-18的成熟与分泌,促进炎症发生[1-3]。目前已有多种可以感知不同上游信号的炎症小体被发现,包括NLRP1、含NACHT-LRR-PYD结构域蛋白3(NOD-like receptor family pyrin domain-containing protein 3, NLRP3)、NLRC4和AIM2等[4]。NLRP3炎症小体由受体NLRP3、接头蛋白凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)和效应蛋白Caspase-1组成,可以被结构和功能迥异的多种外来危险物质如尼日利亚菌素、明矾,以及各种机体异常代谢产物如尿酸结晶、胆固醇结晶和β-淀粉样蛋白等激活[1]。NLRP3炎症小体异常活化会导致一系列自身炎症性疾病,还与糖尿病、阿尔茨海默病、类风湿关节炎和动脉粥样硬化等疾病密切相关[5]。因此,全面理解NLRP3炎症小体活化的调控机制至关重要。
蛋白翻译后修饰,尤其是泛素化,是炎症小体活化的重要调控机制之一[6]。圆柱瘤蛋白(cylindromatosis tumor suppressor protein, CYLD)是一个具有线性连接和K63连接特异性的去泛素化酶[7-8]。最近研究发现,精子发生相关蛋白2(spermatogenesis-associated protein 2, Spata2)与CYLD形成的复合物通过去泛素化NLRP3炎症小体上游调节蛋白Polo样蛋白激酶4(Polo-like kinases 4, PLK4)的K63位点抑制炎症小体活化[9]。有研究表明,线性泛素连接酶线性泛素链组装复合物(linear ubiquitin chain assembly complex, LUBAC)能够直接修饰接头蛋白ASC促进NLRP3炎症小体活化[10]。但是逆转这一过程的去泛素化酶尚不清楚。本研究发现,Spata2-CYLD去泛素化酶能够结合至NLRP3炎症小体并特异性去除LUBAC介导的ASC线性泛素化,从而抑制炎症小体活化,阐示了Spata2-CYLD去泛素化酶复合物负调控炎症小体活化的新机制。
1 材料与方法
1.1 实验细胞人胚胎肾细胞293(human embryonic kidney cell 293, HEK293),购自美国模式培养物集存库。使用含10% FBS和1%抗生素的DMEM培养液,于37 ℃、5% CO2培养箱中培养该细胞。
1.2 实验试剂DMEM培养液,购自康宁公司;FBS和青/链霉素,购自Gibco公司;尼日利亚菌素,购自InvivoGen公司;Hoechst染料,购自Invitrogen公司;Flag-M2微珠和小鼠抗Flag抗体,购自Sigma-Aldrich公司;小鼠抗人Spata2-HRP、IgG-HRP和泛素蛋白(ubiquitin)抗体,购自圣克鲁斯生物技术(上海)有限公司;大鼠抗HA-HRP抗体,购自上海罗氏制药有限公司;兔抗GFP抗体,购自CST公司;小鼠抗人NLRP3和Caspase-1抗体,购自AdipoGen公司;兔抗人线性泛素链抗体,购自默克密理博公司。 HOIP和HOIL表达质粒,购自Addgene公司;ASC点突变构建采用的定点突变试剂盒,购自Stratagene公司。
1.3 质粒的构建带标签的Spata2、CYLD、NLRP3、ASC、Caspase-1和NIMA相关蛋白激酶7(NIMA-related kinase 7, NEK7)表达质粒信息见本课题组已发表文章[9];NLRP3的缺失突变表达质粒,见文献[11]报道。
1.4 免疫沉淀(immunoprecipitation, IP)实验用NP-40裂解液[含50 mmol/L Tris-HCl(pH=7.4)、250 mmol/L NaCl、1 mmol/L EDTA、1% NP-40]于4 ℃冷库裂解细胞20 min;将裂解物与结合抗体的琼脂糖微珠于4 ℃孵育2 h;用裂解液漂洗微珠3次,2×SDS样本缓冲液重悬;于95 ℃变性处理10 min,用于SDS-PAGE和Western blotting检测。
1.5 去泛素化分析变性IP法:用含1% SDS的NP-40裂解液裂解细胞,并用超声波振荡处理细胞裂解液,15 000×g离心后收集上清液,用不含SDS的NP-40裂解液稀释10倍后,与抗体结合的琼脂糖微珠共孵育3 h,裂解液漂洗3次;2×SDS样本缓冲液重悬微珠,于95 ℃变性处理10 min,用于SDS-PAGE和Western blotting检测。亲和纯化方法:将谷胱甘肽硫转移酶(glutathione S-transferase, GST)和人源NF-κB必须调节蛋白(NF-κB-essential modulator, NEMO)的特异结合线性泛素链的Cozi结构域(AA 257~346)[12]与GST的融合蛋白分别于大肠埃希菌菌体内表达并纯化至谷胱甘肽微珠上,然后加至NP-40裂解液制备的蛋白提取液中,于4 ℃孵育2 h;裂解液漂洗3次,加入样本缓冲液如上所述进行变性和Western blotting检测。
1.6 激光共聚焦显微镜成像在HEK293细胞中共转染带mCherry荧光标签的Spata2、GFP荧光标签的ASC、Flag标签的NLRP3和NEK7,8 h后更换新鲜培养液,24 h后加入DNA染料Hoechst进行活细胞染色,用激光共聚焦显微镜(LEICA SP8)进行荧光成像分析。
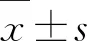
2 结果
2.1 Spata2对ASC线性泛素化的影响Beutler研究组首次建立并证实了在HEK293细胞重建NLRP3炎症小体并分析其活化调控机制的方法体系[13],本课题组在最近的研究中也运用该方法分析NLRP3被泛素化调控的分子机制[9]。本研究继续采用该方法探究Spata2-CYLD对ASC线性泛素化的调控作用。首先,将ASC-GFP与炎症小体其他组分以及Spata2共表达到HEK293细胞中,在变性条件下IP纯化ASC-GFP,Western blotting分析其线性泛素化。用尼日利亚菌素刺激后,与炎症小体其他组分共表达的ASC发生了明显的线性泛素化(泳道2),但是在Spata2共表达的情况下,ASC线性泛素化水平明显下降(泳道3),表明Spata2能够抑制炎症小体激活时ASC的线性泛素化(图1)。

注:于HEK293细胞中共表达ASC-GFP、Spata2以及炎症小体其他组分,变性条件下IP纯化ASC-GFP,Western blotting分析ASC线性泛素化水平。
2.2 Spata2-CYLD去泛素化酶复合物对LUBAC介导的ASC线性泛素化的影响与文献报道相一致,ASC-GFP与线性泛素化连接酶LUBAC (HOIP和HOIL) 共表达时,可检测到依赖LUBAC的ASC线性泛素化(泳道2);同时共表达CYLD时,ASC线性泛素化水平降低(泳道4);同时共表达Spata2和CYLD时,ASC线性泛素化水平进一步降低(泳道5)(图2)。这提示LUBAC介导的ASC线性泛素化可被Spata2-CYLD去泛素化酶复合物去除。

注:于HEK293细胞中共表达ASC-GFP、LUBAC (HOIP和HOIL) 以及CYLD和Spata2,变性条件下IP纯化ASC-GFP,Western blotting分析ASC线性泛素化情况。
2.3 ASC的K21/K22/K24/K26位点对其线性泛素化和NLRP3炎症小体活化的影响为找到ASC线性泛素化发生位点,研究进行了位点突变分析:将赖氨酸突变成不能发生泛素化但理化性质相似的精氨酸,然后与LUBAC共表达。结果显示,赖氨酸K21/K22或者K24/K26位点突变成不能被泛素化的精氨酸R时, ASC几乎不能发生线性泛素化,而所有其他赖氨酸位点的突变并不影响ASC线性泛素化(图3A)。在分析该条件下NLRP3介导的Caspase-1激活情况时,研究发现与线性泛素化相一致,K21/K22和K24/K26位点突变不同程度地抑制了Caspase-1的激活(图3B)。以上结果表明,K21/K22/K24/K26位点对ASC线性泛素化和ASC激活炎症小体而言都是必要的,同时提示Spata2-CYLD去泛素化酶复合物和LUBAC连接酶复合物协同调控ASC这几个赖氨酸位点的线性泛素化/去泛素化进而调控NLRP3炎症小体的活化。
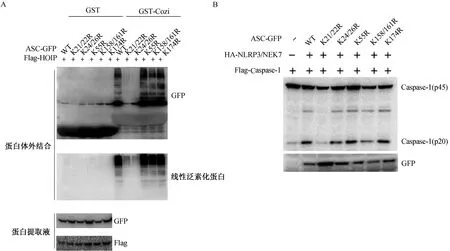
注:A.于HEK293细胞中共表达ASC-GFP及其突变体、LUBAC,GST或GST-Cozi富集线性泛素化蛋白,Western blotting分析ASC的线性泛素化程度;B. 于HEK293细胞中共表达ASC-GFP及其突变体和炎症小体其他组分,分析NLRP3介导的Caspase-1的激活情况。
2.4 ASC与Spata2的共定位情况最近的研究发现,Spata2主要定位于细胞的中心体,并能招募CYLD到中心体发挥调控NLRP3炎症小体活化的功能[9]。为探究Spata2-CYLD如何促进ASC去泛素化,研究进行了激光共聚焦定位分析。与之前的报道一致,带mCherry荧光标签的Spata2主要富集于中心体,呈点状结构;共表达的ASC-GFP也呈点状信号,而且能与Spata2的点状信号较好重叠(图4)。这提示ASC与Spata2在细胞中共定位,这一发现为理解Spata2-CYLD 去泛素化ASC提供了细胞学基础。

注:于HEK293细胞中共表达带红色荧光蛋白标签的Spata2、带绿色荧光蛋白标签的ASC、带Flag标签的NLRP3和NEK7,24 h后加入DNA染料Hoechst(蓝色)进行活细胞染色,用激光共聚焦显微镜进行荧光成像分析。
2.5 Spata2与NLRP3炎症小体的相互作用为进一步阐明Spata2-CYLD调控 ASC去泛素化的分子机制,研究采用IP分析了Spata2与NLRP3炎症小体主要组分的相互作用。在共表达细胞中,Spata2特异地与NLRP3蛋白结合,而不与ASC或Caspase-1结合(图5A)。进一步对NLRP3的缺失突变体分析发现,Spata2主要通过NLRP3的C末端(氨基酸91~710和711~1 034)而不是N末端(氨基酸1~90)与其结合(图5B)。以上结果提示,Spata2-CYLD可能通过NLRP3蛋白结合至炎症小体复合物发挥调控ASC去泛素化的功能。

注:A. 于HEK293细胞中共表达Spata2和炎症小体主要成分,通过Flag-M2微珠IP Flag-NLRP3、Flag-ASC、Flag-Caspase-1,Western blotting(WB)检测与之结合的V5-Spata2;B. 于HEK293细胞中共表达Spata2和NLRP3的缺失突变体, 通过Flag-M2微珠IP Flag-NLRP3,Western blotting检测与之结合的V5-Spata2。FL:full-length protein, 全长蛋白。1~90、91~710、711~1 034分别为NLRP3蛋白的3个不同截断片段(数字为氨基酸位置)。
3 讨论
蛋白质泛素化是一种重要的可逆性翻译后修饰,调节包括炎症和免疫反应在内的许多生物学过程。蛋白质泛素化是在E1、E2和E3 3种酶的催化下把泛素分子共价连接到底物蛋白特定赖氨酸上的酶学过程[14],这一反应过程在同一赖氨酸上的多次重复发生会形成由多个泛素分子组成的泛素链。泛素链在去泛素化酶的催化作用下可被去除。依据连接位点的不同,泛素链可分为K6、K11、K29、K33、K48和K63连接型,以及近年来发现的M1连接形式(又叫线性泛素化)[7]。不同类型的泛素化具有不同的生物学功能,例如K48连接的泛素链会引发依赖蛋白酶体的降解;而非降解性的M1连接的泛素链则调节NF-κB信号通路的激活和固有免疫反应[15]。
目前已知的唯一一个线性泛素化酶E3是由HOIP和HOIL或者SHARPIN组成的名为LUBAC的酶复合物,其中HOIP具有E3活性,是催化亚基,HOIL或者SHARPIN则是必须的调节亚基[16-17]。对于LUBAC和线性泛素化的功能研究最多的是它们对炎症反应和细胞死亡的调控作用[18]。近年来研究发现,LUBAC还能调控炎症小体活化[10,19],它能够特异性线性泛素化接头蛋白ASC,极大促进了NLRP3炎症小体的激活[10]。但是针对线性泛素化ASC的去泛素化酶至今未知。与众多调控炎症小体的E3泛素连接酶相比,有关调控炎症小体的去泛素化酶报道较少。Py等[20]课题组证实BRCC3可去泛素化NLRP3蛋白复合体,而Duong等[21]阐明A20通过逆转IL-1前体的泛素化抑制炎症小体激活。课题组最近的研究揭示接头蛋白Spata2与CYLD调控细胞死亡和炎症反应[22],进一步发现Spata2与CYLD形成去泛素化酶复合物定位于细胞中心体,通过去除NLRP3炎症小体上游调节蛋白PLK4的K63泛素化抑制炎症小体活化[9]。PLK4的K63泛素化能够阻止它与NEK7的结合从而促进NEK7对炎症小体的激活,Spata2与CYLD介导的K63去泛素化则促进PLK4-NEK7结合以及PLK4对NEK7的磷酸化,磷酸化的NEK7失去与NLRP3蛋白的结合能力和对炎症小体的激活作用[9]。这些发现建立了一条定位于中心体的信号通路,通过调控NLRP3上游调节蛋白的泛素化水平调节炎症小体的活化。
本研究结果表明,Spata2-CYLD去泛素化酶复合物能够通过与NLRP3蛋白相互作用结合至炎症小体复合物,去除LUBAC依赖的ASC线性泛素化,抑制ASC介导的NLRP3炎症小体活化(图6)。这一方面揭示了Spata2-CYLD可调控NLRP3炎症小体核心组成蛋白的泛素化,提供了Spata2-CYLD调节炎症小体活化的又一新机制;另一方面首次报道了逆转ASC线性泛素化的去泛素化酶,为NLRP3炎症小体活化调控提供了新认识,为炎症小体相关炎症性疾病的治疗提供了新的潜在策略。
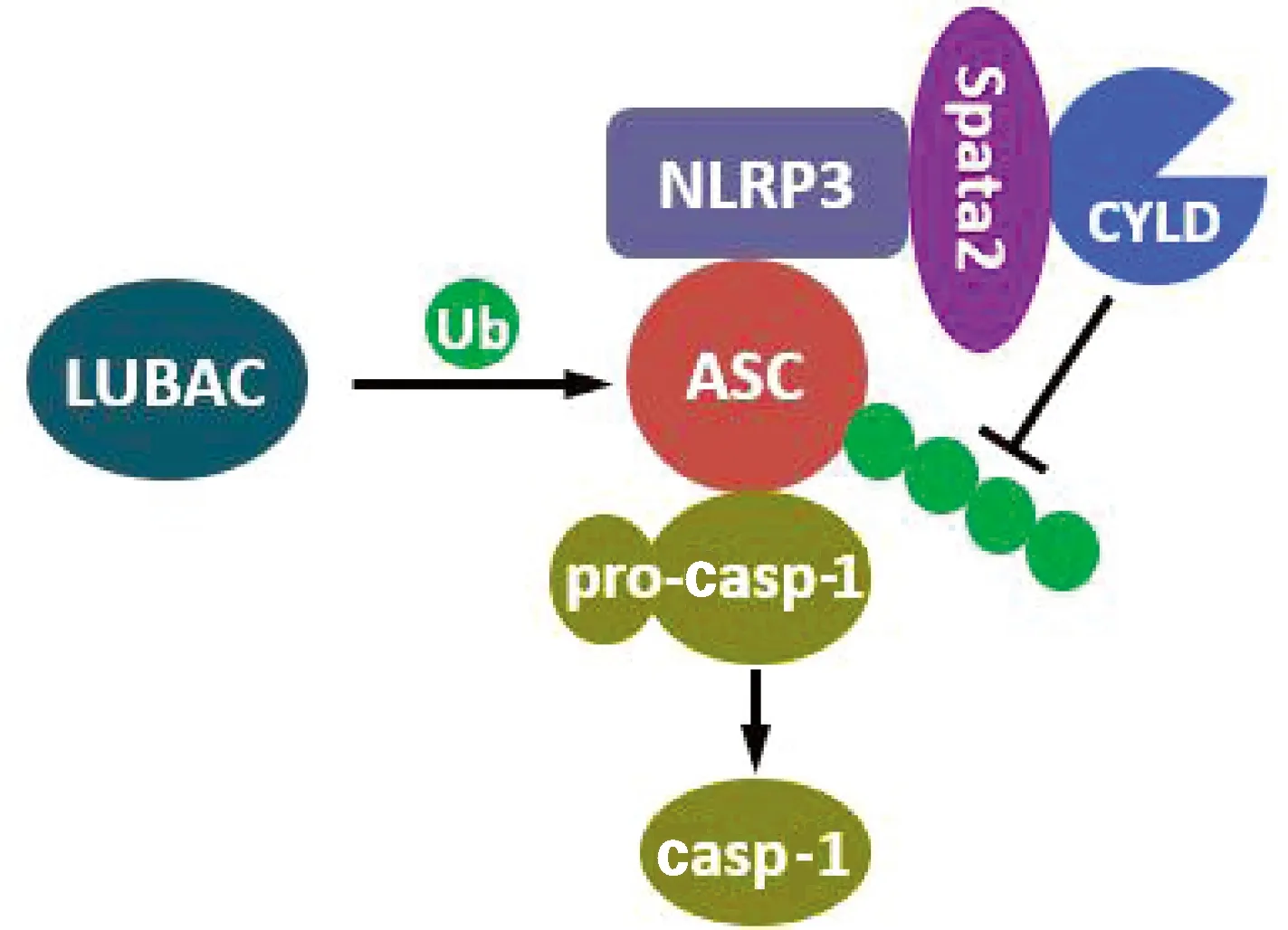
图6 Spata2-CYLD去泛素化酶复合物去除ASC线性泛素化抑制NLRP3炎症小体活化

