感染伯氏疟原虫小鼠外周血淋巴细胞及其表面分子的检测
郑贵星,陈冰霞,张梦欣,金晨曦,谢世豪,齐艳伟
(1.广州医科大学附属第一医院 输血科,广州 511436;2.广州医科大学 第三临床学院,广州 511436;3.广州医科大学 病原生物学与免疫学教研室,广州 511436)
疟疾是由疟原虫引起的传染性虫媒病,其发生发展由宿主和寄生虫的相互作用引起,包括微血管中红内期寄生虫受到的物理阻隔和寄生虫在宿主体内生长、传播过程中释放的有毒产物诱发的局部和全身炎症[1]。另外,机体也会作出一定的反应进行自我防御,这种保护是通过细胞和体液免疫效应机制介导的,尤其是体液免疫,其对疾病血液阶段的发展至关重要[2]。例如,B细胞产生的抗疟疾特异性抗体在限制血液阶段寄生虫繁殖和延缓疾病进展及阻止寄生虫全面感染中发挥关键作用[3]。
小鼠外周血B细胞、T细胞和NK细胞等免疫细胞百分比可反映机体免疫应答水平。其中,NK细胞主要存在于外周血中,其发挥杀伤作用不受外周血抗体等影响[4]。相关研究显示,NK细胞参与宿主抗疟原虫感染[5],且在伯氏疟原虫(Plasmo-diumberghei)血液感染时期含量下降[6]。
作为趋化因子成员之一的CXCR3,有CXCR3-A、CXCR3-B、CXCR3-alt 3种亚型,可在B细胞、T细胞、CD8+T细胞、NK细胞、单核细胞等免疫细胞中表达[7]。CXCR3配体可通过参与激活MAPK、AKT等多种信号通路发挥免疫功能[8];此外,其可与多种配体结合参与免疫细胞的迁移和功能发挥[9]。CD69是细胞表面的一种二聚体蛋白,可在B细胞、T细胞等免疫细胞中表达[10]。CD69在激活后的免疫细胞表面迅速被表达以增加机体IL-2R水平、促进Th1型细胞因子分泌等参与免疫细胞的增殖活化等过程[11]。CD62L是选择素家族成员之一,主要在淋巴细胞、单核细胞等免疫细胞中表达[12],其可参与调节免疫细胞浸润免疫器官、肿瘤局部、炎症部位等协助机体发挥免疫保护作用[13]。
WHO《2018年世界疟疾报告》显示,2017年全球共有疟疾病例2.19亿例,死亡人数也高达43.5万人。而我国2018年的疟疾数据表明已无本地感染病例出现,99.0%的疟疾病例来源于境外输入[14]。这些数据也说明全球的疟疾形势仍不容乐观。同时,目前东南亚使用的抗恶性疟原虫感染的一线药物青蒿素已出现了一定的抗药性[15],这更为人类全面消除疟疾带来严峻考验。因此,现许多学者致力于疟疾疫苗的研究。目前,针对疟原虫的发育周期,相关疫苗主要分为三大类,分别是肝期疟疾疫苗、血液阶段疟疾疫苗以及蚊媒期的传播阻断疫苗[16]。虽然仍未有疟疾疫苗投入临床使用,但这也是防治疟疾的一大有效途径。另外,还可以通过控制病媒预防疟疾,主要措施有使用杀虫剂处理过的蚊帐和室内残留喷雾剂喷洒[17]。为此,本研究检测小鼠B细胞、T细胞、CD8+T细胞和NK细胞百分比及其表面分子CXCR3、CD69、CD62L的表达水平变化,探索C57BL/6小鼠外周血循环中不同的免疫细胞及其表面分子在伯氏疟原虫感染后的功能状态,以此为学界探究疟原虫的致病机制和研发血液阶段疫苗提供新的证据与参考。
1 材料与方法
1.1 实验动物6~8周龄SPF级C57BL/6小鼠,10只,雌性,20~25 g,购自广州中医药大学实验动物中心;伯氏疟原虫ANKA株,由厦门大学李剑博士惠赠,于广州霍夫曼免疫研究所长期保存。
1.2 试剂与仪器Hank's液、PBS和红细胞裂解液,购自生工生物工程(上海)股份有限公司;RPMI 1640基础培养液和FBS,购自Thermo Fisher Scientific公司;小鼠抗CD19-PerCP-Cy5.5、抗CD3-FITC和抗NK1.1-PE-Cy7流式抗体,购自BioLegend公司;小鼠抗CD8-APC-Cy7、抗CD69-Pacific Blue、抗CD62L-APC和抗CXCR3-PE流式抗体,购自Abcam公司。FACSCalibur流式细胞仪,来自美国贝克曼库尔特公司。
1.3 方法
1.3.1 模型鼠的培养 于标准SPF环境中(温度20~26 ℃,相对湿度40%~70%)饲养模型鼠,自由饮食饮水。将10只C57BL/6小鼠随机均分为感染组和对照组(n=5);予感染组小鼠尾静脉注射106个伯氏疟原虫(用100 μL生理盐水稀释),予对照组小鼠尾静脉注射等量生理盐水。实验操作过程符合广州医科大学实验动物伦理委员会要求。
1.3.2 样本的采集 于感染第6天(Day 6, D6)自小鼠眼眶后静脉丛取血1.5 mL,置于离心管中,加入200 μL抗凝剂,充分摇匀,置冰上备用。
1.3.3 小鼠外周血免疫细胞悬液的制备 将采集的外周血与1 mL Hank's液混合,将所得的细胞悬液转移至离心管,600×g离心5 min后弃上清液并重悬。用Hank's液漂洗2次后,每500 μL加入5 mL常温红细胞裂解液裂解红细胞,于室温条件下静置5 min。分别加入5 mL Hank's液终止裂红,600×g离心5 min,弃上清液。加入5 mL Hank's液重悬后,600×g离心5 min,弃上清液。将细胞沉淀转移至RPMI 1640培养液中,用1 mL 5% FBS重悬,通过血细胞计数板计算免疫细胞密度。
1.3.4 小鼠外周血免疫细胞亚群和细胞因子水平的检测 调整细胞密度至每孔100 μL混悬液中含1.5×106个细胞,用200 μL PBS漂洗后600×g离心5 min并弃上清液,用100 μL/孔PBS重悬。按照试剂盒说明书将适量流式抗体加至细胞悬液中,进行15 s的涡旋振荡(混合抗体和细胞)。于4 ℃避光条件下孵育30 min,加入2 mL PBS终止染色并离心(600×g,5 min),弃上清液后漂洗细胞1次;用250 μL上机液重悬细胞。FACS检测染色细胞,通过CytExpert软件分析并得出检测结果。
2 结果
2.1 两组小鼠外周血B、T、CD8+T细胞和NK细胞百分比的比较分离两组小鼠外周血并制备单细胞悬液,FACS检测B细胞(CD3-CD19+)、T细胞(CD3+CD19-)、CD8+T细胞(CD3+CD8+)和NK细胞(CD19-CD3-NK1.1+)百分比。结果显示,感染组小鼠外周血B细胞水平显著低于对照组[(7.28±0.57)%vs(44.49±4.31)%,P<0.01,图1A、1D];感染组小鼠T细胞、CD8+T细胞和NK细胞百分比与对照组相比差异不显著[(33.26±6.65)%vs(35.99±3.45)%,(17.86±5.34)%vs(14.61±3.86)%,(13.32±1.92)%vs(11.75±1.64)%,均P>0.05,图1]。

注: A. 两组小鼠外周血B细胞和T细胞百分比FACS结果;B. 两组小鼠外周血CD8+T细胞百分比FACS结果;C. 两组小鼠外周血NK细胞百分比FACS结果;D. 两组小鼠外周血免疫细胞百分比统计结果。**P<0.01。
2.2 两组小鼠外周血免疫细胞表面CXCR3表达水平的比较FACS结果显示,感染组小鼠外周血B细胞、T细胞表面CXCR3表达水平显著高于对照组[(10.52±0.65)%vs(5.46±1.59)%,(25.44±5.67)%vs(12.45±0.23)%,均P<0.05,图2A、2C];感染组NK细胞表面CXCR3表达水平显著低于对照组[(2.33±0.23)%vs(5.42±1.37)%,P<0.05,图2B、2C];感染组CD8+T细胞表面CXCR3表达水平比对照组高,但差异无统计学意义[(30.13±6.40)%vs(21.29±0.60)%,P>0.05,图2A、2C]。

注:A. 两组小鼠外周血B细胞、T细胞和CD8+T细胞表面CXCR3表达水平比较;B. 两组小鼠外周血NK细胞表面CXCR3表达水平比较;C. 两组小鼠外周血免疫细胞表面CXCR3表达水平统计结果。*P<0.05。
2.3 两组小鼠外周血免疫细胞表面CD69表达水平的比较FACS结果显示,感染组小鼠外周血T细胞、CD8+T细胞和NK细胞表面CD69表达水平显著高于对照组[(25.89±1.89)%vs(1.68±0.56)%,(20.43±3.91)%vs(2.34±1.05)%,(34.58±1.67)%vs(5.28±1.04)%,均P<0.001,图3];而感染组小鼠B细胞表面CD69表达水平高于对照组,但差异无统计学意义[(38.83±2.24)%vs(15.29±15.12)%,P>0.05,图3A、3C]。
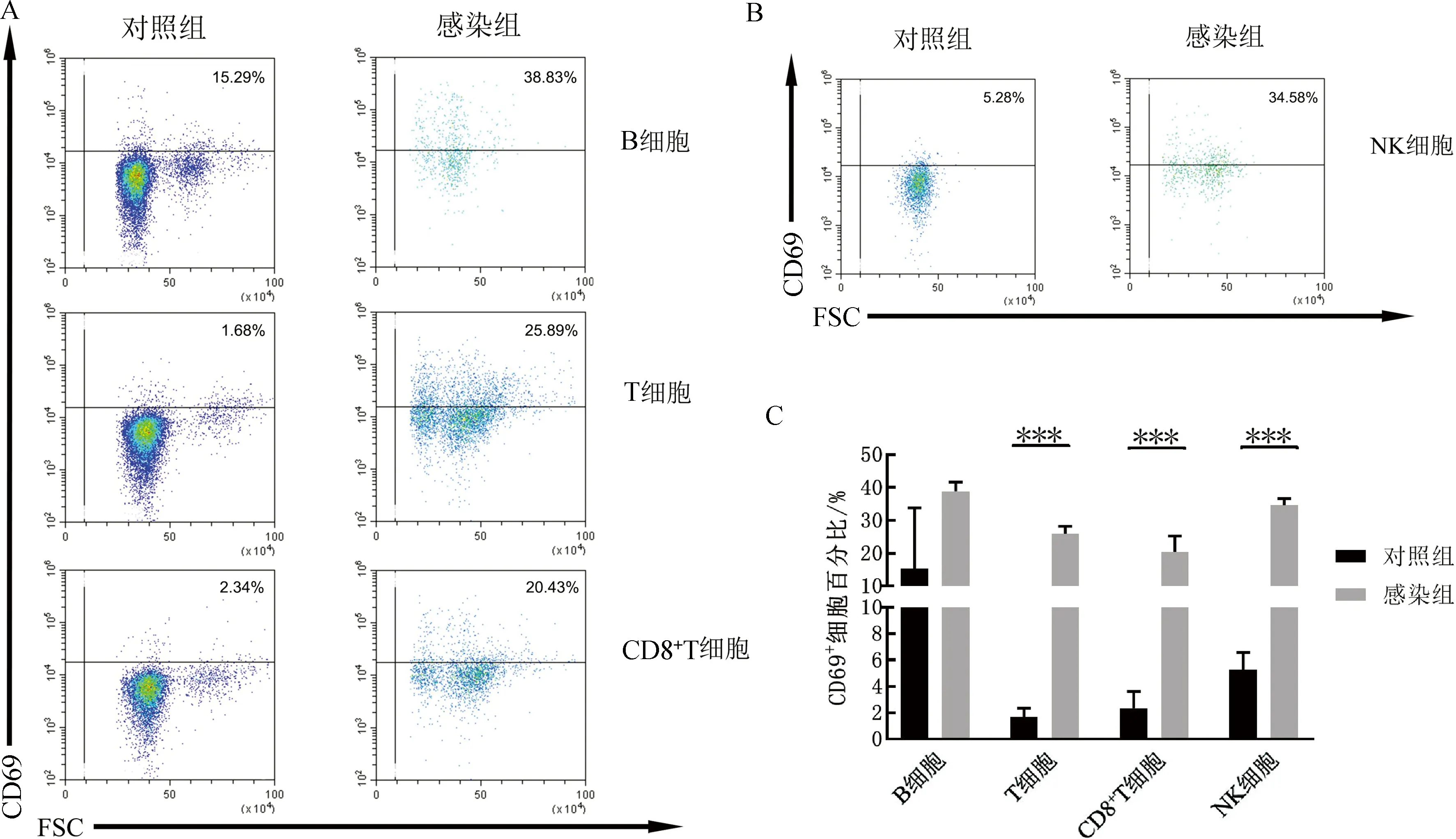
注:A. 两组小鼠外周血B细胞、T细胞和CD8+T细胞表面CD69表达水平比较;B. 两组小鼠外周血NK细胞表面CD69表达水平比较;C. 两组小鼠外周血免疫细胞表面CD69表达水平统计结果。***P<0.001。
2.4 两组小鼠外周血免疫细胞表面CD62L表达水平的比较FACS结果显示,感染组小鼠外周血B、T细胞、CD8+T细胞和NK细胞表面CD62L表达水平显著低于对照组[(32.62±5.73)%vs(92.31±0.49)%,(2.60±0.50)%vs(76.33±8.34)%,(1.80±0.51)%vs(88.07±2.63)%,(0.25±0.06)%vs(14.69±2.37)%,均P<0.001,图4]。

注:A. 两组小鼠外周血B细胞、T细胞和CD8+T细胞表面CD62L表达水平比较;B. 两组小鼠外周血NK细胞表面CD62L表达水平比较;C. 两组小鼠外周血免疫细胞表面CD62L表达水平统计结果。***P<0.001。
3 讨论
有研究表明,在感染伯氏或约氏疟原虫后,小鼠脾脏T细胞百分比明显下降[18-19]。本研究中,小鼠外周血T细胞百分比下降不显著,笔者考虑可能是T细胞在不同组织中的免疫功能状态存在差异所致。另外,CD4+T细胞与CD8+T细胞比值的合理是机体免疫功能稳定的一个重要支点[20]。在同样感染伯氏疟原虫的条件下,小鼠脾脏CD8+T细胞水平明显下降,其表达的CD69水平上升而CD62L下降[18]。本研究中,外周血CD8+T细胞变化不明显,可能与组织样本不同有关,而外周血CD8+T细胞表达的CD69、CD62L变化趋势与其相同,有关因素还需进一步研究。此外,CD4+T细胞和B细胞协同作用产生的抗体是机体抵抗疟原虫红内期感染的关键免疫成分[21]。本研究中,小鼠感染伯氏疟原虫后外周血B细胞百分比显著下降(P<0.01),而其他细胞没有明显变化,考虑伯氏疟原虫感染后D6外周血B细胞可能增殖受抑而不能有效发挥抗感染免疫。
在伯氏疟原虫ANKA虫株感染模型中,脾脏会一定程度上调T细胞表面分子CXCR3表达[6]。本研究中,小鼠感染伯氏疟原虫后外周血B细胞和T细胞的CXCR3分子表达水平显著提高(均P<0.05),而其在NK细胞中表达则显著下降(P<0.05),提示感染伯氏疟原虫后,机体可通过特异性提高免疫细胞CXCR3表达发挥一定的抗感染作用。
之前有研究证实,小鼠肠系膜淋巴结可提高NK细胞、NKT细胞等分泌CD69抵抗日本血吸虫感染[22]。B细胞可在多种致病菌感染条件下表达CD69,如金黄色葡萄球菌感染[23];且有研究表明,外周血免疫细胞CD69表达水平与新生儿早期感染有一定关系[24-25]。本研究表明,感染伯氏疟原虫后小鼠外周血T细胞、CD8+T细胞和NK细胞等CD69表达水平显著提高(均P<0.001),提示机体可能通过促进固有和适应性免疫细胞表面CD69的表达抵抗疟原虫感染。在兰巧芬等[26]的研究结果中,类风湿关节炎患者体内CD62L表达水平提高,其促进了嗜碱性粒细胞向特定组织迁移从而参与致病。此外研究表明,CD62L可能对临床应用中T细胞的筛选有积极帮助,或可拓宽CAR-T细胞的应用范围并有利于抗肿瘤治疗[26]。
由本研究可知,伯氏疟原虫感染后小鼠外周血B细胞、T细胞、CD8+T细胞和NK细胞表面CD62L表达水平显著降低(均P<0.001),提示寄生虫感染后机体或通过下调免疫细胞CD62L表达一定程度上抑制免疫细胞的免疫功能和迁移过程。
——“零疟疾从我开始”

