龙胆苦苷对肿瘤坏死因子-α诱导的HaCaT细胞增殖的抑制作用
赵凯轩,孙丽蕴
(首都医科大学附属北京中医医院,北京 100010)
龙胆苦苷是主要存在于龙胆科植物秦艽中的一种环烯醚萜苷,有多种药理作用,包括抗炎、抗氧化[1]、保肝利胆、镇痛[2]等。银屑病是一种慢性皮肤疾病,与免疫介导的炎性反应密切相关,病理表现为角质形成细胞的过度增殖、血管形成和炎性细胞浸润[3]。血管内皮生长因子(VEGF)A在银屑病的发病机制中起着关键作用,主要由皮肤中活化的角质形成细胞产生。角蛋白(K)17是一种细胞骨架蛋白,是人类上皮细胞增殖的重要标志,与银屑病严重程度呈正相关[4]。龙胆苦苷对银屑病是否具有治疗作用尚不清楚,因此本研究采用肿瘤坏死因子(TNF)-α诱导HaCaT细胞增殖[5],模拟银屑病患者皮损处角质形成细胞异常增殖的病理特征,观察龙胆苦苷处理后细胞凋亡、VEGF A及K17表达情况,探索龙胆苦苷是否抑制角质形成细胞异常增殖并确定其作用机制,为龙胆苦苷在银屑病中的进一步研究应用奠定基础。
1 材料与方法
1.1 试剂与仪器 龙胆苦苷北京中科质检生物技术有限公司;MEM培养基(Minimum Essential Medium,MEM)、胎牛血清美国(FBS)Gibco公司;青链霉素混合液、Annexin V-FITC/PI细胞凋亡检测试剂盒、胰蛋白酶-EDTA消化液(Trypsin-EDTA solution,TRY)Solarbio 公司;TNF-αPEPROTECH 公司;MTT 奥科斯公司,氨甲蝶呤(Methotrexate,MTX)上海源叶生物科技有限公司。ReverTra Ace®qPCR RT master Mix with gDNA Remover试剂盒、SYBR®qPCR Mix试剂盒购自TOYOBO公司。
二氧化碳(CO2)培养箱(MCO-15AC型,SANYO),倒置显微镜(XDS-2B型,重庆光电),超净台(SWCJ-1D型,江苏通净),NanoDroP分光光度计(Thermo Fisher Scientific,美国)。
1.2 细胞株及培养 人永生化角质形成细胞(HaCaT)购自中国医学科学院基础医学研究
所细胞资源中心,在37℃、5%CO2及饱和湿度的培养箱中,以含有10%胎牛血清(FBS)、100 U/mL青霉素和100 μg/mL链霉素的MEM培养基培养,并每隔2~3 d用0.25%的胰蛋白酶消化传代。
1.3 MTT法检测HaCaT细胞活性
1.3.1 TNF-α诱导HaCaT细胞增殖浓度的确定采用MTT法检测不同浓度TNF-α对体外HaCaT细胞增殖能力的影响,分为对照组和TNF-α(2.5、5.0、10.0、20.0、40.0、80.0 ng/mL)组,取对数生长期的HaCaT细胞,消化、计数,以1×105/mL的密度接种于96孔板中,每孔100 μL。培养24 h后,分别加入不同浓度 TNF-α(2.5、5.0、10.0、20.0、40.0、80.0 ng/mL),每组6个复孔。24 h后弃去培养液,加入100 μL MTT(1 g/L),继续培养 4 h,弃上清,每孔加入150 μL DMSO,振荡均匀,用酶标仪在570 nm处测定吸光度值。计算细胞存活率。
1.3.2 龙胆苦苷对TNF-α诱导的HaCaT细胞抑制作用浓度的确定 检测不同浓度龙胆苦苷对TNF-α诱导的HaCaT细胞增殖能力的影响,96孔板放置于细胞培养箱24 h后,弃去培养基,除对照组外其他组加入 10 ng/mL TNF-α 100 μL/孔,24 h 后,移除培养基,阳性对照组(MTX 5 μg/mL),龙胆苦苷治疗组(12.5、25.0、50.0、100.0、200.0、400.0、800.0 ng/mL),每组设6个复孔,培养24 h,步骤同1.3.1。
1.4 流式细胞术检测细胞凋亡 使用Annexin VFITC/PI细胞凋亡检测试剂盒通过流式细胞仪分析确定凋亡细胞。简而言之,将浓度为1×105细胞/孔的HaCaT细胞接种于六孔板中,分为对照组、模型组、MTX 组、龙胆苦苷(100、200、400 ng/mL)治疗组做相应处理,收集细胞,用冷的磷酸盐缓冲液(PBS)洗涤,将细胞重悬于1×Binding Buffer中,然后在室温下于黑暗中用5 μL Annexin V-FITC和5 μL PI溶液染色30 min。上机检测。
1.5 荧光定量聚合酶链反应(RT-PCR)法检测HaCaT细胞VEGFA、K17的表达 用TRIzol试剂从HaCaT细胞中提取总RNA,使用NanoDroP分光光度计检测每个样品中的总RNA浓度。随后,使用ReverTra Ace®qPCR RT master Mix with gDNA Remover试剂盒将1 μg总RNA反转录为cDNA。根据制造商的协议使用SYBR®qPCR Mix试剂盒。PCR反应体系为 20 μL,扩增条件为:95℃预变性 3 min,95℃变性15 s,60℃变性15 s,72℃延伸45 s,共40个循环;溶解曲线:95℃15 s;使用StepOnePlus进行mRNA定量。这项研究中使用的引物是:K17(Forward:5’-TGAGGAGCTGCAGAACAAGA-3’,Reverse:5’-TCTGTAGCAGGATGTTGGCA-3’);VEGFA(Forward:5’-CTGTCTTGGGTGCATTGGAG-3’,Reverse:5’-ACCAGGGTCTCGATTGGATG-3’);GAPDH(Forward:5’-GTCGGAGTCAACGGATTTGG-3’,Reverse:5’-ATCTCGCTCCTGGAAGATGG-3’)。通过 2-△△CT法测定VEGF A、K17经甘油醛-3-磷酸脱氢酶(GAPDH)标准化后的相对表达量。
1.6 统计学方法 采用GraphPad Prism 8软件进行分析,计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 TNF-α诱导HaCaT细胞增殖模型 为确定TNF-α诱导HaCaT细胞增殖的最佳浓度,观察不同浓度TNF-α对体外HaCaT细胞增殖能力的影响见表1、图1,结果表明,与对照组相比,TNF-α 5.0、10.0、20.0 ng/mL组的细胞存活率显著升高(P<0.05),分别为(122.1±4.7)%、(123.7±6.4)%、(113.1±2.6)%,其中TNF-α 10.0 ng/mL组的细胞存活率最高,因此,采用10.0 ng/mL TNF-α诱导细胞增殖,成功建立银屑病增殖模型。

表1 不同浓度TNF-α对HaCaT细胞增殖的影响
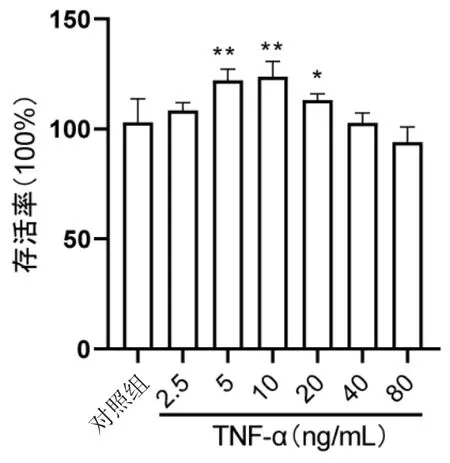
图1 不同浓度TNF-α对HaCaT细胞增殖的影响
2.2 龙胆苦苷对TNF-α诱导HaCaT增殖模型细胞存活率的影响 龙胆苦苷对由TNF-α诱导细胞增殖影响的实验结果见表2,图2、3,与对照组相比,模型组细胞存活率显著升高(P<0.01),与模型组相比,100、200、400、800 ng/mL 的龙胆苦苷作用于 HaCaT细胞存活率均显著降低(P<0.01),与MTX组比较,400、800 ng/mL龙胆苦苷对HaCaT细胞存活率的抑制作用优于MTX 组(P<0.05)。
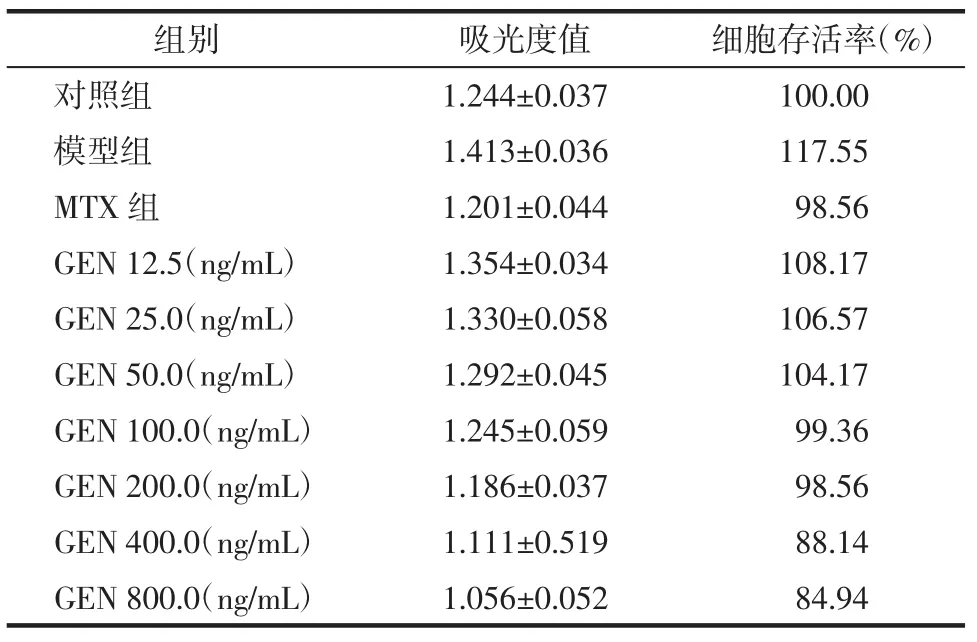
表2 不同浓度龙胆苦苷对TNF-α诱导HaCaT细胞增殖的影响
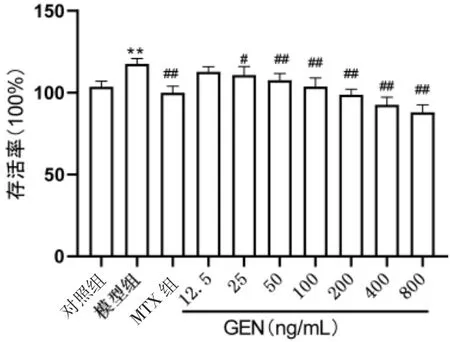
图2 不同浓度龙胆苦苷对TNF-α诱导HaCaT细胞增殖的影响

图3 不同组拍摄的几个随机选择的区域(10×)
2.3 不同浓度龙胆苦苷对TNF-α诱导HaCaT细胞凋亡的影响 对照组、模型组HaCaT细胞凋亡率分别为(9.86±1.15)%、(3.36±0.68)%,MTX 组和龙胆苦苷(100、200、400 ng/mL)治疗组 HaCaT 细胞凋亡率分别为(11.24±0.57)%、(6.07±1.00)%、(9.84±0.59)%、(13.37±0.90)%,6组之间差异有统计学意义(F=36.98,P<0.01)。模型组凋亡率较对照组明显降低(P<0.01)。见表 3,图 4,5。

表3 龙胆苦苷对TNF-α诱导HaCaT细胞凋亡的影响

图4 龙胆苦苷对TNF-α诱导HaCaT细胞凋亡的影响
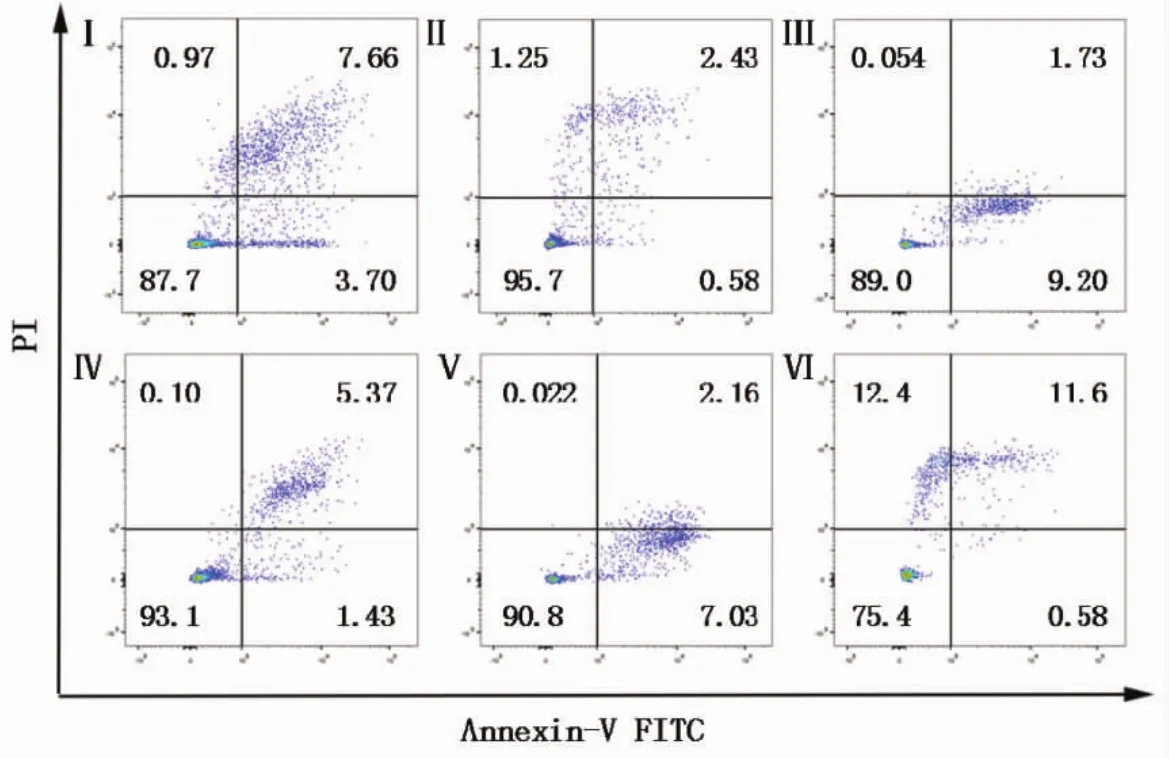
图5 流式细胞仪检测龙胆苦苷对TNF-α诱导HaCaT细胞凋亡的影响
2.3 不同浓度龙胆苦苷对TNF-α诱导HaCaT细胞VEGF A、K17 mRNA表达的影响 龙胆苦苷抑制了TNF-α诱导的 HaCaT细胞 VEGF A见图 6、K17 mRNA见图7表达,用TNF-α处理HaCaT细胞后VEGF A、K17 mRNA 表达增加(P<0.01),与模型组比较,MTX 组、龙胆苦苷(200、400 ng/mL)治疗组的VEGF A mRNA 表达降低(P<0.01),100 ng/mL 治疗组表达差异无统计学意义(P>0.05);与模型组相比,MTX组和龙胆苦苷(100、200、400 ng/mL)治疗组HaCaT细胞K17 mRNA表达降低(P<0.01)。与MTX组相比,龙胆苦苷(200、400 ng/mL)治疗组 HaCaT细胞VEGF A mRNA的表达差异无统计学意义(P>0.05);龙胆苦苷 (100、200、400 ng/mL) 治疗组HaCaT细胞K17 mRNA的表达差异无统计学意义(P>0.05)。
3 讨论
银屑病是一种常见的慢性炎症性皮肤病,影响了全世界约2%的人口[6]。目前银屑病的治疗主要有MTX、环孢素、维A酸类、生物制剂[7]等,这些治疗方法有不良反应大、复发率高或价钱昂贵[8]等弊端,而中医药治疗银屑病在疗效及复发率等方面有明确的优势[9]。秦艽有祛风湿,清湿热的功效,既往研究表明秦艽对银屑病有较好的治疗作用[10-11],龙胆苦苷是秦艽的主要活性成分[12-13],因此探讨龙胆苦苷对TNF-α诱导的HaCaT细胞增殖的抑制作用及作用机制。
TNF-α可以诱导HaCaT细胞达到高增殖状态[13]。因此,在这项研究中,笔者选择了TNF-α共培养的HaCat细胞作为银屑病角质形成细胞的细胞模型,以模拟银屑病角质形成细胞的高度增殖状态。实验结果表明,一定浓度的TNF-α能使HaCat细胞增殖,10 ng/mLTNF-α促进HaCat细胞的增殖速度明显快于对照组,成功建立银屑病增殖模型。
龙胆苦苷作用于TNF-α诱导的HaCaT细胞,发现浓度>25 ng/mL在体外可抑制TNF-α诱导的HaCaT细胞的增殖,随着浓度的增加,对增殖的抑制作用也会增加,并且在400 ng/mL浓度时无细胞毒性。与MTX组相比,100、200 ng/mL的龙胆苦苷作用于HaCaT细胞抑制增殖作用比较差异无统计学意义(P>0.05),400 ng/mL的龙胆苦苷抑制增殖效果优于MTX组,差异有统计学意义(P<0.05)。表明龙胆苦苷对TNF-α诱导HaCaT细胞的增殖有抑制作用。
银屑病角质形成细胞显示出增强的抗凋亡能力,这可能是银屑病发病机制中的关键因素之一[15]。流式细胞仪检测细胞凋亡结果表明,模型组抑制了细胞凋亡,MTX组与龙胆苦苷治疗组促进细胞的凋亡,并且随着龙胆苦苷浓度升高,凋亡细胞百分比增加。
VEGF A目前被认为在包括银屑病在内的多种炎性免疫介导疾病的发病机制中起着关键作用,主要由银屑病患者皮肤中的活化角质形成细胞产生。血管增生是银屑病病变的特征之一,VEGF A是血管生成的有效介质[16],研究表明VEGF A可能影响银屑病疾病进展[17]。K17在银屑病皮损处表皮中过表达,而在健康表皮中无表达,被认为是角质形成细胞增殖的标志,同时被视为治疗目标[18]。本研究通过RT-PCR评估VEGF A、K17 mRNA的表达。结果表明龙胆苦苷可抑制细胞中VEGF A、K17的表达,并且随着龙胆苦苷浓度的升高,抑制作用增强。
本课题成功模拟银屑病角质形成细胞的高增殖状态,在体外实验中,龙胆苦苷可能是通过促进细胞凋亡,降低由TNF-α引起的HaCaT细胞VEGF A、K17表达的升高,从而有效抑制TNF-α诱导的HaCaT细胞异常增殖,龙胆苦苷可能是治疗银屑病的有前途的药物,为下一步体内实验提供了实验基础。

