膀胱内注射A型肉毒毒素治疗脊髓损伤伴自主神经反射亢进的疗效
郑荷依 黄马平 黄天海 杨晓毅 刘秋玲 李青青 陈晖
1广东省工伤康复医院颅脑损伤康复科,广州 510440;2广东省工伤康复医院泌尿外科,广州 510440
自主神经反射亢进(AD)是脊髓损伤患者常见的并发症,特别是在颈段和T6及以上的上胸段脊髓损伤患者[1-2]。AD定义为患者收缩压升高超过20 mmHg(1 mmHg=0.133 kPa)[3]。AD临床表现形式多种多样,包括无症状、病变以上部位发汗等轻度不适,严重时有可能危及生命[4-5]。AD发作的原因85%有可能是膀胱功能障碍引起的,因为膀胱扩张或被称为神经源性逼尿肌过度活动(NDO)的逼尿肌不自主收缩[6-7]。NDO可导致下尿路和上尿路相关并发症,甚至最终导致终末期肾衰竭[8-9]。引起这种临床表现的原因主要是膀胱内高压,因此控制NDO患者较高的膀胱内压力可以提高这些患者的生活质量和预期寿命。在随机安慰剂对照试验中,A型肉毒毒素注射已被证明是一种安全有效的治疗NDO的方法[10-12]。但是很少有关A型肉毒毒素被用于治疗脊髓损伤后AD方面的报道。因此我们进行此项研究,目的是评价膀胱内注射A型肉毒毒素对降低AD发病率和严重程度的疗效。
1 资料与方法
1.1 一般资料选取2018年6月至2019年12月本院接受膀胱内注射A型肉毒毒素治疗逼尿肌过度活动的15例T6及以上脊髓损伤患者,均出现过AD的症状,并在尿流动力学检查期间确诊为AD。其中,男11例,女4例;年龄范围为19~57岁,年龄(38.6±11.9)岁;脊髓损伤时间范围为0.5~17.4年,脊髓损伤时间(4.7±4.3)年;脊髓损伤程度:颈部8例(53.3%),胸部7例(46.7%);美国脊髓损伤协会损伤量表评分分布为:A级8例(53.3%),B级1例(6.7%),C级2例(13.3%),D级4例(26.7%)。纳入标准:(1)18岁以上的慢性脊髓损伤患者(即前3个月神经症状无进展);(2)存在逼尿肌过度活动和AD;(3)对口服抗毒蕈碱药物(奥昔布宁、托特罗定、丙维林、索利那新等)、骨骼肌松弛剂(巴氯芬)和α受体阻滞剂(坦索罗辛、特拉唑嗪等)等药物效果不好或者不能耐受不良反应者;(4)患者签署相关知情同意书并愿意进行随访。排除标准:(1)A型肉毒毒素过敏;(2)凝血疾病和重症肌无力;(3)急性尿路感染;(4)膀胱出口梗阻的其他原因(即尿道狭窄和良性前列腺增生);(5)既往括约肌切开术。本研究经医院伦理委员会批准。
1.2 方法注射在手术室进行,无麻醉或硬膜外麻醉。膀胱充盈100~150 ml无菌生理盐水,以实现充分的可视化,从而避免注射过程中的血管。使用23号针(Cook Urologic Incorporated,Bloomington,IN,USA)通过21F硬式膀胱镜(Ackermann,Schaffhausen,Switzerland)注入逼尿肌约2 mm深。肉毒毒素使用进口的保妥适(Allergan,USA,50 U/瓶)。200 U的A型肉毒毒素溶于30 ml无菌生理盐水中(6.7 U/ml),分30个部位进行注射,每个部位1 ml,每个注射部位间隔约1 cm(避开三角区)。术后留置16 Foley导尿管3~5 d。治疗当天口服预防性抗生素(氨基糖苷除外)。
1.3 观察指标所有患者治疗前均按国际尿控协会标准进行尿动力学检查,在尿动力学期间记录心血管参数,如收缩压,以揭示AD的存在及其严重程度(即收缩压较基线的变化);此外,进行尿失禁生活质量量表(I-QOL)评分,以上指标作为基线评价,注射后1个月复查相同指标[8]。
1.4 统计学分析采用SPSS 13.0软件进行统计分析,计量资料呈正态分布,采用()表示,使用配对t检验,所有统计检验均为双侧检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 治疗前后尿动力参数及尿动力检查期间AD的严重程度比较治疗后患者最大逼尿肌压力较治疗前下降、膀胱容量增加,差异均有统计学意义(均P<0.05);治疗前和治疗后患者尿动力检查进行膀胱灌注之前测得患者的血压差异无统计学意义(P=0.561);治疗后患者尿动力检查期间最大灌注量收缩压和收缩压较基线变化值均较治疗前明显下降,差异均有统计学意义(均P<0.05),见表1。所有患者在注射肉毒毒素前均出现AD(收缩压较基线变化值≥20 mmHg),而在注射肉毒毒素后有8例(53.3%)没有出现明显AD症状,其余7例AD严重程度也有明显减轻。在肉毒杆菌注射前,13例参与者(86.7%)报告至少有1种AD症状,包括鸡皮疙瘩、发冷/刺痛、潮红或头痛;注射肉毒杆菌后,自我报告的症状减少,只有8例(53.3%)出现症状。
表1 15例脊髓损伤患者注射A型肉毒毒素治疗前后尿动力参数及尿动力检查期间自主神经反射亢进的严重程度比较()
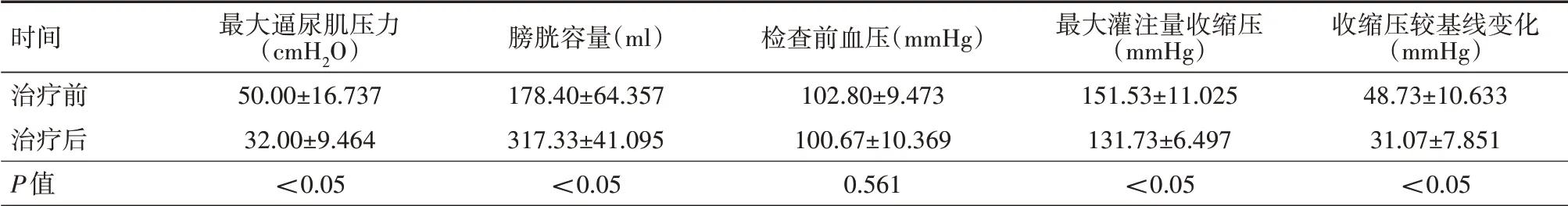
表1 15例脊髓损伤患者注射A型肉毒毒素治疗前后尿动力参数及尿动力检查期间自主神经反射亢进的严重程度比较()
注:1 mmHg=0.133 kPa;1 cmH2O=0.098 kPa
时间治疗前治疗后P值收缩压较基线变化(mmHg)48.73±10.633 31.07±7.851<0.05最大逼尿肌压力(cmH2O)50.00±16.737 32.00±9.464<0.05膀胱容量(ml)178.40±64.357 317.33±41.095<0.05检查前血压(mmHg)102.80±9.473 100.67±10.369 0.561最大灌注量收缩压(mmHg)151.53±11.025 131.73±6.497<0.05
2.2 导尿量和I-QOL评分治疗后每次导尿量和I-QOL评分分别为(343.33±37.161)ml、(77.60±2.694)分,均高于治疗前(196.67±44.186)ml、(48.60±1.642)分,差异均有统计学意义(均P<0.05)。
3 讨 论
脊髓损伤后患者常出现下尿路功能障碍[13-14],由于反复尿路感染和膀胱内逼尿肌压力升高,NDO严重影响患者生活质量和上尿路功能[15]。一线治疗通常是口服抗胆碱能药物降低膀胱内压力,结合清洁间歇性导尿(CIC)排空膀胱。由于治疗效果不理想或者发生严重的不良反应无法耐受,是导致口服药物治疗中止的主要原因。在2000年,Schurch等[16]发表了关于将肉毒毒素注射到逼尿肌中治疗脊髓损伤患者NDO的文章。从那时起,逼尿肌内注射肉毒毒素已成为一种公认治疗NDO的方法[17],然而很少有报道研究其在AD治疗中的应用。
在我们的研究中,注射A型肉毒毒素后,逼尿肌最大压力和顺应性也降低,而膀胱最大容量和膀胱反射容积增加。此外,膀胱相关AD的严重程度和频率也有所降低很明显,这个AD减少的原因可能与A型肉毒毒素的作用机制有关。首先,由于它能够通过阻止副交感神经节后乙酰胆碱的释放而暂时导致逼尿肌麻痹,有效抑制逼尿肌的不自主收缩,从而使引起AD的脊髓介导反应的启动失活[18]。其次可能是通过调节感觉受体的传递,Apostolidis等[19]报道,逼尿肌内注射肉毒毒素可导致支配膀胱的感觉纤维中嘌呤受体(P2X)和辣椒素受体(TRPV1)的表达减少,这种减少与膀胱功能的显著改善暂时相关。并且Elkelini等[20]在动物模型中也显示肉毒毒素对AD有直接作用,不仅降低了神经生长因子(NGF)的浓度,而且减少了AD的发作次数。
此外,尿失禁相关的生活质量评分得到明显的提高。原因有可能是:(1)治疗后患者的导尿量较前增加了,导尿次数有可能减少;(2)患者尿失禁次数比基线检查时有了较大的改善,甚至有少数患者没有出现尿失禁,因此生活质量非常高;(3)最重要的是大部分患者AD的严重程度较术前减轻,更有利于患者进行其他康复治疗,同时这也是有可能威胁高位脊髓损伤患者威胁生命的因素,因此需要引起我们的关注。
利益冲突:作者已申明文章无相关利益冲突。

