非诺贝特通过介导TGF-β1/Smad3信号通路对糖尿病肾病大鼠肾功能的保护作用研究
阮华玲,郭昆全,杨 坤,叶林秀,阎劲松,周丽荣
随着人们生活方式及饮食习惯的改变,糖尿病发生率逐年升高[1]。糖尿病肾病(DN)是糖尿病慢性并发症中较为常见的一种,早期表现为肾脏肥大、肾小球基底膜增厚并伴随以肾小球系膜区为主的细胞外基质(ECM)积聚,随着病情恶化会进一步发展为肾小球硬化及肾小管间质纤维化,引起肾衰竭[2-3]。目前DN的发生机制尚不清楚,但脂代谢异常作为DN发生、发展的主要影响因素,逐渐成为研究的热点[4]。非诺贝特作为过氧化物酶体增殖物激活受体-α(PPAR-α)的特异性激动剂,是一种以降低三酰甘油(TG)为主疗效的降血脂药物[5]。既往研究表明,非诺贝特对于DN模型大鼠的肾功能具有一定保护作用[6],但具体机制尚不清楚。近年研究发现,转化生长因子-β1(TGF-β1)是DN发病的核心因子,能够与多种信号通路作用,来调控DN纤维化进程[7],其中TGF-β1/Smads信号通路在诱导ECM产生的过程中发挥着重要作用[8]。本研究通过高糖高脂饲料饲养联合链脲佐菌素(STZ)腹腔注射构建DN大鼠模型,利用非诺贝特干预探讨其保护DN大鼠肾功能的可能机制。
1 材料与方法
1.1实验动物 30只4周龄SD大鼠,雌雄各半,体质量200~220 g,购于广东省南方医科大学,实验动物生产许可证号:SCXK(粤)2016-0041,SPF级饲养环境常规饲养,全天自由饮水。
1.2主要试剂 STZ、非诺贝特购自美国Sigma-Aldrich公司;高糖高脂饲料购自辽宁长生生物技术有限公司;兔抗大鼠α-平滑肌肌动蛋白(α-SMA)、纤溶酶原激活物抑制剂-1(PAI-1)、金属蛋白酶组织抑制剂-1(TIMP-1)、TGF-β1、Smad3、p-Smad3、Smad7、β-actin抗体购自美国Abcam公司。
1.3动物模型制备、干预及分组 将30只大鼠分为正常对照组、模型组和非诺贝特组,适应性饲养1周后,正常对照组大鼠给予常规饲料饲养,模型组和非诺贝特组大鼠给予高糖高脂饲料饲养。饲养5周后,模型组和非诺贝特组大鼠单侧腹腔注射30 mg/kg STZ构建糖尿病模型[9];72 h后检测空腹血糖(FBG),以FBG≥16.7 mmol/L视为造模成功,继续饲养2周,检测尿量及24 h尿蛋白定量高于造模前2倍即为DN造模成功。非诺贝特组大鼠给予50 mg/kg非诺贝特腹腔注射,正常对照组和模型组大鼠给予等量生理盐水腹腔注射。连续干预8周,实验期间每周检测1次FBG、每2周检测1次24 h尿蛋白定量。
1.4样本采集及处理 末次给药后,留取24 h尿标本,离心后取上清保存;测量各组大鼠体质量,10%水合氯醛麻醉后,取心脏血,离心后取上清保存;利用生理盐水灌注后迅速取出肾脏,剥离包膜称取肾重,并计算肾脏指数(KI),KI=肾质量/体质量×1000;取部分肾皮质,用4%多聚甲醛固定后,常规石蜡包埋切片,剩余肾组织液氮冰冻后于-80℃环境中保存待测。
1.5生化指标检测 取“1.4”中留取的尿标本和血清标本,利用考马斯亮蓝法检测24 h尿蛋白定量,应用DCX800型全自动生化分析仪(美国BECKMAN公司)检测血尿肌酐水平,并计算肌酐清除率(Ccr),Ccr=[尿肌酐×尿液体积/血肌酐]×[1/1440][9];应用DCX800型全自动生化分析仪检测血清样本中TG、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平。
1.6HE和Masson染色观察肾组织病理特点及纤维化程度 取“1.4”中制备好的切片,常规脱蜡脱水后行HE染色,Olympus光学显微镜观察肾组织形态结构,并在每个组织上随机选取至少10个视野,利用Image-pro plus软件计算肾小球面积(GA);另取石蜡切片脱蜡后行Masson染色,肌纤维呈红色、胶纤维呈蓝色,蓝色面积越大表示肾组织纤维化程度越严重。
1.7Western blot法检测肾组织蛋白表达 取“1.4”中冻存的肾组织,液氮中研磨成粉,加入组织裂解液后提取组织总蛋白,BCA蛋白定量试剂盒测定蛋白浓度。取50 μg蛋白样品行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,待溴酚蓝快到胶底部时停止转膜,4℃下用5%的脱脂奶粉封闭处理2 h,加入α-SMA(1︰500)、PAI-1(1︰500)、TIMP-1(1︰500)、TGF-β1(1︰1000)、Smad3(1︰1000)、p-Smad3(1︰1000)、Smad7(1︰1000)、β-actin(1︰1000)孵育过夜;洗膜,加入二抗(1︰200)在37℃条件下恒温孵育1 h后,TBST漂洗40 min,使用ECL试剂盒在DNR BioImaging System上观察膜上蛋白条带,收集影像,采用Image J软件测定各组条带灰度值。
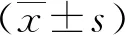
2 结果
2.1各组大鼠肾组织病理及纤维化程度 HE染色结果显示,正常对照组大鼠肾小球结构清晰,形态正常,无异常病理改变;模型组大鼠可见肾组织间质大量炎性细胞浸润,肾小管狭窄、萎缩,近曲小管上皮细胞坏死,肾小管扩张,可见管型;非诺贝特组大鼠较模型组大鼠病变程度减轻,近曲小管好似较少,肾小管结构恢复较好,炎性细胞浸润明显减少。Masson染色结果显示,正常对照组大鼠无明显纤维化改变;模型组大鼠肾组织纤维化程度较为严重,出现肾小球硬化、肾间质纤维化改变;非诺贝特组大鼠较模型组大鼠肾组织纤维化程度减轻。见图1。模型组和非诺贝特组大鼠KI、GA、纤维化程度均明显高于正常对照组大鼠,非诺贝特组大鼠KI、GA、纤维化程度显著低于模型组大鼠,差异均有统计学意义(P<0.05)。见表1。
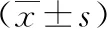
表1 各组大鼠KI、GA、纤维化程度比较

图1 各组大鼠肾组织病理改变及纤维化程度观察(×400)
2.2各组大鼠血尿生化指标比较 模型组大鼠24 h尿蛋白定量、TG、TC、LDL-C显著高于正常对照组,Ccr、HDL-C水平低于正常对照组,差异均有统计学意义(P<0.05);与模型组大鼠相比,非诺贝特组大鼠24 h尿蛋白定量、TG、TC、LDL-C均显著降低,Ccr、HDL-C水平显著升高,差异均有统计学意义(P<0.05)。见表2。
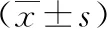
表2 各组大鼠血尿生化指标比较
2.3各组大鼠肾组织中α-SMA、PAI-1、TIMP-1蛋白表达水平比较 与正常对照组大鼠相比,模型组大鼠肾组织中α-SMA、PAI-1、TIMP-1蛋白表达水平显著升高(P<0.05);与模型组大鼠相比,非诺贝特组大鼠肾组织中α-SMA、PAI-1、TIMP-1蛋白表达水平显著降低(P<0.05)。见图2、表3。
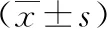
表3 各组大鼠肾组织中α-SMA、PAI-1、

图2 各组大鼠肾组织中α-SMA、PAI-1、TIMP-1蛋白表达图谱 α-SMA为α-平滑肌肌动蛋白,PAI-1为纤溶酶原激活物抑制剂-1,TIMP-1为金属蛋白酶组织抑制剂-1
2.4各组大鼠肾组织中TGF-β1、Smad3、Smad7蛋白表达水平比较 与正常对照组大鼠相比,模型组大鼠肾组织中TGF-β1、p-Smad3/Smad3蛋白表达水平显著升高,Smad7蛋白表达水平显著降低,差异均有统计学意义(P<0.05);与模型组大鼠相比,非诺贝特组大鼠肾组织中TGF-β1、p-Smad3/Smad3蛋白表达水平显著降低,Smad7蛋白表达水平显著升高,差异均有统计学意义(P<0.05)。见图3、表4。

图3 各组大鼠肾组织中TGF-β1、Smad3、Smad7蛋白表达图谱 TGF-β1为转化生长因子-β1
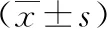
表4 各组大鼠肾组织中TGF-β1、Smad3、Smad7蛋白表达水平比较
3 讨论
DN为一种糖尿病慢性并发症,终末期肾衰竭是引起糖尿病患者死亡的主要原因。随着糖尿病发生率逐年升高,DN的发生率也逐年升高。蛋白尿是DN患者主要的临床特征,而尿蛋白排泄量的增加提示患者肾功能受损,也是目前临床上诊断DN最主要的生化指标[10]。本研究利用高糖高脂饲料饲养联合STZ腹腔注射制备糖尿病大鼠模型[11],造模后通过检测24 h尿蛋白定量增加情况来构建DN模型。研究表明,富含小颗粒的TG及致密LDL氧化、糖化后的脂蛋白具有细胞毒性,通过激活体内TGF-β1的释放,既能激活炎症反应,引起肾组织炎性浸润,又能促进ECM的生成,引起肾脏肥大及ECM进行性积累,造成肾小球硬化[12]。PPAR-α是由配体激活的一类核转录因子,在肝脏中广泛表达,参与脂肪调控过程。非诺贝特是一种PPAR-α激动剂,主要通过激活PPAR-α从而发挥降脂作用[13-16]。除了具有降脂作用外,非诺贝特还具有抗氧化、抗癌、抗炎及抗凋亡等多种生物学活性[17-18]。本研究发现大鼠肾小球结构损伤明显改善,且24 h尿蛋白定量显著降低,Ccr明显升高,可能是因为非诺贝特发挥降脂作用,降低了TG、LDL-C水平,减少了损伤细胞的脂蛋白生成,同时还能发挥抗炎作用减轻肾组织中炎性浸润,从而减轻了对肾组织细胞的损伤。
肾小球硬化及肾间质纤维化是DN肾衰竭主要的病理改变。高血糖、炎症反应、氧化应激等因素均是DN患者肾纤维化的危险因素。ECM的过量积累是引起肾纤维化的主要原因,而肾小管中的ECM主要由成纤维细胞合成,α-SMA是肌成纤维细胞的主要靶标蛋白,其表达水平升高提示ECM分泌功能增强[19]。PAI-1和TIMP-1受TGF-β1信号调控,前者通过抑制纤溶酶原激活物激活减少胶原及糖蛋白的降解[20],而后者则是基质金属蛋白酶(MMPs)的主要抑制剂,能够通过降低MMPs的合成来减少ECM的降解[21],二者表达增强会促进纤维化的进展。本研究结果显示,模型组大鼠肾组织中α-SMA、PAI-1、TIMP-1蛋白表达显著升高,非诺贝特干预后α-SMA、PAI-1、TIMP-1蛋白表达水平显著降低,表明非诺贝特能够抑制ECM的大量生成,从而减缓肾纤维化进程。TGF-β1/Smad3作为调控肾纤维化的主要信号通路,DN发生后诱导TGF-β1合成增加,TGF-β1高表达后与其Ⅱ型受体在胞外结合并使Ⅰ型受体磷酸化,激活下游的Smad2/Smad3,并与Smad4结合后进入细胞核内,从而诱导PAI-1和TIMP-1等相关转录因子表达升高[22]。Smad7作为一种抑制因子,能够与TGF-β1受体结合,抑制Smad2/Smad3转录[23]。本研究结果显示,DN模型大鼠肾组织中TGF-β1、p-Smad3/Smad3蛋白表达水平显著升高,而Smad7蛋白表达水平显著降低,非诺贝特干预后大鼠肾组织中TGF-β1、p-Smad3/Smad3蛋白表达水平显著降低,而Smad7蛋白表达水平显著升高,表明非诺贝特能够通过抑制TGF-β1/Smad3信号通路,降低促纤维化因子表达,从而缓解DN大鼠肾纤维化损伤。
综上,非诺贝特可能通过降低DN大鼠血脂抑制TGF-β1/Smad3信号通路激活,降低促纤维化相关蛋白表达,改善肾纤维化进程,从而保护肾功能。

