乳腺癌P53表达与预后生存时间的相关性
赵建鹏
(河南省三门峡市灵宝市第一人民医院 灵宝472500)
乳腺癌作为一种常见的恶性肿瘤,主要见于女性,我国北方的发病率多于南方。该病的病因包括饮酒、空气污染、遗传、吸烟等因素。近些年来,虽然治疗水平取得了长足进步,但乳腺癌5年生存率仍无显著提高。究其原因主要是因为手术以及化疗后肿瘤复发和转移导致了乳腺癌的治疗失败,尤其处于进展期的患者更容易出现复发的现象。在进行根治术后,大约有一半患者因为发生转移以及复发而死亡[1]。因此想要延长患者的生存期及改善患者的预后,就需要在促进乳腺癌转移和复发机制方面进行着重研究。现代研究表明,肿瘤细胞的增殖最终导致肿瘤细胞的形成,其发生和发展会涉及多环节、多中心以及多通路[2]。目前,肿瘤组织学分类、淋巴结转移状况、原发肿瘤大小等为传统上判断乳腺癌病情的临床指标,但其具有异形的局限性,无法满足对患者预后判断的要求[3]。P53是目前研究最为深入的抑癌基因,由393个氨基酸构成,按结构及功能分成转录激活区、序列特异性DNA结合区、C端寡聚化区、转录调节区,通常情况下上述任何区域的异常都可导致P53功能失活和细胞的恶变[4]。本研究采用免疫组化技术,检测入选病例的乳腺癌组织和癌旁正常组织中P53的表达情况,并结合乳腺癌患者主要的临床病理特征与随访参数,探讨乳腺癌P53表达与预后生存时间的相关性。现报道如下:
1 资料与方法
1.1 一般资料 选取我院2017年8月~2019年4月收治的乳腺癌患者120例为研究对象,患者年龄28~77岁,平均(56.12±3.25)岁。纳入标准:临床诊断为Ⅰ期、Ⅱ期乳腺癌患者;可进行免疫组化研究并保存完好的肿瘤原发灶蜡块患者;随访资料能够完整搜集患者;对本研究知情,自愿参与并签署知情同意书患者。排除标准:合并严重脏器损伤者;术前经过治疗患者。本研究经医院医学伦理委员会批准。
1.2 检测方法 采用免疫组化法检测患者病灶组织标本和癌旁组织标本中P53表达情况。取所有患者的病灶组织标本(观察组)与癌旁组织标本(对照组),组织标本经4%甲醛固定,于浓度梯度酒精中脱水,二甲苯中浸润观察组织块至透明为止。用石蜡Ⅰ(<60℃,1 h)浸润、石蜡Ⅱ(60℃,2 h)包埋后制成石蜡组织块,用石蜡切片机采用5μm厚度连续切片,常规制片、封片。试剂来源:所用试剂P53一抗(兔抗人多克隆抗体)购于美国ProteinTech Group,Inc公司,免疫组化通用试剂盒和显色剂购于武汉博士德生物技术有限公司,其他常规试剂均为国产分析纯试剂。P53一抗最佳的抗体滴度为1:100,每批染色均设立对照组,以PBS代替一抗为阴性空白对照,随机计数5个高倍镜视野(×400),对癌细胞的数目进行统计,同时统计表达阳性细胞数,并观察显色度。阳性强度采用半定量法,按阳性细胞占癌细胞的百分数评分,结果观察采用盲法。
1.3 观察指标 患者的随访时间截止到2020年1月1日,记录患者的生存时间和生存率,同时调查患者的临床病理特征,包括临床分期、淋巴结转移、临床分期、组织学分化、发病位置、肿瘤大小等。统计两组病灶组织标本和癌旁组织标本中P53表达情况。分析P53表达阳性与患者年龄、发病部位、肿瘤大小、临床分期、组织学分化、淋巴结转移的相关性,预后生存时间与P53表达、临床分期、组织学分化、淋巴结转移的相关性,分析患者预后生存时间的影响因素。
1.4 统计学方法 应用SPSS22.00统计学软件分析数据,计数数据以%表示,行χ2检验。采用Spearman相关分析对各指标间相关性进行分析,影响因素采用Logistic回归分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 两组P53表达阳性率对比 观察组P53表达阳性率为10.00%,显著低于对照组的72.50%(P<0.05)。见表1。

表1 两组P53表达阳性率对比
2.2 不同病理特征乳腺癌患者的P53表达阳性率对比 在观察组中,年龄≥54岁与年龄<54岁、发病位置左侧与发病位置右侧、肿瘤直径≥4 cm与肿瘤直径<4 cm患者P53表达阳性率对比,差异无统计学意义(P>0.05);组织学高/中分化与低分化、临床分期Ⅰ期与Ⅱ期、淋巴结转移与未转移患者P53表达阳性率对比,差异有统计学意义(P<0.05)。见表2。

表2 不同病理特征乳腺癌患者的P53表达阳性率对比
2.3 随访情况 所有患者随访时间截至2020年1月1日,生存105例,死亡15例,生存率为87.50%,平均生存时间为(23.21±0.24)个月。
2.4 预后生存时间与临床特征、P53表达的相关性分析 在观察组中,Spearman相关分析显示,预后生存时间与P53表达、临床分期、组织学分化、淋巴结转移都存在相关性(P<0.05)。见表3。
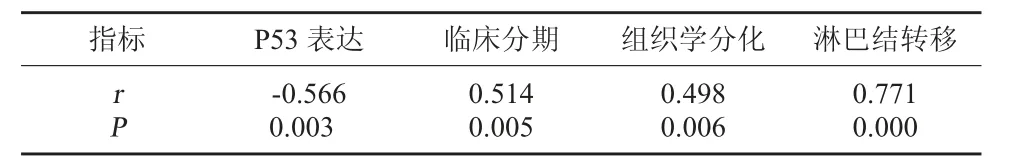
表3 乳腺癌患者预后生存时间与临床特征、P53表达的相关性分析(n=120)
2.5 预后生存时间影响因素分析 此次分析的因变量为预后生存时间,自变量选择P53表达(阳性=1,阴性=0)、临床分期(Ⅰ期=1,Ⅱ期=0)、组织学分化(低分化=1,高/中分化=0)、淋巴结转移(是=1,否=0)等。Logistic回归分析显示,影响预后生存时间的重要因素包括P53表达、临床分期、组织学分化、淋巴结转移(P<0.05)。见表4。

表4 影响乳腺癌患者预后生存时间的多因素分析(n=120)
3 讨论
乳腺癌在临床上较为常见,属于恶性肿瘤之一。患者手术之后,可能会出现复发和转移的现象,这是一个多步骤且多因素的病理过程,具有一定的复杂性。肿瘤转移过程中的每一个环节与不同的作用因素相关,同时也存在多种不同的基因参与。乳腺癌具有相对较长的发生和发展过程,其原因为细胞非正常增殖,在增殖过程较快时,肿瘤的局部组织会发生缺氧并产生一种供能与耗能之间的不平衡状态。
P53在胃癌、食管癌、白血病、肺癌等人类多种恶性肿瘤组织中表达下调或缺失,而这种表达下调或缺失的现象是由于mRNA表达减少或稳定性下降有关。本研究结果显示,观察组的P53表达阳性率为10.00%,显著低于对照组的72.50%(P<0.05)。在观察组中,年龄≥54岁与年龄<54岁,发病位置左侧与发病位置右侧,肿瘤直径≥4 cm与肿瘤直径<4 cm患者P53表达阳性率对比,差异无统计学意义(P>0.05);组织学高/中分化与低分化,临床分期Ⅰ期与Ⅱ期,淋巴结转移与未转移患者P53表达阳性率对比,差异有统计学意义(P<0.05)。在P53基因的抗肿瘤机制中,P53可引起G0/G1期和G2/M期阻滞;P53与参与DNA合成,修复及凋亡的蛋白结合,形成蛋白复合体调节凋亡的发生。当前也有研究显示,P53具有抑制肿瘤分化与浸润发展的作用,也可抑制肿瘤的远处转移。乳腺癌细胞的增殖是一个抑癌基因失活、癌基因激活的过程,已有研究显示P53在病理状态下,其表达会被抑制,这能够对细胞外基质和基底膜的降解进行调节,调节方式可以是直接调节,也可以是间接调节,从而参与恶性肿瘤的转移和浸润过程,从而对乳腺癌患者的病理特征发挥调节作用。此外,研究还表明在接受了化疗的乳腺癌患者中,细胞核内P53蛋白的积聚与局部治疗失败有强相关性,P53的表达水平还可帮助预测乳腺癌化疗的耐药性[5]。
本研究所有患者随访时间截至2020年1月1日,生存105例,死亡15例,生存率为87.50%,平均生存时间为(23.21±0.24)个月;Spearman相关分析显示,预后生存时间与P53表达、临床分期、组织学分化、淋巴结转移都存在相关性(P<0.05);Logistic回归分析显示,影响预后生存时间的重要因素包括P53表达、临床分期、组织学分化、淋巴结转移等(P<0.05)。从机制上分析,P53作为一种潜在的肿瘤转移抑制基因,在人类不同肿瘤中,水平存在差异[6]。若P53发生一定的变化,能够通过微管促使形成癌细胞染色体非整倍性,这在肿瘤发展方面具有一定促进作用。P53表达下降还可以进一步通过调控并加强MMP-13蛋白在癌组织中的过表达或激活,增强了癌细胞破坏和降解周围细胞外基质以及基底膜的能力,更加有助于促进癌组织的浸润、转移[7]。
综上所述,乳腺癌患者P53呈现表达较低的情况,与患者的临床分期、组织学分化、淋巴结转移等存在显著的相关性,也会对预后生存时间的重要因素产生影响。

