苹果LRR-RLK基因家族鉴定和表达分析
黄金凤,吕天星,王寻,王颖达,王冬梅,闫忠业,刘志
苹果LRR-RLK基因家族鉴定和表达分析

1辽宁省果树科学研究所,辽宁营口 115009;2山东农业大学园艺科学与工程学院,山东泰安 271018
【】从苹果全基因组中鉴定LRR-RLK家族蛋白成员,并进行生物信息学和表达模式分析,为研究苹果LRR-RLK的潜在功能提供理论基础。利用BLASTp基于GDR数据库鉴定苹果LRR-RLK家族成员,通过ExPASy Proteomics Server、Cell-PLoc、CD-Search Tool、MEGAX、MG2C等软件分析LRR-RLK蛋白序列基本信息、亚细胞定位情况、结构域组成、系统进化关系以及染色体定位情况。利用实时荧光定量PCR技术检测苹果12个的组织表达和诱导表达特性。苹果LRR-RLK基因家族包含378个成员,这些LRR-RLK蛋白包括318—1 827个不等的氨基酸残基,等电点分布在5.16—9.75。亚细胞定位结果显示LRR-RLK蛋白均定位在细胞膜。系统进化分析可将其分为15类,各亚家族基因数量分布在1—111。染色体定位结果显示,LRR-RLK在苹果17条染色体上均有分布,其中第7条染色体数量最多,为40个。LRR-RLK家族基因具有2个特定的保守结构域,分别是LRR结构和蛋白激酶结构。蛋白二级结构以无规则卷曲为主,其次是-螺旋,-转角所占比例最小。通过定量检测发现筛选的12个家族成员在各组织中均有表达(除MD00G1105400外),且多数基因在茎中表达水平相对较高。低温条件下,7个基因上调表达,其中MD09G1153800上调最明显,最高为对照的6.8倍,而MD06G1170200和MD05G1061600均下调表达;在干旱条件下,8个基因上调表达,其中MD00G1105400上调最明显,最高为对照的9.6倍;在盐胁迫条件下,MD04G1150400、MD13G1108000和MD02G1071800始终处于上调表达状态,其中MD02G1071800上调最明显,最高为对照的14.9倍。苹果新梢接种轮纹病菌后,12个LRR-RLK家族基因表达基本上呈先上升后下降的趋势。并且在‘望山红’中,1 d时表达水平较高,而在‘鸡冠’中,3 d时表达水平较高。MD09G1153800和 MD05G1065800在‘鸡冠’响应轮纹病菌侵染过程中显著上调表达,而在‘望山红’中无响应,可作为进一步开展抗病研究和功能分析的候选基因。苹果LRR-RLK基因家族包含378个成员,进化上可分为15组,在17条染色体上均有分布,多数基因具有在茎中高表达的组织表达特征,多数基因受逆境和轮纹病菌调控。
苹果;LRR-RLK;基因家族;鉴定;表达分析
0 引言
【研究意义】富含亮氨酸重复的类受体蛋白激酶(leucine-rich repeat receptor like kinase,LRR-RLK)是植物类受体激酶家族中最大的一类,在植物生长发育、激素信号传导、非生物胁迫和病原体防御中发挥至关重要的作用[1-4]。对苹果(×Borkh.)富含亮氨酸重复的受体蛋白家族基因进行全面的生物信息学、组织表达特征及逆境胁迫的响应研究,有利于更深入了解LRR-RLK家族基因的功能,并对苹果品种的遗传改良具有重要的参考意义。【前人研究进展】富含亮氨酸受体蛋白激酶含有胞外LRR结构域(2—35个)、单次跨膜区和胞内丝氨酸/苏氨酸激酶结构域[5-6]。LRR-RLK由N-胞外结构域感受胞外信号并将信息经跨膜区传递至C-胞内激酶结构域,使其发生磷酸化或去磷酸化等反应,开启或关闭下游靶蛋白,从而调节植物的生长发育和防卫反应[7]。虽然,植物中存在大量的LRR-RLKs,但大多数LRR-RLK家族成员的生物学功能仍不清楚,而且已进行功能分析的LRR-RLK也大部分局限于模式植物。这源于LRR-RLKs的配基多数未知,且参与信号转导途径复杂[8-9]。在拟南芥()中,识别病原体的鞭毛蛋白后诱发一系列防卫反应,如活性氧爆发、胼胝质形成等,这些防卫反应限制了细菌的生长,从而起到抗病作用[10]。拟南芥的特异识别细菌延伸因子中高度保守的18个氨基酸多肽,用以激活防卫反应[11]。水稻(L.)抗白叶枯病基因,通过识别由细菌细胞分泌的硫酸化多肽引发胞内的抗逆反应[12]。最近的研究发现,参与水稻对白叶枯病菌的响应,并且正调控介导抗病性[13]。在中感白粉病小麦(L.)品种‘扬麦158’中过表达或,能显著增强对白粉病的抗性[14]。是一种重要的植物类受体胞质激酶相关基因,正向调控多条免疫防御反应。而和是介导防御机制的负调节因子。在靠近膜结构域中发现了高密度的-磷酸化位点,可被-磷酸化,发挥负调节作用。竞争性抑制与相互作用,以阻止受体复合物形成[15-16]。表达谱分析显示棉花(L.)的LRR-RLK广泛参与防卫反应[17]。以上研究表明LRR-RLK在植物免疫抗病中起重要调控作用,但是不同LRR-RLK的功能和作用方式可能不同,有的仍需进一步研究。LRR-RLK还参与对干旱、盐等非生物胁迫的响应:过表达可提高玉米(L)在干旱胁迫下的水分利用率和净光合速率,表明在干旱胁迫中起着重要作用[18];水稻的通过调节ROS清除系统、Na+/K+比率和MAPK信号通路实现对盐胁迫的正调控作用[19];在低硝酸盐条件下,通过增加硝酸盐同化作用并上调参与硝酸盐同化的基因,如的过表达促进苹果愈伤组织和拟南芥的生长[20];在冷热胁迫和干旱条件下,水稻均上调表达其启动子区包含与应激反应有关的顺式作用元件,进一步证明参与非生物胁迫耐受性[21]。LRR-RLK还参与生长和发育的形态建成过程:拟南芥的参与木质部纤维中次生细胞壁的形成[22];拟南芥过表达株系比对照株系开花早[23];通过其近膜和激酶结构域与相互作用,在花粉管的极性生长中起关键作用[24];拟南芥中的和既可调节侧根原基发生,也可调节局部侧根的形成,同时可通过响应芽衍生的蔗糖控制侧根延伸。此外,这两种受体的突变都会阻止幼苗对蔗糖作出响应,从而导致侧根较长[25];是一种新型的富含亮氨酸的重复受体样激酶,它通过负调节水稻中生长素的极性转运来影响根系结构[26]。以上研究表明,LRR-RLK广泛参与了植物的防御反应及多种生长发育过程。【本研究切入点】在已有研究中,苹果LRR-RLK基因家族已基于version 1.0版本基因组进行过鉴定分析[9,27]。由于早期版本基因组拼接和注释的质量有限,所以基于更通用的GDDH13 v1.1 版本基因组对LRR-RLK家族进行分析,将会提供更全面准确的鉴定结果[28]。并且苹果LRR-RLK基因家族成员的组织表达特性、生物胁迫及非生物胁迫表达模式未见报道。【拟解决的关键问题】本研究采用生物信息学分析方法,分析苹果LRR-RLK基因家族的成员数量及分类、基因结构、染色体定位及系统进化,通过qRT-PCR技术检测的组织表达特异性和胁迫表达模式,为进一步研究苹果LRR-RLK基因家族的生物学功能,并应用于苹果品种的遗传改良提供理论参考。
1 材料与方法
试验于2019年10月至2020年7月在辽宁省果树科学研究所进行。
1.1 材料与处理
试验材料为种植于辽宁省果树科学研究所苹果育种实验基地的‘望山红’和‘鸡冠’苹果(Borkh.),砧木为平邑甜茶(),以及生长于光照培养箱的‘平邑甜茶’幼苗。
取15年生‘望山红’苹果树的茎、叶片、花(初花期)、果实(花后30 d),液氮速冻后置于-80℃超低温冰箱贮藏,用于的组织表达分析。
取‘平邑甜茶’种子,催芽后播种于装有混合基质的纸杯中,置于人工气候箱培养(温度25℃,光照16 h/黑暗8 h)。选取生长状况较为一致的1个月大幼苗。分别用300 mmol∙L-1NaCl和10%的PEG浇灌根系,以及用4℃低温处理‘平邑甜茶’幼苗。以上各处理培养0、6、12、24和48 h时分别全株取样。每个时间点取实生苗5株,设置3个生物学重复。液氮速冻,-80℃贮藏备用,用于开展非生物胁迫诱导表达分析。
在田间选取长势一致的2年生抗病苹果品种‘鸡冠’和感病品种‘望山红’新梢,长度约15 cm,用于轮纹病菌接种试验。轮纹病病原菌()由笔者课题组分离纯化获得。配置浓度为1×105个/mL病菌孢子悬液,用10 cm长的滤纸条蘸取孢子悬液,包裹于苹果新梢上,保湿培养。于0、1、3和5 d分别取新梢接种部位的韧皮部。每个处理取5条新梢,设置3次生物学重复。液氮速冻,-80℃贮藏备用,用于开展的轮纹病诱导表达分析。
1.2 苹果LRR-RLK家族成员进化分析及基本性质
苹果全基因组数据下载于蔷薇科基因组数据库GDR(http://www.rosaceae.org/)。拟南芥()LRR-RLK蛋白序列下载自拟南芥在线信息资源TAIR(http://www.arabidopsis.org/)。以拟南芥数据库中225个已知LRR-RLK蛋白为问询序列,利用BLAST(http://ncbi.nlm.nih.gov/blast/executables/)软件逐一比对,检索本地苹果数据库中LRR-RLK蛋白,并删除重复序列[9]。对初步鉴定获得的候选基因,利用保守域预测软件Pfam(https://pfam.xfam.org/)和SMART(http://smart.emblheidelberg.de/)进行分析,确保上述候选基因同时含有胞外LRR结构域、跨膜区和胞内丝氨酸/苏氨酸激酶结构域。利用MEGA X(http://www.megasoftware.net)软件,以最大释然法(Maximum Likelihood)构建进化树,通过分析,选择WAG+G+F模型、部分删除(Partial deletion)和1 000次重复(Bootstrap replicated 1 000 times)。并利用在线软件iTOL(https://itol.embl.de/)对系统发育树进行可视化展示。
采用ExPASyProteomics Server(http://web.expasy. org/protparam/)在线分析苹果LRR-RLK蛋白氨基酸序列长度、分子量和等电点。利用在线软件Cell-PLoc(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)进行亚细胞预测分析。
1.3 苹果LRR-RLK基因结构及染色体定位分析
利用MG2C(http://mg2c.iask.in/mg2c_v2.1/)工具进行基因染色体位置可视化分析。采用GSDS 2.0(http://gsds.gao-lab.org/)绘制基因结构图。
1.4 苹果LRR-RLK家族基因motif及结构域分析
鉴于苹果LRR-RLK基因家族数目较多,为了便于展示,选取数目中等的III亚家族蛋白(50个)进行motif与结构域分析。其中motif分析利用在线软件MEME(http://meme-suite.org/tools/meme)进行,基序数量设置15个,其余参数默认。利用在线工具Conserved Domains(https://www.ncbi.nlm.nih.gov/ Structure/cdd/wrpsb.cgi)对苹果LRR-RLK蛋白保守结构域进行分析。
1.5 苹果LRR-RLK蛋白二级结构分析
因LRR-RLK家族蛋白数目庞大,每个亚组随机选出1个代表,共21个,利用在线分析工具SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对蛋白质二级结构进行预测。
1.6 实时荧光定量分析
采用CTAB法,选取‘望山红’苹果树的根、茎、叶、花、果不同组织,4℃低温、10% PEG和300 mmol∙L-1NaCl处理不同时间点取样的‘平邑甜茶’苹果幼苗,以及轮纹病菌侵染的‘望山红’与‘鸡冠’新梢韧皮部组织提取RNA。使用HiFiScript gDNA Removal cDNA Synthesis Kit试剂盒(CW2582,康为世纪),将RNA反转录成cDNA供荧光定量使用。利用琼脂糖凝胶电泳检测RNA完整性,Thermo Nano Drop 2000仪器检测浓度和质量。选取前期研究的转录组测序抗(‘望山红’)/感(‘鸡冠’)轮纹病材料差异表达基因(未发表)12个,推测这些基因在生长发育与逆境胁迫中发挥重要功能,开展荧光定量表达分析。利用Primer 5.0软件设计引物,所有引物特异性均经过NCBI的Nucleotide BLAST和Primer-BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)验证。实时荧光定量PCR引物序列见表1,选用作为内参基因[29]。试验仪器为QuantStudio™ 6 Flex荧光定量PCR仪(Thermo公司)。反应体系:SYBR Green(CW2601,康为世纪)10 μL,10 μmol·L-1的上、下游引物(生工生物工程有限公司)各0.4 μL,ddH2O 7.2 μL,cDNA 2 μL,总体积20 μL。反应条件为:95℃预变性10 min;95℃变性15 s,60℃退火1 min,40个循环。每个处理3次重复。试验所得数据采用2-ΔΔCT计算,利用SPSS 18.0进行差异显著性分析,显著性水平为<0.05,并用Excel作图。

表1 实时荧光定量引物序列
2 结果
2.1 苹果LRR-RLK家族成员进化分析及基本信息
2.1.1 苹果LRR-RLK成员进化分析 从苹果基因组序列中鉴定得到378个LRR-RLK家族成员。为分析蛋白间的系统进化关系,采用MEGAX软件对378个苹果和225个拟南芥的LRR-RLK蛋白序列进行比对分析和系统进化树构建。如图1所示,根据亲缘关系远近将所有LRR-RLK蛋白分成15组(I—XV),进一步细化可分成21个亚组。在苹果中成员最多的为XII亚家族,包含111个基因;其次为XI-1亚家族,包含74个成员;然后是III亚家族,包含50个成员;而XIIIb亚家族成员最少,只包含1个蛋白。
2.1.2 苹果LRR-RLK成员基本信息 通过保守域预测软件Pfam和SMART分析表明,所有鉴定出的378个LRR-RLK均具有N-末端LRR结构域、跨膜结构域和C-末端Pkinase结构域。各亚家族基因数目差异较大,从1—111个不等。其序列氨基酸数目、分子量、等电点和LRR数分别介于318—1 827、34.95— 199.33、5.16—9.75和1—20(表2)。利用在线软件CELLO v.2.5对所有基因成员进行亚细胞定位预测分析,发现均定位于细胞质膜。
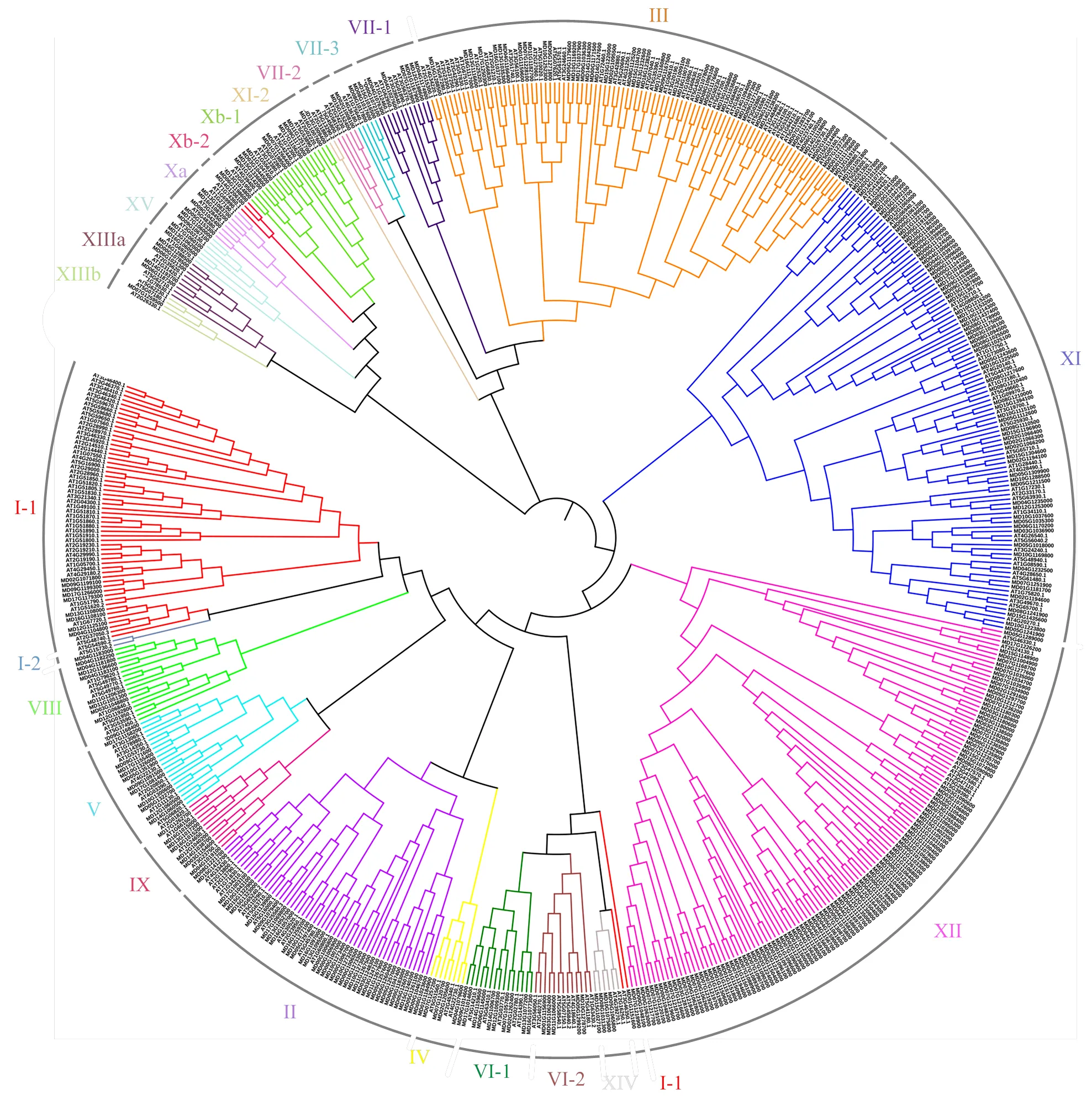
图1 苹果LRR-RLK基因家族的系统进化树
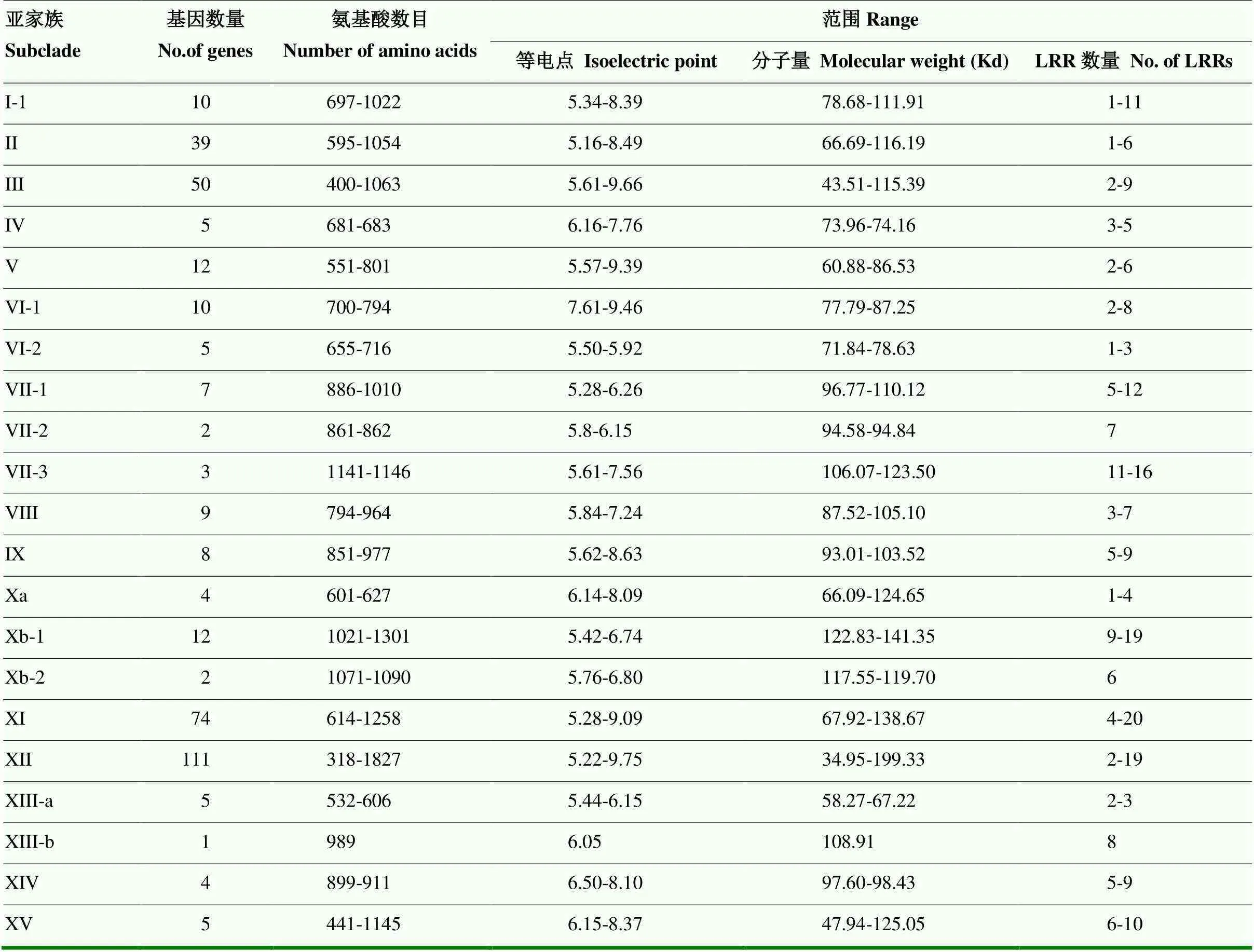
表2 苹果LRR-RLK家族成员信息
2.2 苹果LRR-RLK家族染色体定位及结构分析
如图2所示,LRR-RLK基因家族的378个成员在苹果的17条染色体上均有分布。7号染色体(Chr 07)分布的LRR-RLK成员最多,为40个,其次为5号染色体(Chr 05),共29个成员,且基因大多分布在染色体下端;定位在6号染色体(Chr 06)的LRR-RLK最少,仅包含7个成员。
因苹果LRR-RLK家族数目较庞大,每个亚家族随机选一个基因,共21个,经在线软件GSDS 2.0对其进行可视化分析。由图3可知,该家族基因结构相对复杂,外显子数量从1—27,内含子子数目0—26。氨基酸在外显子上的分布位置差异较大,序列的长度也各不相同,推测不同亚族之间功能上可能差异较大。
2.3 III亚家族motif及结构域分析
2.3.1 III亚家族motif分析 由于苹果LRR-RLK基因家族成员数目较多,选取数目中等的III亚家族为代表,利用MEME在线工具开展motif分析。经分析得到15个保守基序,50个基因的motif分布(图 4)存在以下规律:顺序为motif 14-motif 11-motif 9-motif 10-motif 12-motif 1-motif 15-motif 7-motif 4-motif 5-motif 8-motif 13-motif 2-motif 6-motif 3。III亚家族成员motif 1—motif 15比例分别为100.0%、92.0%、82.0%、88.0%、96.0%、74.0%、100.0%、94.0%、100.0%、100.0%、100.0%、74.0%、78.0%、72.0%、94.0%。由此可知III亚家族成员结构相似且较为保守,可能在苹果的生长过程中发挥相似的功能。对每个motif分析发现,motif 1和motif 13均含有29个保守氨基酸,而motif 15含保守氨基酸较少,只有11个。III亚家族最主要的motif 有5个,分别为motif 1、motif 7、motif 9、motif 10和motif 11。N端均含有3个LRR结构保守核心氨基酸残基:XXLXLXX(motif 14、motif 9和motif 11)。
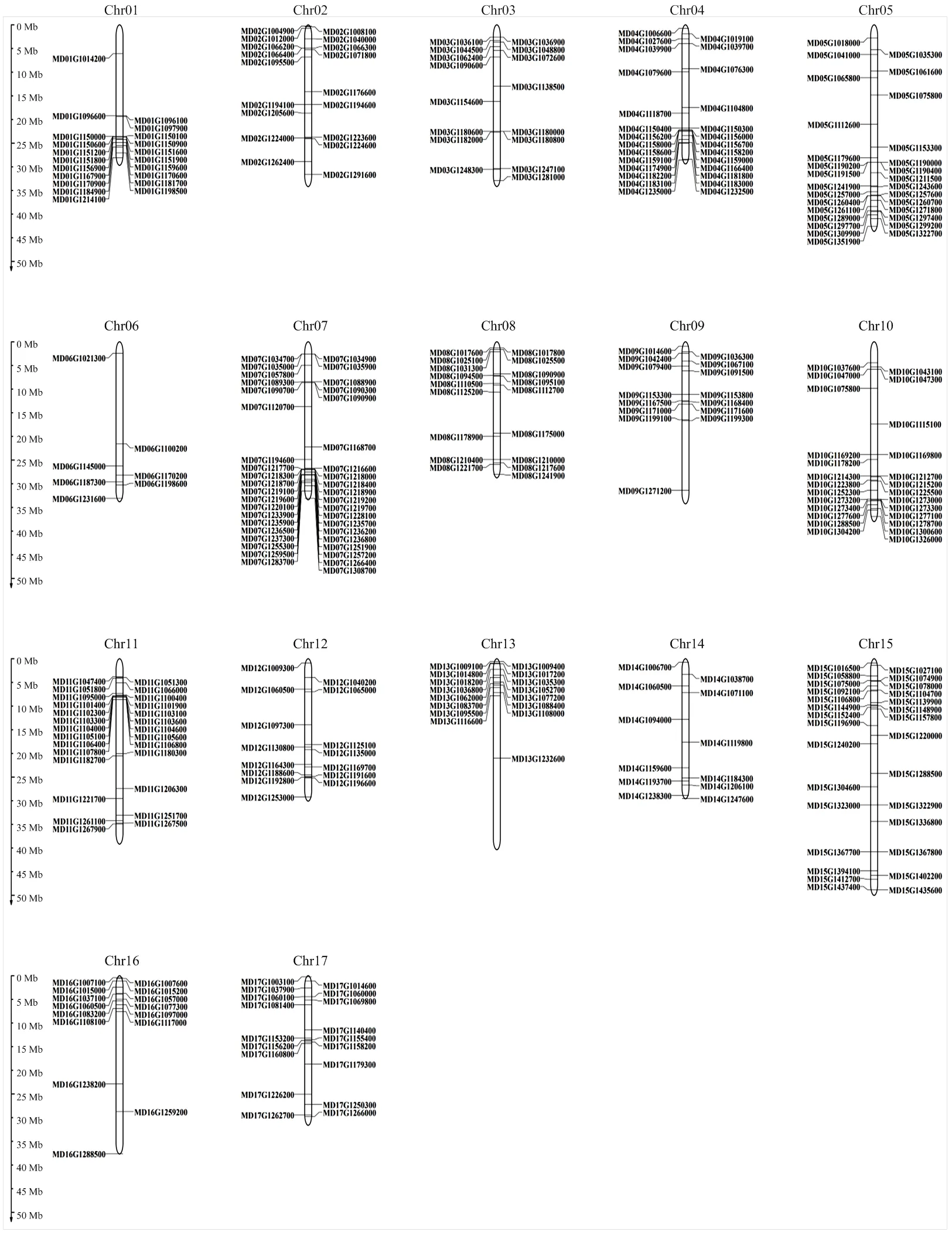
图2 苹果LRR-RLK基因家族染色体定位分析
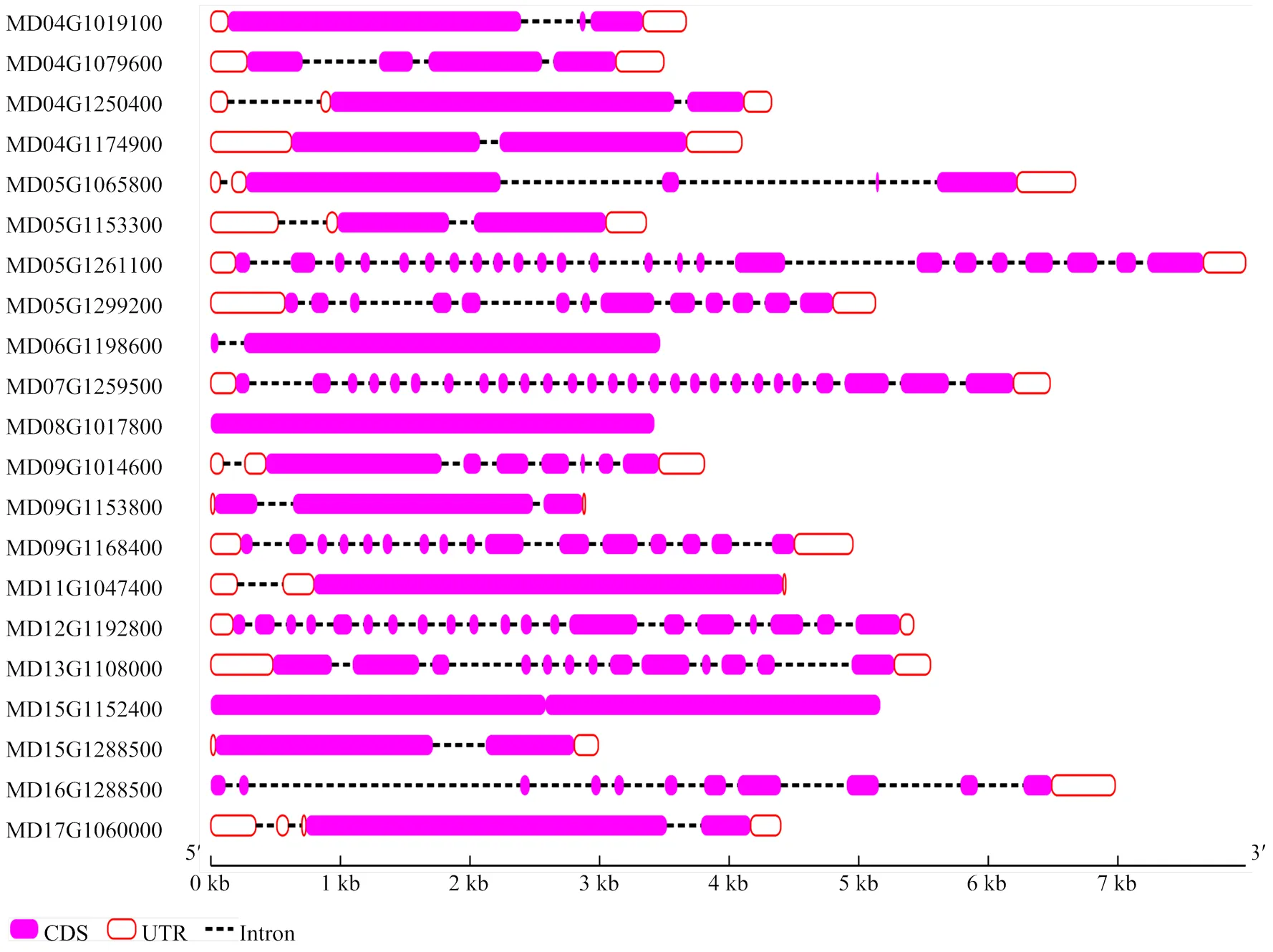
图3 苹果LRR-RLK家族基因结构
2.3.2 III亚家族保守结构域分析 III亚家族基因主要结构域有3个,包括LRRNT-2、PLN00113超级家族和PKc-like超级家族(图5)。对比图5的motif与图7的结构域可知motif 14-motif 11-motif 9-motif 10-motif 12-motif 1-motif 15-motif 7-motif 4-motif 5- motif 8-motif 13-motif 2-motif 6-motif 3属于PLN00113超级家族,而其中的motif 1-motif 15-motif 7-motif 4- motif 5-motif 8-motif 13-motif 2-motif 6-motif 3又属于PKc-like超级家族。
2.4 蛋白质二级结构分析
利用在线软件SOPMA对21个亚家族代表LRR-RLK蛋白进行二级结构预测,结果见表3。所有蛋白质二级结构都以螺旋和无规则卷曲为主,其中螺旋占26.88%—41.63%,无规则卷曲占38.59%— 52.26%,此外二级结构中还包含转角(占1.80%— 7.75%)和延长链(占11.3%—19.48%),两者所占比例较小。
2.5 苹果LRR-RLK表达分析
2.5.1 组织表达分析 利用qRT-PCR技术分析12个在苹果茎、叶、花和果实中的表达情况(图6),引物见表1。除MD00G1105400外,其余11个基因在各组织中均有表达。MD03G1138500、MD05G1061600、MD13G1108000、MD05G1261100、MD02G1071800和MD15G1288500主要在茎中表达,MD06G1170200、MD03G1036900和MD05G1065800主要在花中表达,MD04G1150400主要在果实中表达。
2.5.2 非生物胁迫下的表达分析 利用qRT-PCR分析‘平邑甜茶’苹果LRR-RLK基因家族中12个代表基因分别在4℃、10% PEG以及300 mmol∙L-1NaCl处理下的相对表达量(图7)。
4℃处理下,MD09G1153800、MD04G1150400、MD03G1138500、MD06G1170200、MD03G1036900、MD05G1061600、MD00G1105400至少在其中一个时间点发生了差异表达。在以上差异表达的中,MD09G1153800上调表达最为明显,在4℃处理6 h后表达量为对照的6.8倍。而MD06G1170200和MD05G1061600在0—48 h均下调表达,表达量不到对照的20%,推测两者可能在响应低温时起到负调控作用。
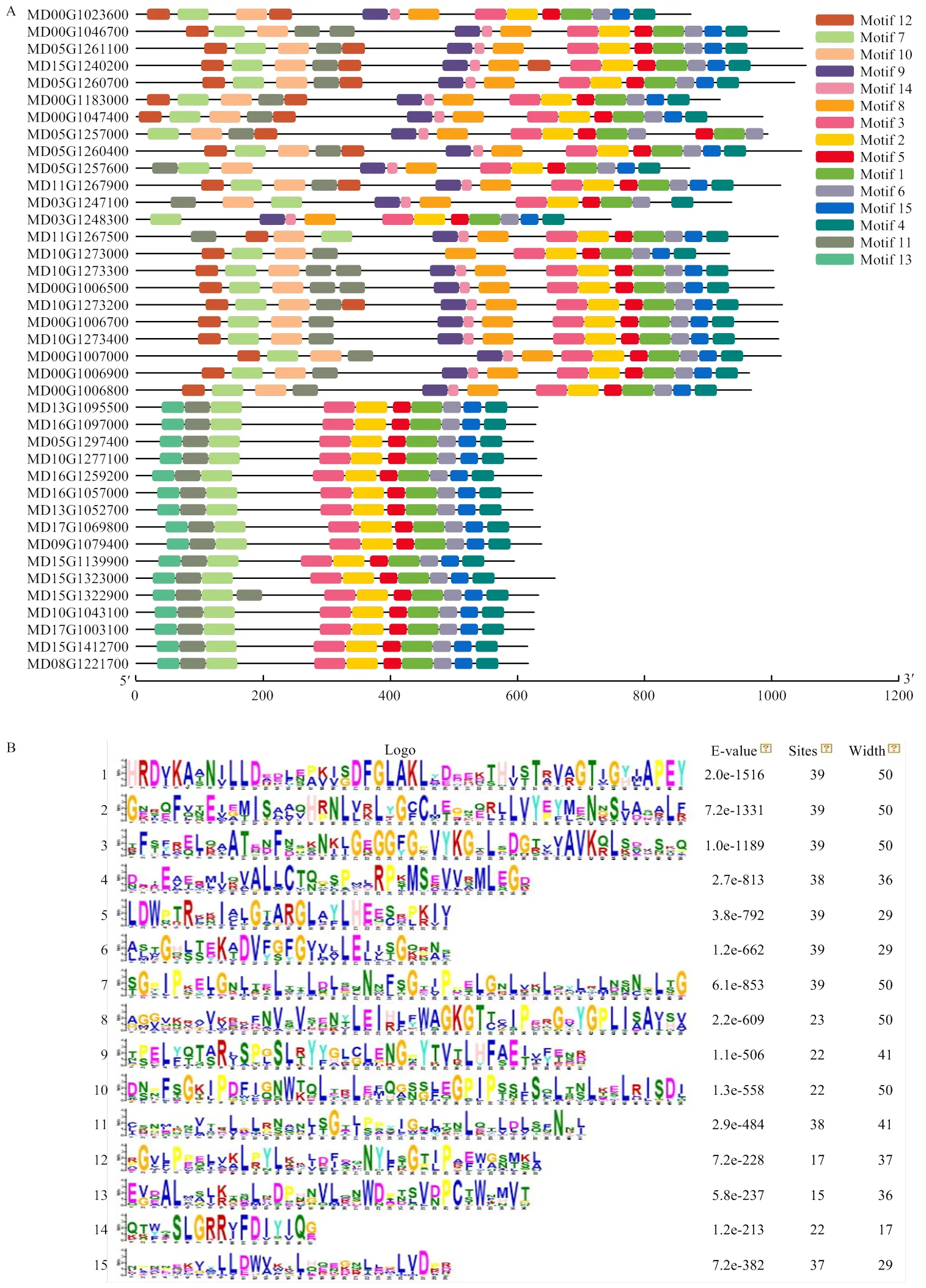
A:III亚家族motif 分析;B:15个保守位点LOGO图 A: III subfamily motif analysis; B: Logo of 15 conserved motif
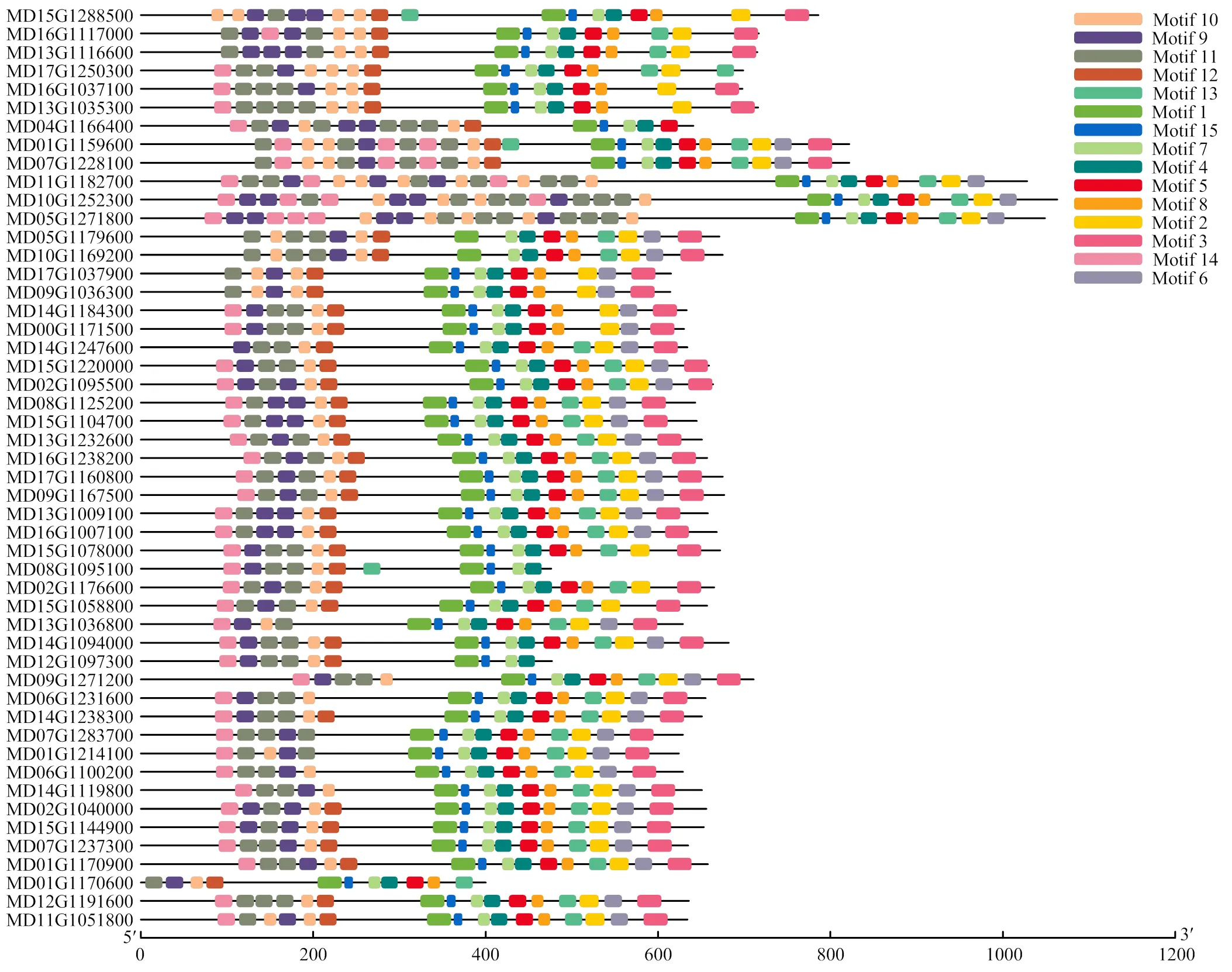
图5 III亚家族保守结构域
10% PEG处理下,除MD04G1150400、MD02G1071800、MD05G1065800和MD15G1288500对干旱胁迫无响应外,其余基因至少在其中一个时间点发生了差异表达。其中MD00G1105400上调表达最明显,PEG处理24 h时的表达量为对照的9.6倍。
NaCl处理下,MD04G1150400、MD13G1108000和MD02G1071800在盐胁迫条件下始终处于上调表达。推测其在响应盐胁时起正调控作用。其中MD02G1071800在盐胁迫下处理12 h的表达量最高为对照的14.9倍。而MD03G1138500、MD06G1170200、MD03G1036900、MD05G1061600和MD15G1288500对盐胁迫信号均无响应。
2.5.3 轮纹病菌诱导表达分析 分别用1×105个/mL轮纹病菌孢子悬液处理2年生‘望山红’与‘鸡冠’新梢。由图8可知,接种3 d时,MD09G1153800在‘鸡冠’中表达量显著上调,为对照的75.6倍,而在‘望山红’中表达量为对照的1.9倍,推测MD09G1153800在抗轮纹病过程中可能起到正调控作用。MD05G1065800在轮纹病侵染‘望山红’过程中表达量始终无差异,表明在感病品种中此基因不受诱导,而在抗病品种‘鸡冠’中,3 d时显著上调表达,表达量为对照的11倍,推测其可能在抗病中起到正调控作用。MD02G1071800在‘鸡冠’中呈现先上升后下降趋势,接种3 d时,表达量显著上调,为对照的16.3倍,而感病品种‘望山红’与对照差异不显著。MD00G1105400在‘望山红’接种轮纹病菌1 d时表达量是对照的286.9倍,抗病品种‘鸡冠’接种3 d时,表达量是对照的191倍,表明MD00G1105400参与苹果响应轮纹病侵染的过程。从整体上看,12个表达基本上呈先上升后下降趋势。
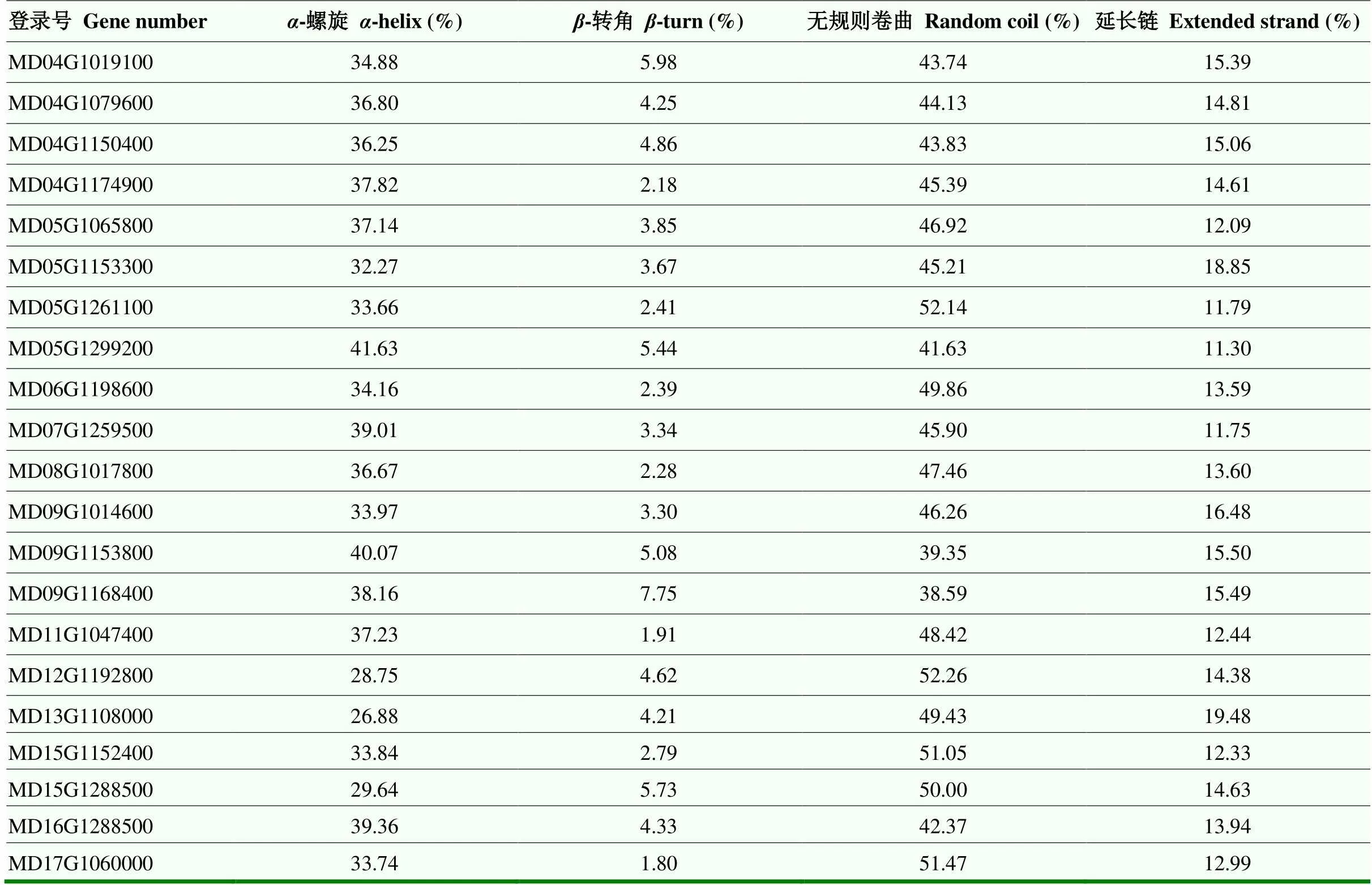
表3 苹果LRR-RLK蛋白的二级结构
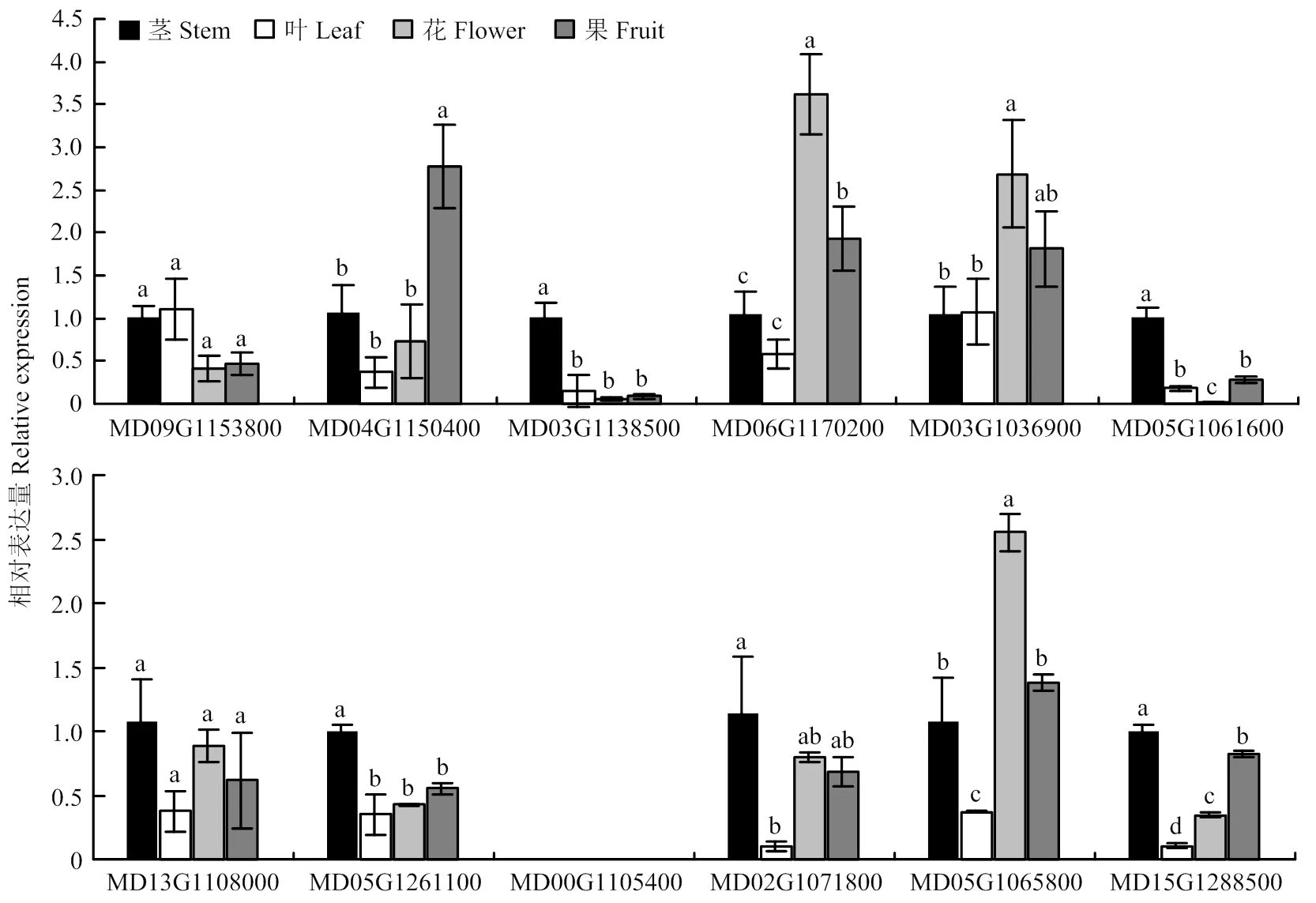
不同小写字母表示差异显著(P<0.05)。下同 Different lowercase letters indicate significant difference (P<0.05). The same as below
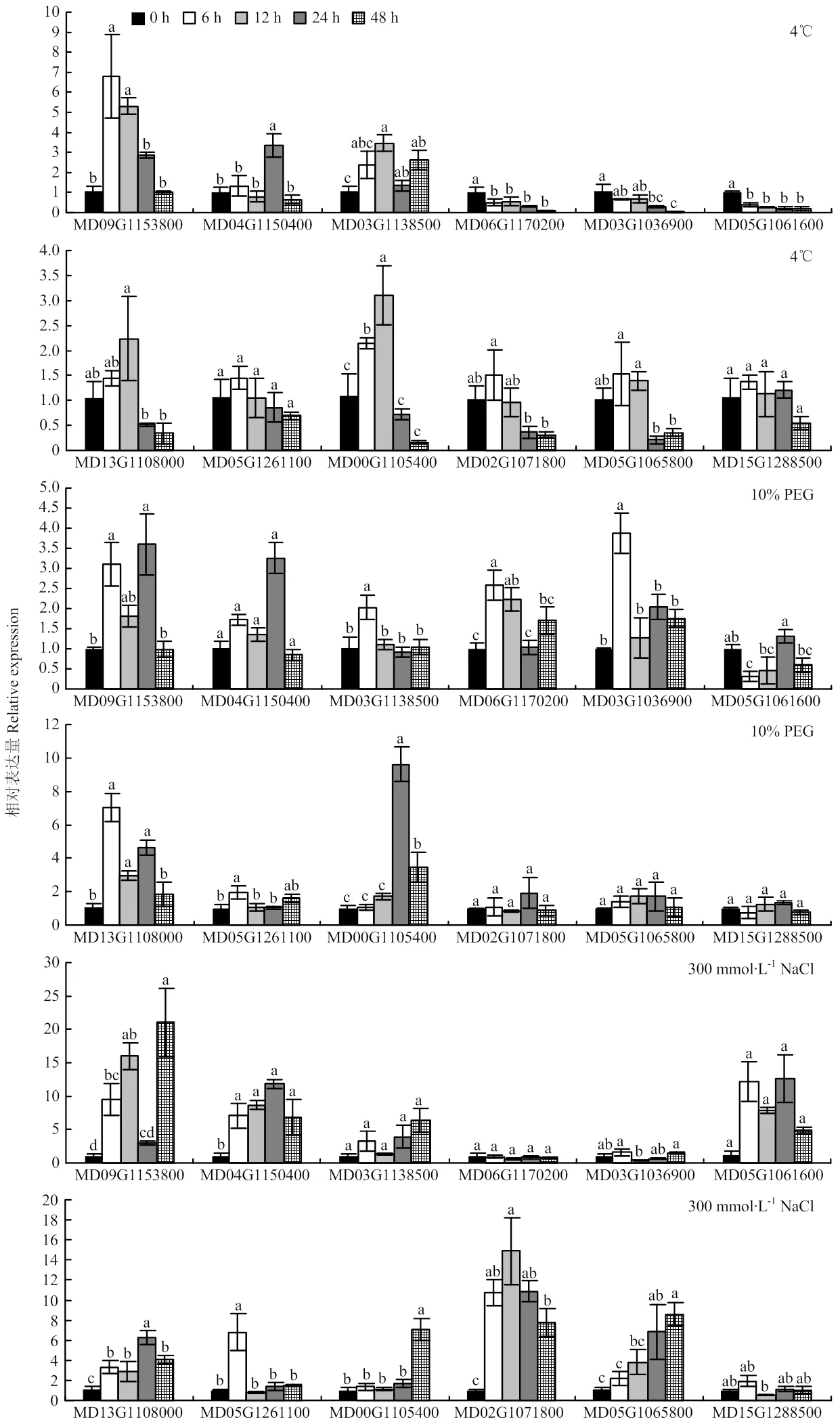
图7 不同非生物胁迫下苹果LRR-RLK的相对表达量
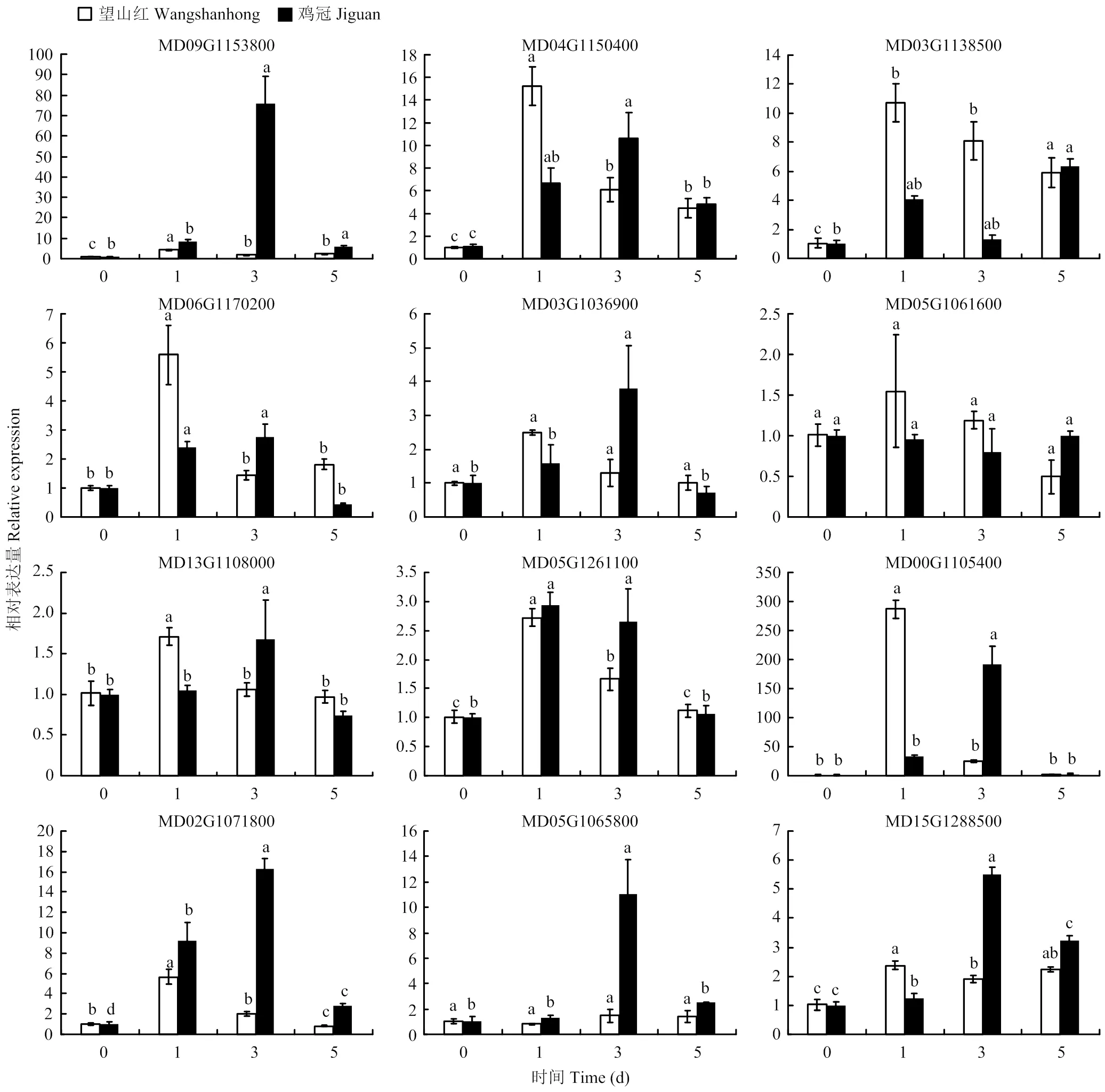
图8 苹果LRR-RLK响应轮纹病菌侵染的表达模式
3 讨论
植物在生长发育过程中因受到外界环境及内部信号的刺激,引发一系列的信号传递。植物类受体蛋白激酶是植物许多信号转导途径的关键组分[30-31]。而富含亮氨酸重复的类受体蛋白激酶是RLKs家族中当中最大的一类。目前,LRR-RLK已经在许多植物中被鉴定,如拟南芥225个[9]、大豆((L.) Merr.)467个[32]、棉花543个[33]、可可(L.)253个[34]、柑橘(L.)300个[35]。本研究依据LRR-RLK的蛋白质序列构建了系统进化树,可将LRR-RLK分为15组,这与拟南芥和棉花中对LRR-RLK的系统进化关系研究具有相似性[9,17]。苹果LRR-RLK家族的蛋白质大小在318— 1 827、分子量在34.95—199.33 kD,PI在5.19—9.14,表明LRR-RLK家族成员间的蛋白质大小、PI等特征差异较大,这一结果与其他物种相似[36]。基因结构分析显示CDS数量1—27个,内含子数目0—26个,表明该家族基因结构相对复杂,推测不同亚族之间功能上可能差异较大。这与Liu等[37]对拟南芥、苜蓿、狐米草和异叶卷柏等4种植物的LRR-RLK研究结果类似。Motif结构与分析表明,在LRR-RLK基因家族中各亚家族内部成员结构类似且相对保守,可能在苹果的生命过程中发挥相似的功能。II与III亚家族主要存在2个保守序列,分别是LRR基序、蛋白激酶结构域。该基因家族与拟南芥、大豆LRR-RLK基因家族高度相似[9,32]。
LRR-RLK广泛参与了根、叶、花、茎和果的生长发育[4,38-39]。本研究通过定量检测发现,筛选的12个家族成员在各组织中均有表达(除MD00G1105400外),且多数基因在茎中表达水平相对较高。MD09G1153800、MD00G1105400对低温、干旱、盐胁迫均有响应,与在马铃薯和水稻中的研究结果类似[4,40]。由此推测两者可能参与了苹果对逆境的响应调控。而MD15G1288500对上述3种非生物胁迫均无响应,此现象在其他基因家族中也存在[41]。
轮纹病是苹果三大真菌病害之一,而抗病基因的鉴定可为综合防控提供理论参考[42]。目前,LRR-RLK在植物抗病方面已经开展了较为广泛的研究,如通过QTL定位发现在基因座中编码LRR-RLK家族蛋白的基因与葡萄霜霉病抗性有关[43]。是苹果中第一个被发现的LRR型受体蛋白激酶相关基因[44]。和参与对黑星病的抗性[45-46]。和在抗黑星病基因存时对病原菌做出响应,可能参与病原体信号的识别。而和的表达谱不依赖于的存在,可能参与了植物的基础防御[47]。本研究中,接种轮纹病菌后,苹果LRR-RLK家族多个成员差异表达,但MD00G1105400在抗感苹果品种响应轮纹病诱导过程中均出现较高表达水平,仅可表明其参与对病原菌入侵的响应,而非抗病的关键成员。
4 结论
从苹果全基因组中获得378个LRR-RLK基因家族成员,均含有LRR区、跨膜区和激酶区等保守结构域。系统进化分析可将LRR-RLK分为15大类和21个亚类。多数苹果LRR-RLK在茎中高表达。低温条件下,7个基因上调表达,2个基因下调表达;在干旱条件下,8个基因上调表达;在盐胁迫条件下,MD04G1150400、MD13G1108000和MD02G1071800始终处于上调表达状态;MD09G1153800和MD05G1065800可能参与‘鸡冠’对轮纹病菌的抗性形成。
[1] SHIU S H, BLEECKER A B. Receptor-like kinases fromform a monophyletic gene family related to animal receptor kinases. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(19): 10763-10768.
[2] XIANG Y, CAO Y L, XU C G, LI X H, WANG S P., conferring resistance for rice bacterial blight and encoding a receptor kinase-like protein, is the same as. Theoretical and Applied Genetics, 2006, 113(7): 1347-1355.
[3] De LORENZO L, MERCHAN F, LAPORTE P, THOMPSON R, CLARKE J, SOUSA C, CRESPI M. A novel plant leucine-rich repeat receptor kinase regulates the response ofroots to salt stress. Plant Cell, 2009, 21(2): 668-680.
[4] LI X X, SALMAN A, GUO C, YU J, CAO S X, GAO X M, LI W, LI H, GUO Y F. Identification and characterization offamily genes in potato reveal their involvement in peptide signaling of cell fate decisions and biotic/abiotic stress responses. Cells, 2018, 7: 120.
[5] TICHTINSKY G, VANNOOSTHUYSE V, COCK J M, GAUDE T. Making inroads into plant receptor kinase signalling pathways. Trends in Plant Science, 2003, 8(5): 231-237.
[6] NAPIER R. Plant hormone binding sites. Annals of Botany, 2004, 93: 227-233.
[7] LEHTI-SHIU M D, SHIU S H. Diversity, classification and function of the plant protein kinase superfamily. Philosophical Transactions of The Royal Society Biological Sciences, 2012, 367: 2619-2639.
[8] GISH L A, CLARK S E. The RLK/Pelle family of kinases.The Plant Journal, 2011, 66: 117-127.
[9] SUN J M, LI L T, WANG P, ZHANG S L, WU J Y. Genome-wide characterization, evolution, and expression analysis of the leucine-rich repeat receptor-like protein kinase (LRR-RLK) gene family in Rosaceae genomes. BMC Genomics, 2017, 18: 763.
[10] GOMEZ-GOMEZ L, BAUER Z, BOLLER T. Both the extracellular leucine-richrepeat domain and the kinase activity ofare required for flagellin binding and signaling in. Plant Cell, 2001, 13(5): 1155-1163.
[11] KUNZE G, ZIPFEL C, ROBATZEK S, NIEHAUS K, BOLLER T, FELIX G. The N terminus of bacterial elongation factor Tu elicits innate immunity inplants. Plant Cell, 2004, 16: 3496-3507.
[12] SONG W Y, WANG G L, CHEN L L, KIM H S, PI LY, HOLSTEN T, GARDNER J, WANG B, ZHAI W X, ZHU L H, FAUQUET C, RONALD P. A receptor kinase-like protein encoded by the rice disease resistance gene,. Science, 1995, 270(5243): 1804-1806.
[13] HU H, WANG J, SHI C, YUAN C, PENG C F, YIN J J, LI W T, HE M, WANG J C, MA B T, WANG Y P, LI S G, CHEN X W. A receptor like kinase gene with expressional responsiveness onpv.is essential for-mediated disease resistance. Rice, 2015, 8: 1. https://doi.org/10.1186/s12284- 014-0034-1.
[14] CHEN T T, XIAO J, XU J, WAN WT, QIN B,CAO A Z, CHEN W, XING L P, DU C, GAO X Q, ZHANG S Z, ZHANG R Q, SHEN W B, WANG H Y, WANG X E. Two members offamily confer powdery mildew resistance in common wheat. BMC Plant Biology, 2016, 16: 27.
[15] BLAUM B S, MAZZOTTA S, NOLDEKE E R, HALTER T, MADLUNG J, KEMMERLING B, STEHLE T. Structure of the pseudokinase domain of, a regulator of-mediated immune signaling in.Journal of Structural Biology, 2014, 186(1): 112-121.
[16] IMKAMPE J, HALTER T,HUANG S H, SCHULZE S,MAZZOTTA S,SCHMIDT N,MANSTRETTA R,POSTEL S, WIERZBA M,YANG Y, VanDONGEN W M A M, STAHL M,ZIPFEL C,GOSHE M B,CLOUSE S, De VRIES S C, TAX F,WANG X F. KEMMERLING B. Theleucine-rich repeat receptor kinasenegatively regulatesReceptor complex formation and stabilizesPlant Cell, 2017, 29(9): 2285-2303.
[17] SUN R B, WANG S H, MA D, LIU C L. Genome-wide analysis ofgene family in fourspecies and expression analysis during cotton development and stress responses. Genes, 2018, 9: 592.
[18] LI H, HAN X D, LIU X X, ZHOU M Y, REN W, ZHAO B B, JU C L, LIU Y, ZHAO J R. A leucine-rich repeat-receptor-like kinase genefrom sorghum (L.) confers drought tolerance in maize. BMC Genomics, 2019, 20: 737.
[19] LIN F M , LI S, WANG K, TIAN H, GAO J F, ZHAO Q Z, DU C Q. A leucine-rich repeat receptor-like kinase,, modulates salt tolerance in rice. Plant Science, 2020, 296: 110465.
[20] LI R, AN J P, YOU C X, WANG X F, HAO Y J. Molecular cloning and functional characterization of the CEP RECEPTOR1 geneof apple (). Plant Cell, Tissue and Organ Culture, 2020, 140(3): 539-550.
[21] LIAO Y L, HU C Q, ZHANG X W, CAO X F, XU Z J, GAO X L, LI L H, ZHU J Q, CHEN R J. Isolation of a novel leucine-rich repeat receptorlike kinase () gene from rice and analysis of its relation to abiotic stress responses. Biotechnology & Biotechnological Equipment, 2017, 31(1): 51-57.
[22] WANG J H, KUCUKOGLU M, ZHANG L B, CHEN P, DANIEL D, NILSSON O, JONES B, SANDBERG G, ZHENG B. TheLRR-RLK,, is a regulator of secondary wall formation correlated with the TDIF-PXY/TDR-WOX4 signaling pathway. BMC Plant Biology, 2013, 13: 94.
[23] 杨敏, 韩玉珍, 阿依江, 哈拜克, 王翠玲. LRR-RLKs亚家族基因在拟南芥开花过程中的作用. 核农学报, 2017, 31(4): 654-662.
YANG M, HAN Y Z, A Y J, HA B K, WANG C L. Study of, one member of leucine-rich repeat receptor-like kinases () subfamily gene, on process of flowering inJournal of Nuclear Agricultural Sciences, 2017, 31(4): 654-662. (in Chinese)
[24] YU Y X, SONG J L, TIAN X H, ZHANG H W, LI L G, ZHU H F.interacts specifically withand induces depolarized growth of pollen tubes when over expressed. Science China-Life Sciences, 2018, 61: 100-112.
[25] DIMITROVA I, TAX F E. Lateral root growth inis controlled by short and long distance signaling through the LRR RLKsand. Plant Signaling and Behavior, 2018, 13(6): e1489667.
[26] ZOU Y, LIU X Y, WANG Q, CHEN Y, LIU C, QIU Y, ZHANG W., a novel leucine-rich repeat receptor-like kinase, negatively regulates polar auxin transport and root development in rice. Biochimica et Biophysica Acta (BBA)-General Subjects, 2014, 1840(6): 1676-1685.
[27] VELASCO R, ZHARKIKH A, AFFOURTIT J, DHINGRA A, CESTARO A, KALYANARAMAN A, FONTANA P, BHATNAGAR S K, TROGGIO M, PRUSS D, SALVI S, PINDO M, BALDI P, CASTELLETTI S, CAVAIUOLO M, COPPOLA G, COSTA F, COVA V, RI A D, GOREMYKIN V,. The genome of the domesticated apple (Borkh.). Nature Genetics, 2010, 42(10): 833-839.
[28] DACCORD N, CELTON J M, LINSMITH G, BECKER C, CHOISNE N, SCHIJLEN E, Van de GEEST H,BIANCO L, MICHELETTI D, WELASCO R, DiPIERRO E A, GOUZY J, REES D J G, GUERIF P, MURANTY H, DUREL C E, LAURENS F, LESPINASSE Y, GAILLARD S, AUBOURG S, QUESNEVILLE H, WEIGEL D, Van deWEG E, TROGGIO M, BUCHER E. High-quality de novo assembly of the apple genome and methylome dynamics of early fruit development. Nature Genetics, 2017, 49: 1099-1106.
[29] 袁高鹏, 韩晓蕾, 卞书迅, 张利义, 田义, 张彩霞, 丛佩华. 苹果基因家族生物信息学及表达分析. 中国农业科学, 2019, 52(23): 4322-4332.
YUAN G P, HAN X L, BIAN S X, ZHANG L Y, TIAN Y, ZHANG C X, CONG P H. Bioinformatics and expression analysis of thegene family in apple. Scientia Agricultura Sinica, 2019, 52(23): 4322-4332. (in Chinese)
[30] WAI C M, POWELL B, MING R, MIN X J. Genome-wide identification and analysis of genes encoding proteolytic enzymes in pineapple. Tropical Plant Biology, 2016, 9: 161-175.
[31] 张娅, 黄天虹, 张西林, 刘同坤, 侯喜林, 李英. 不结球白菜基因的克隆及表达分析. 南京农业大学学报, 2019, 42(6) : 1014-1021.
ZHANG Y, HUANG T H, ZHANG X L, LIU T K, HOU X L, LI Y. Cloning and expression analysis offrom non-heading Chinese cabbage. Journal of Nanjing Agricultural University, 2019, 42(6): 1014-1021. (in Chinese)
[32] ZHOU F l, GUO Y, Qiu L J. Genome-wide identification and evolutionary analysis of leucine-rich repeat receptor-like protein kinase genes in soybean. BMC Plant Biology, 2016, 16: 58.
[33] YUAN N, RAI K M, BALASUBRAMANIAN V K, UPADHYAY S K, LUO H, MENDU V. Genome-wide identification and characterization of LRR-RLKs reveal functional conservation of thesubfamily in cotton (). BMC Plant Biology, 2018, 18: 185.
[34] ARGOUT X, SALSE J, AURY J m, GUILTINAN M J, DROC G, GOUZY J, ALLEGRE M, CHAPARRO C, LEGAVRE T, MAXIMOVA S N, ABROUK M, MURAT F, FOUET O, POULAIN J, RUIZ M, ROGUET Y, RODIER-GOUD M, BARBOSA-NETO J F, SABOT F, KUDRNA D, AMMIRAJU J S S, SCHUSTER S C, CARLSON J E, SALLET E, SCHIEX T, DIEVART A, KRAMER M, GELLEY L, SHI Z, BERARD A,. The genome of. Nature Genetics, 2011, 43: 101-108.
[35] MAGALHAES D M, SCHOLTE L L S, SILVA N V, OLIVEIRA G C, ZIPFEL C, TAKITA M A, DE SOUZA A A.family from twospecies: Genome-wide identification and evolutionary aspects. BMC Genomics, 2016, 17: 623.
[36] WEI Z R, WANG J H, YANG S H, SONG Y J. Identification and expression analysis of thegene family in tomato () Heinz 1706. Genome, 2015, 58(4): 121-134.
[37] LIU P L, DU L, HUANG Y, GAO S M, YU M. Origin and diversification of leucine-rich repeat receptor-like protein kinase () genes in plants. BMC Evolutionary Biology, 2017, 17: 47.
[38] BETTEMBOURG M, DAL-SOGLIO M, BUREAU C, VERNET A, DARDOUX A, PORTEFAIX M, BES M, MEYNARD D, MIEULET D, CAYROL B, PERIN C, COURTOIS B, MA J F, DIEVART A. Root cone angle is enlarged inLRR-RLK mutants in rice. Rice, 2017, 10: 50.
[39] HOU B Z, CHENG X, SHEN Y Y. A leu-rich repeat receptor-like protein kinase,, interacts with the ABA receptor,, to regulate fruit ripening in strawberry. Journal of Experimental Botany, 2018, 69(7): 1569-1582.
[40] PARK S J, MOON J C, PARK Y C, KIM J, KIM D S, JANG C S. Molecular dissection of the response of a rice leucine-rich repeat receptor-like kinase () gene to abiotic stresses.Journal of Plant Physiology, 2014, 171(17): 1645-1653.
[41] XIE R J, LI Y J, HE S L, ZHENG Y Q, YI S L, LV Q, DENG L. Genome-wide analysis of citrusgenes and their spatiotemporal expression under stresses and hormone treatments. PLoS ONE, 2014, 9(12): e113971.
[42] 刘河, 朵虎, 赵丹, 孙娥, 马富鹏, 马春玲, 左存武. 梨家族基因及其腐烂病菌侵染响应成员的鉴定. 园艺学报, 2020, 47(4): 963-973.
LIU H, DUO H, ZHAO D, SUN E, MA F P, MA C L, ZUO C W. Identification ofgene family in pear and its members in response to signals of.Acta Horticulturae Sinica, 2020, 47(4): 963-973. (in Chinese)
[43] LIN H, LENG H, GUO Y S, KONDO S,ZHAO Y H, SHI G L, GUO X W. QTLs and candidate genes for downy mildew resistance conferred by interspecific grape (L. ×Rupr.) crossing. Scientia Horticulturae, 2019, 244: 200-207.
[44] FAIZE M, FAIZE M, FAIZE L, ISHII H. Characterization of a leucine-rich repeat receptor-like protein kinase () gene from Japanese pear and its possible involvement in scab resistance. Journal of General Plant Pahtology, 2007, 73(2): 104-112.
[45] KOMJANC M, FESTI S, RIZZOTTI L, CATTIVELLI L, CERVONE F, De LORENZO G. A leucine-rich repeat receptor-like protein kinase() gene is induced inbyinfection and salicylic acid treatment., 1999, 40: 945-957.
[46] PADMARASU S, SARGENT D J, PATOCCHI A, TROGGOI M, BALDI P, LINSMITH G, POLES L, JANSCH M, KELLERHALS M, TATTARINI S, VELASCO R. Identification of a leucine-rich repeat receptor-like serine/threonine-protein kinase as a candidate gene for()-based apple scab resistance. Molecular Breeding, 2018, 38: 73.
[47] COVA V, PARIS R, PASSEROTTI S, ZINI E, GESSLER C, PERTOT I, LOI N, MUSETTI R, KOMJANC M. Mapping and functional analysis of four apple receptor-like protein kinases related to-transgenic and wild-type apple plants. Tree Genetics & Genomes, 2010, 6: 389-403.
Genome-Wide Identification and Expression Pattern Analysis of LRR-RLK Gene Family in Apple

1Liaoning Institute of Pomology, Yingkou 115009, Liaoning;2College of Horticultural Science and Engineering, Shangdong Agricultural University, Tai’an 271018, Shangdong
【】 The study was carried out to explore the whole genome characteristics and expression patterns ofin apple, to reveal the expression specificity of family members in different tissues and their responses to biological and abiotic stress, and further understand its biological function in apple. 【】 The members of LRR-RLK gene family in the whole genome of apple were identified based on the local BLAST database and Pfam database. The LRR-RLK amino acid sequence prediction, subcellular localization prediction, domain analysis, phylogenetic tree and chromosome localization were completed by software of ExPASy Proteomics Server, Cell-PLoc, CD-Search Tool, MEGAX and MG2C. In addition, the expression pattern of 12genes in different tissues and stress were analyzed by real-time fluorescent quantitative PCR (qRT-PCR).【】 A total of 378genes were identified from apple genome. Thesegenes encoded proteins containing 318-1 827 amino acid, and the theoretical isoelectric point ranged from 6.14 to 9.01. The prediction subcellular localization of apple LRR-RLK proteins was all distributed in the cell membrane. The gene family could be divided into 15 subgroups, containing 1-111 genes. The 378 genes in this family were distributed on all 17 chromosomes of the apple, and the chromosome 7 contained 40 genes. The LRR-RLKgene family had two conserved domains, namely the leucine-rich repeat structure and the protein kinase domain. Irregular curl and α-helix was the main secondary structure in the LRR-RLK gene family, and the rotation of β-turn was very small. It was found that the 12 selected family members were expressed in all tissues (except MD00G1105400), and most genes were expressed at relatively high levels in stem. Seven genes were up-regulated under low temperature conditions, and the expression of MD09G1153800 was the most obvious. The expression of MD09G1153800 was raised to 6.8 times of that under the control. While MD06G1170200 and MD05G1061600 were both down-regulated. Eight genes were up-regulated under drought conditions, and MD00G1105400 was the most obvious one. The expression of MD00G1105400 was raised to 9.6 times of that under the control; under salt conditions, MD04G1150400, MD13G1108000 and MD02G1071800 were always up-regulated. Among them, MD02G1071800 had the highest expression after 24 hours of salt stress treatment, which was 14.9 times of that under the control. After inoculatingthe expression of 12genes increased first and then decreased. After inoculating, the expression level of Wangshanhong was higher on the first day, however the expression level of Jiguan was higher on the third day. The expression of MD09G1153800 and MD05G1065800 were up-regulated significantly in Jiguan,in relativeto have no change in Wangshanhong, suggesting that these twocould serve as candidate genes for further functional characterization. 【】 A total of 378members were identified from apple whole genome sequences, which could be divided into 15 groups and distributed on 17 chromosomes, and the most ofgenes were responsive to stress stimulus and.
apple; LRR-RLK; gene family; identification; expression analysis

10.3864/j.issn.0578-1752.2021.14.015
2020-08-30;
2020-12-29
农业农村部园艺作物种质资源利用重点实验室开放基金(NYZS201905)、辽宁省科学事业公益研究基金(20180022)、辽宁省农业科学院学科建设项目(2020DD165004)
黄金凤,E-mail:huangfeng1002@163.com。通信作者刘志,Tel:0417-7033412;E-mail:lnliuzhi@163.com
(责任编辑 赵伶俐)

