两种微生物菌剂对有机基质袋培秋黄瓜产量、品质及根际环境的影响
王君正,张琪,高子星,马雪强,屈锋,胡晓辉
两种微生物菌剂对有机基质袋培秋黄瓜产量、品质及根际环境的影响
王君正,张琪,高子星,马雪强,屈锋,胡晓辉
西北农林科技大学园艺学院/农业农村部西北设施园艺工程重点实验室,陕西杨凌 712100
【】探究甲基营养型芽孢杆菌和植物乳杆菌两种微生物菌剂对有机基质培黄瓜产量、品质及根际环境的影响,开发新型功能型微生物制剂,指导黄瓜优质高效生产。以‘博耐526’黄瓜品种为材料,采用有机基质袋培方式,在浇灌清水(N)和营养液(F)2种养分水平下,以不添加菌剂为对照(分别记为CK1和CK2),于定植后第20、35和50天按2.5×1010CFU/株的菌剂用量分别灌根添加‘VL-10’型甲基营养型芽孢杆菌(NT1、FT1)和‘LYS-1’型植物乳杆菌(NT2、FT2)两种菌剂,共6个处理。两种养分水平下,与CK1和CK2处理相比,甲基营养型芽孢杆菌处理植株的干物质积累量增幅分别为13.51%和15.02%,产量增幅分别为20.83%和15.63%;植物乳杆菌处理植株干物质积累量增幅分别为11.43%和8.42%,产量增幅分别为17.42%和14.96%,甲基营养型芽孢杆菌对植株干物质积累和产量形成的促进效果优于植物乳杆菌。以FT1处理的果实品质最优,其游离氨基酸、有机酸、可溶性糖、还原糖和维C含量分别较CK2处理显著提高了10.61%、28.93%、22.92%和39.88%(<0.05),FT2处理的果实品质次之;NT1和NT2处理较CK1处理显著提高了植株P(7.43%和13.50%)、K(10.60%和8.19%)元素积累量(<0.05),FT1和FT2处理的植株N(19.57%和24.18%)、P(17.16%和12.50%)、K(16.48%和26.25%)元素积累量均较CK2处理显著提高(<0.05);FT1处理的N、P、K肥料利用率较CK2处理分别显著提高了82.85%、483.90%和75.60%(<0.05),FT2处理分别显著提高了102.42%、367.98%和120.46%(<0.05)。NT1和NT2处理较CK1处理提高了盛果期的基质蔗糖酶(100.66%、116.60%)、过氧化氢酶(3.39%、4.10%)和碱性磷酸酶(6.99%、95.08%)活性,其中过氧化氢酶和碱性磷酸酶活性在拉秧期依然高于CK1处理;而FT1和FT2处理均较CK2处理显著提高了盛果期和拉秧期的基质脲酶(3.75%、4.95%和13.13%、6.12%)、蔗糖酶(68.62%、24.93%和31.68%、63.35%)和碱性磷酸酶活性(18.00%、26.99%和109.64%、84.01%)(<0.05),且甲基营养型芽孢杆菌对脲酶和碱性磷酸酶的影响优于植物乳杆菌;两种养分水平下,甲基营养型芽孢杆菌处理的基质有效态氮含量在盛果期分别较CK1和CK2显著提高了63.33%和72.70%(<0.05),在拉秧期增幅为25.48%和86.46%,同时期增幅均大于植物乳杆菌,有利于保持更高的基质有效态氮含量。灌根添加7.5×1010CFU/株的甲基营养型芽孢杆菌和植物乳杆菌均可改善有机基质袋培黄瓜的根际环境,促进植株对元素的吸收、同化和积累,有效提高黄瓜产量和果实品质,以甲基营养型芽孢杆菌的增产提质效果更优。
微生物菌剂;黄瓜;基质栽培;产量;品质;根际环境
0 引言
【研究意义】设施栽培在实现蔬菜作物周年生产、增加经济效益的同时,栽培土壤的次生盐渍化、连作障碍等诸多问题也一直受到普遍关注[1]。基质栽培可摆脱土壤束缚,有效解决传统土壤栽培中较难解决的水、气、肥供应的矛盾关系等优势[2],已成为发展设施蔬菜优质生产的重要途径。基质栽培过程中,根际微生物不仅是有机养分转化的动力[3],其结构与丰度也影响植株的生长发育[4]。探寻微生物对有机基质培作物根际环境的影响有助于挖掘有机养分转化与作物吸收增效途径,探究有机基质培方式下外源微生物菌剂对黄瓜干物质积累、产量、品质、元素吸收和根际环境等指标的影响,对提高基质栽培效果和建立富营养型有机基质栽培模式具有重要的理论和实际意义。【前人研究进展】前人关于有机基质栽培的研究多以促生、增产和提高果实品质为目标,实现途径多基于品种比较和基质配方、水/肥调控等栽培管理方式的优化[5-7],生产过程依然难以摆脱传统化学肥料的束缚,而根际微生物对有机养分转化和作物元素吸收过程所起到的关键作用往往被忽略。甲基营养型芽孢杆菌()为生防型革兰氏阳性菌,具有抗逆性强、抗菌谱广、环境友好且不易产生耐药性等特点[8],目前有关该菌的研究集中在对黄瓜炭疽病、灰霉病、枯萎病和葡萄霜霉病等病害的防治作用及其作用机理[9-10];植物乳杆菌()作为可食用益生菌之一,是一类革兰氏阳性、兼性异型发酵乳酸菌,其有关研究多集中于食品、青贮饲料发酵及动物肠道益生作用[11-12],对作物生产过程的影响以探究其病害防控作用为主[13]。【本研究切入点】目前,利用微生物制剂促进作物生长、提高产量和品质的研究多基于土壤栽培条件[14-15],结合基质栽培方式下养分转化与作物吸收的研究相对较少,且关于上述两种微生物对蔬菜产量、品质和根际环境的影响鲜有报道。因此,将甲基营养型芽孢杆菌和植物乳杆菌两种微生物制剂与黄瓜有机基质栽培方式相结合,以挖掘菌剂功能、提高生产质量和肥料利用率。【拟解决的关键问题】基于黄瓜有机基质栽培试验,探究甲基营养型芽孢杆菌和植物乳杆菌两种微生物菌剂在不同养分水平下对产量、品质、养分吸收以及根际微环境等指标的具体影响,为促进设施基质栽培黄瓜优质高效生产提供科学依据。
1 材料与方法
试验于2019年在陕西杨凌揉谷设施农业基地(北纬34°28′,东经108°07′,海拔498.68 m)大跨度非对称内保温双层塑料薄膜大棚内进行。试验期棚内日平均空气温度18.6—34.6℃;日平均相对湿度48.3%—84.3%(北京金洋万达科技有限公司生产的“WD-PDKI”型温湿度光照记录仪测定)。
1.1 试验材料
以‘博耐526’品种黄瓜和‘VL-10’甲基营养型芽孢杆菌(粉剂,山东蔚蓝生物科技有限公司,有效活菌数为5×1010CFU/g)、‘LYS-1’植物乳杆菌(菌液,山东蔚蓝生物科技有限公司,有效活菌数为1×108CFU/mL)为试材。采用基质袋培,基质袋尺寸大小为长×宽×高=90 cm×20 cm×16 cm,基质容量为18 L/袋,每袋种植2株黄瓜。栽培基质配比为腐熟牛粪﹕菇渣﹕珍珠岩=2﹕4﹕1(体积比),其理化性质为:速效氮1.4 mg·g-1、速效磷0.8 mg·g-1、速效钾5.5 mg·g-1、全氮19.4 mg·g-1、全磷8.4 mg·g-1、全钾20.3 mg·g-1、pH 6.94、电导率为2.3 mS·cm-1、有机质含量为48.3%。采用水肥一体化滴灌系统进行水肥管理,灌溉和营养液供应流速为1 L·h-1。
1.2 试验设计
黄瓜苗于8月9日(3叶1心时)定植,10月26日拉秧,各处理定植28株,3次重复,定植密度为3 419株/667 m2。为分别对比两种微生物菌剂对不同养分水平下植株产量、品质及根际环境等指标的影响,分为浇灌清水(N)和营养液(F)两个组分。根据预试验结果,设置两种供试菌剂的单株累计添加总活菌数均为7.5×1010CFU,分别于定植后第20、35和50天进行灌根,每次每株添加活菌数为2.5×1010CFU,根据公式:单次单株添加活菌数=[菌剂有效活菌浓度×单株取用克数(或取用体积)]计算取用量,其中,甲基营养型芽孢杆菌菌剂处理(NT1和FT1)时按0.5 g/株称取菌剂,于250 mL清水中混合均匀后进行灌根;植物乳杆菌为菌液,每次菌剂处理(NT2和FT2)时按250 mL/株用量取菌液后进行灌根,CK1和CK2处理浇灌同体积清水,共6个处理。
开花坐果期(定植后第24天)开始进行不同养分条件处理,营养液供应组分选用山崎黄瓜专用营养液进行滴灌补充养分,每3 d按每株1 L·d-1用量浇1次0.5倍浓度山崎黄瓜专用营养液或等量清水,浇4次;然后增加营养液浓度至1倍浓度,按每株1 L·d-1用量,浇9次。其他管理按常规栽培管理方式进行。
1.3 测定指标与方法
1.3.1 产量记录 各处理随机选取8株植株挂牌标记,用于记录单株产量,每次采收时记录单株产量和小区产量,各处理总产量由小区产量折算。
1.3.2 品质测定 于盛果中期(定植后第55天),分别在各处理植株的相同叶位选取长度和重量一致的5个果实用于品质测定。维生素C含量采用钼蓝比色法测定;可溶性蛋白含量采用考马斯亮蓝G-250染色法测定;游离氨基酸含量采用茚三酮显色法测定;可溶性糖含量采用蒽酮比色法测定;还原糖含量采用3,5-二硝基水杨酸法测定;硝酸盐含量采用水杨酸法测定[18];有机酸含量采用氢氧化钠滴定法测定[16]。
1.3.3 植株N、P、K元素和不同器官干物质积累量测定 各处理分别于盛果期和拉秧期(定植后第55和78天)随机选取5株,参照张佼等[17]的方法测定植株干物质积累量和植株N、P、K元素含量。
1.3.4 基质酶活性和有效态氮含量测定 各处理分别于盛果期和拉秧期(定植后第55和78天)随机取5株植株的根际基质,经自然风干、混匀、研磨、过筛后测定基质酶活性和有效态氮含量。基质过氧化氢酶活性采用高锰酸钾滴定法测定;脲酶活性采用苯酚-次氯酸钠比色法测定;蔗糖酶活性采用3,5-二硝基水杨酸比色法测定;磷酸酶活性采用磷酸苯二钠比色法测定[18]。有效态氮含量为NH4+-N和NO3--N含量之和,经1 mol·L-1KCl溶液浸提基质后,用连续流动分析仪(Auto Analyzer 3,Germany)测定基质悬液的NH4+-N含量和NO3--N含量[19]。
1.3.5 肥料利用率的计算 结合拉秧期所取植株的干质量、元素含量和生育期内养分投入量,根据如下公式分别计算N、P、K肥料利用率[20]。
肥料利用率(fertilizer use efficiency,FUE)=(U1-U0)/F×100%
式中,U1:施肥区吸收N、P2O5和K2O总量(kg/株),U0:对照区吸收N、P2O5和K2O总量(kg/株),F:全生育期投入的N、P2O5和K2O总量(kg/株)。
1.4 数据统计与分析
采用Excel 2010软件进行数据整理及作图,用SPSS 23.0软件中的Duncan’s方法进行数据差异性分析,数据以“平均值±标准误”表示,用Pearson相关性分析根际环境与品质指标的相关性。
2 结果
2.1 两种微生物菌剂对有机基质培黄瓜产量的影响
由图1可见,营养液和微生物菌剂对黄瓜产量均有极显著影响(<0.01),而二者对黄瓜产量无显著交互作用影响(<0.05)。在两种养分水平下,均以添加甲基营养型芽孢杆菌的处理产量最高,添加植物乳杆菌的处理次之。与CK1处理相比,NT1和NT2处理的黄瓜产量分别显著提高了23.56%和17.61%;与CK2处理相比,FT1和FT2处理的黄瓜产量分别显著提高了16.39%和16.25%。表明两种微生物菌剂均可促进黄瓜产量的增加,其增产幅度因基质中养分含量的不同略有差异,其中甲基营养型芽孢杆菌的增产效果更稳定。

**表示极显著影响(P<0.01),NS表示无显著影响。不同小写字母表示差异显著(P<0.05),字母‘M’和‘F’分别代表菌剂和营养液。下同
2.2 两种微生物菌剂对有机基质培黄瓜品质的影响
除维生素C含量外,营养液对黄瓜果实其他品质指标均有极显著影响(<0.01);微生物菌剂对游离氨基酸、可溶性蛋白、有机酸和维生素C含量有极显著影响(<0.01),对可溶性总糖含量影响显著(<0.05),但对其他指标无显著影响;二者的交互作用对除游离氨基酸外的其他品质指标均呈极显著影响(<0.01)(表1)。整体来看,以营养液供应配合添加甲基营养型芽孢杆菌的FT1处理黄瓜品质指标最优,除硝酸盐含量外的品质指标均为最大值。与CK1处理相比,NT1和NT2处理的果实游离氨基酸、有机酸、可溶性糖及还原糖含量分别显著提高了14.98%和6.39%、5.73%和16.39%、13.34%和11.63%、27.68%和22.32%,NT1处理的果实可溶性蛋白含量显著提高了17.82%;与CK2处理相比,FT1和FT2处理的果实游离氨基酸、有机酸、可溶性总糖含量分别显著提高了10.61%和7.33%、6.25%和4.17%、28.93%和9.75%,FT1处理还显著提高了果实还原糖(22.92%)和维C含量(39.88%),两种菌剂处理均显著降低了果实的硝酸盐含量。
2.3 两种微生物菌剂对黄瓜不同器官干物质积累与分配的影响
由表2可知,营养液对茎、叶、果干质量和果实干物质分配系数均有极显著影响(<0.01);微生物菌剂对植株根、茎和果实干质量有极显著影响(<0.01);二者的交互作用仅对茎干质量有极显著影响(<0.01),对果实干物质分配系数有显著影响(<0.05)。根际添加两种微生物菌剂后,在两种养分管理模式下均较对照提高了植株干物质积累量。与CK1处理相比,NT1和NT2处理的植株茎、果实干物质积累量分别显著提高了14.86%和18.64%、23.56%和17.60%,NT1处理还显著提高了根干质量(20.45%)和果实干物质分配系数(10.20%);与CK2处理相比,FT1处理的植株根、茎、叶和果实干物质积累量分别较CK2对照显著提高了30.47%、29.71%、14.45%和12.39%,而FT2处理仅茎、果实干物质积累量分别显著提高了12.13%和12.35%。两种养分水平下均以甲基营养型芽孢杆菌处理对植株干物质积累的促进效果最优。
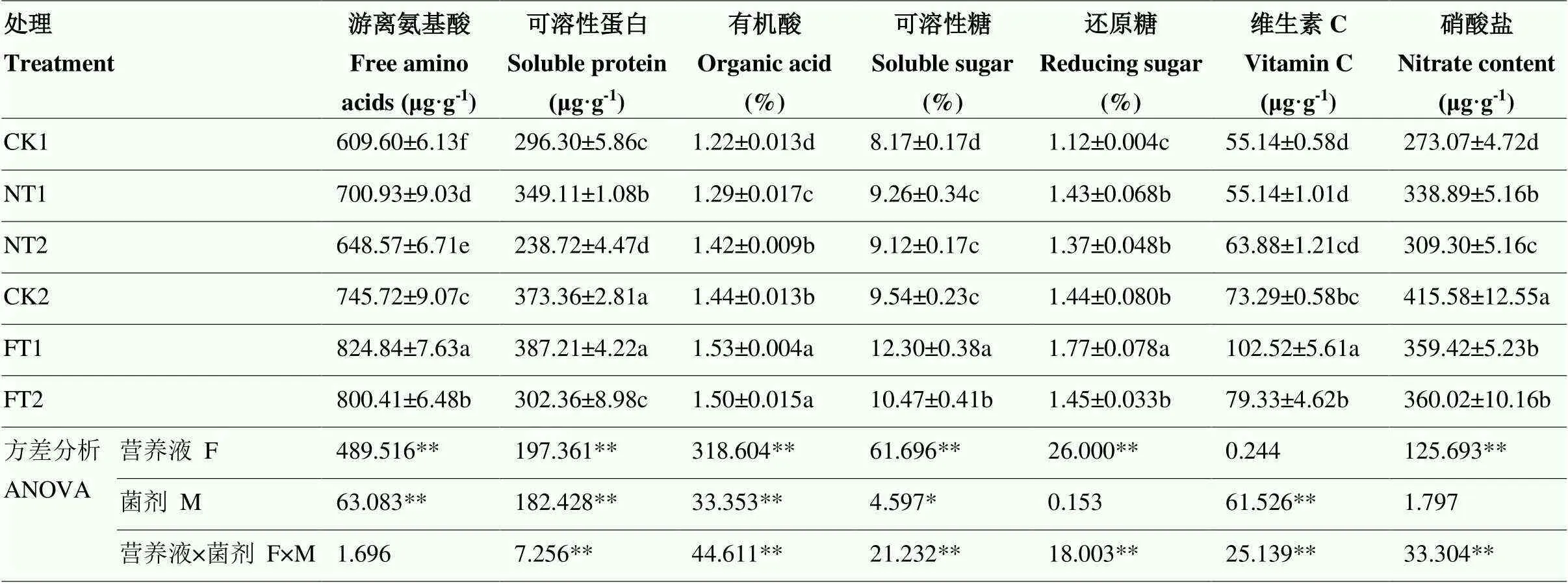
表1 两种微生物菌剂对有机基质培黄瓜品质的影响
同列数据后不同小写字母表示差异显著(<0.05),*和**分别表示显著差异(<0.05)和极显著差异(<0.01)。下同
Values followed by different letters in the same column show significant difference (<0.05). *, ** significant difference (<0.05) and extremely significant difference (<0.01), respectively. The same as below
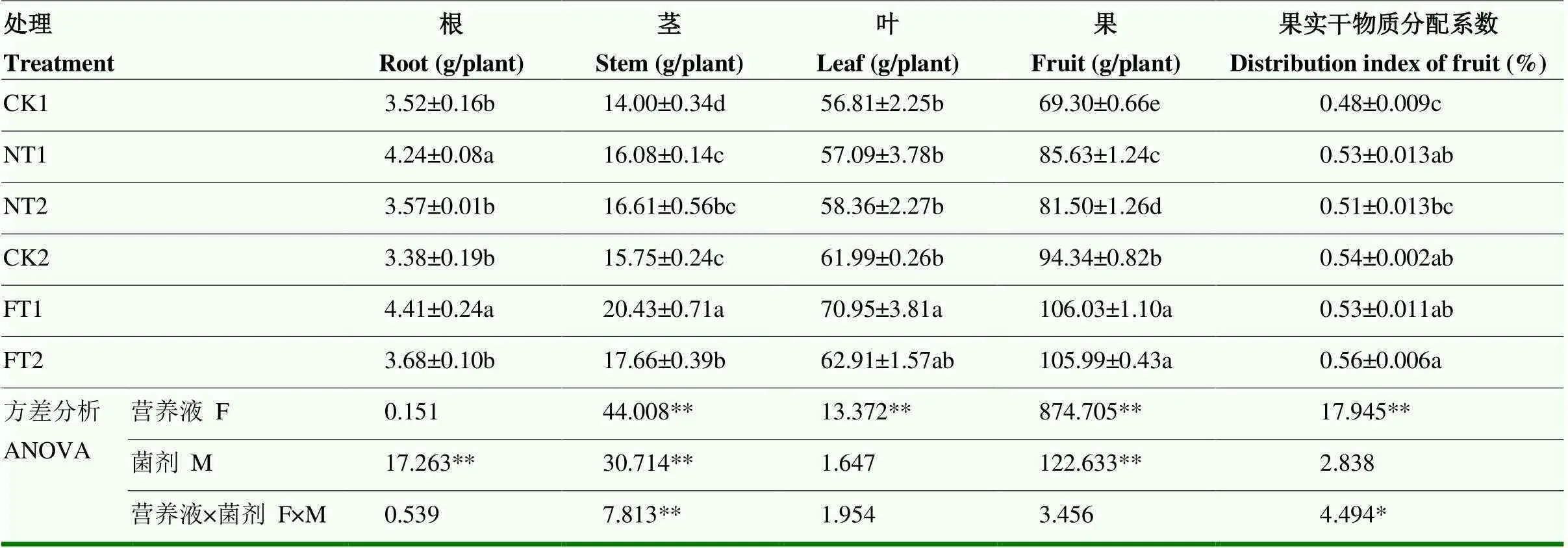
表2 两种微生物菌剂对黄瓜干物质积累与分配的影响
2.4 两种微生物菌剂对植株元素积累量的影响
由图2可知,营养液、菌剂及二者的交互作用对黄瓜的N、P、K元素积累量均有极显著影响(<0.01)。微生物菌剂在促进元素吸收和积累的同时,也促进了元素由根系向茎、叶和果实的转运与积累。在两种养分管理模式下,添加甲基营养型芽孢杆菌和植物乳杆菌菌剂处理的植株P元素积累量分别较各自对照显著提高了7.43%—17.16%和12.50%—13.50%、K元素积累量分别较各自对照显著提高了10.60%—16.48%和8.19%—26.25%。仅在营养液供应条件下,添加两种微生物菌剂后显著提高了植株N元素积累量,FT1和FT2处理的N元素积累量分别较CK2处理显著提高了19.57%和24.18%,但该促进作用在浇灌清水条件下不明显。
2.5 两种微生物菌剂对基质酶活性的影响
营养液对两个时期的基质脲酶、蔗糖酶活性和拉秧期过氧化氢酶活性均有极显著影响(<0.01),而对拉秧期的碱性磷酸酶有显著影响(<0.05);菌剂对两个时期的脲酶、过氧化氢酶和盛果期的蔗糖酶、碱性磷酶活性均有极显著影响(<0.01);除拉秧期的过氧化氢酶外,二者的交互作用对两个时期的其他基质酶活性均有极显著影响(<0.01)(表3)。两种微生物菌剂在营养液供应条件下对基质酶活性的影响大于无营养供应条件。在浇灌清水条件下,根际添加两种微生物菌剂后均较CK1处理提高了盛果期的蔗糖酶、过氧化氢酶和碱性磷酸酶活性,其中过氧化氢酶和碱性磷酸酶活性在拉秧期仍高于CK1处理,该条件下甲基营养型芽孢杆菌对碱性磷酸酶的影响大于植物乳杆菌,而过氧化氢酶活性更多受到植物乳杆菌的影响。在营养液供应条件下,添加两种微生物菌剂后均较CK2处理显著提高了两个时期的脲酶、蔗糖酶和碱性磷酸酶活性,且甲基营养型芽孢杆菌对脲酶和碱性磷酸酶的影响效果优于植物乳杆菌。整体而言,外源添加两种微生物菌剂有助于提高基质酶活性。
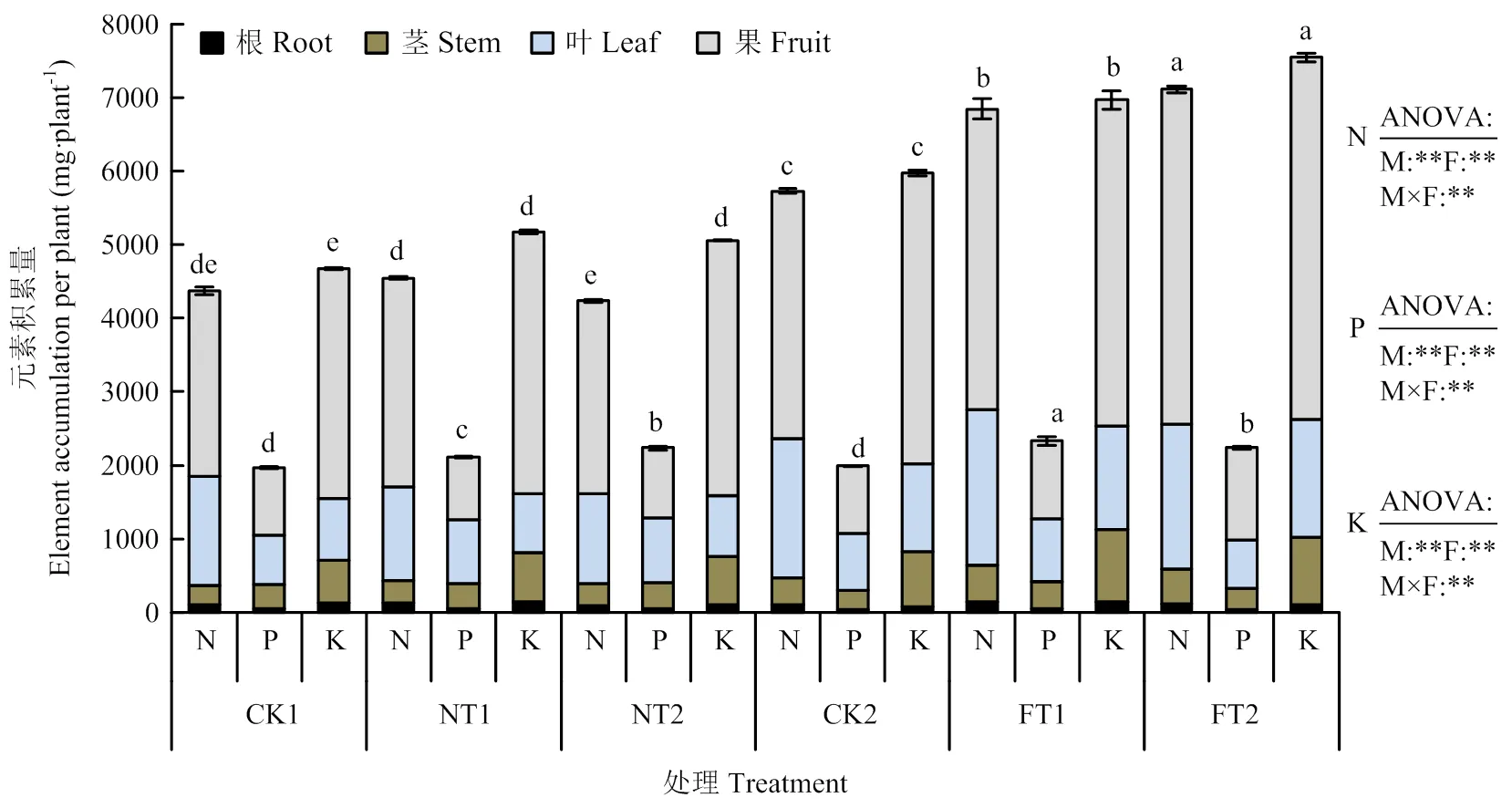
图2 两种微生物菌剂对黄瓜N、P、K元素积累量的影响
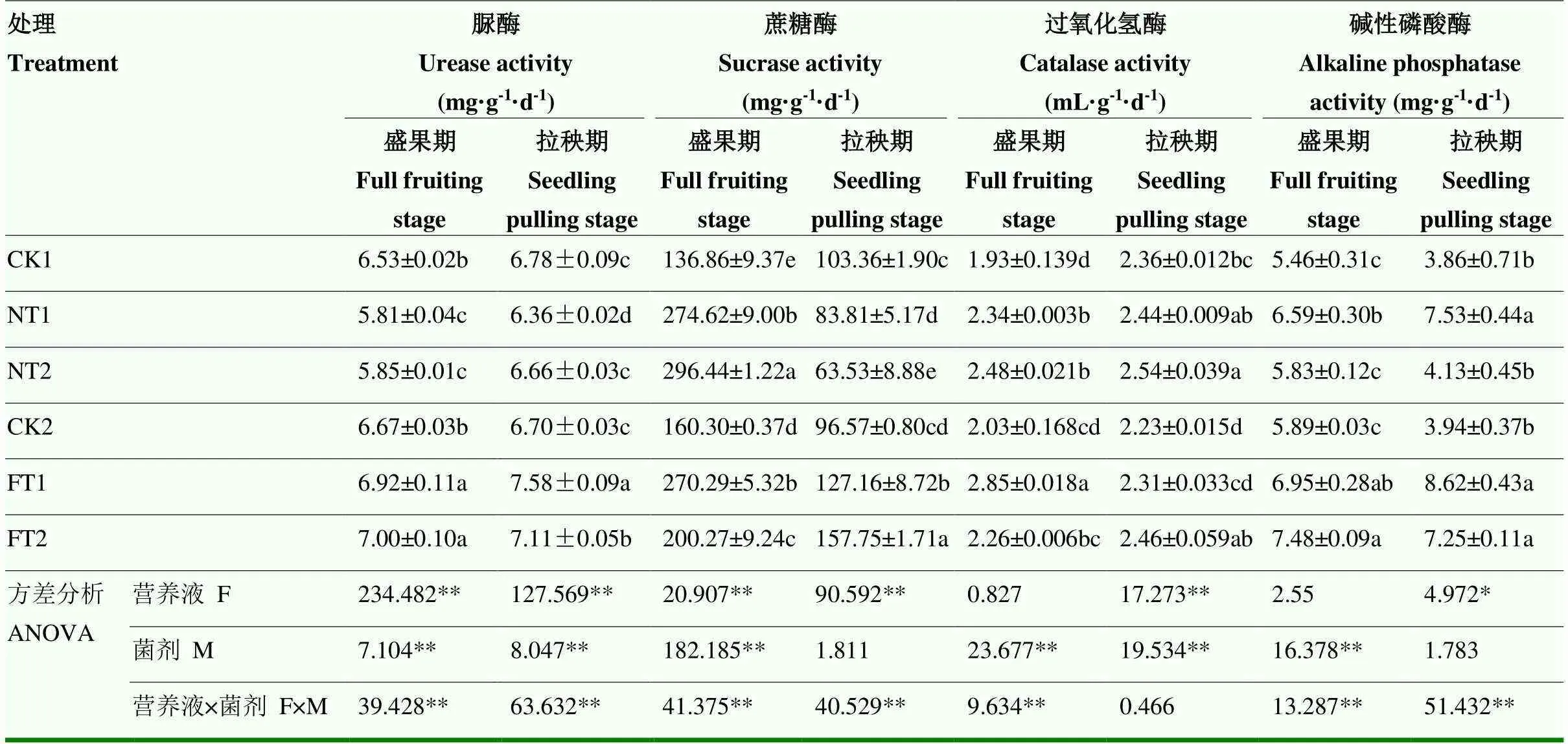
表3 两种微生物菌剂对基质酶活性的影响
2.6 两种微生物菌剂对基质有效态氮含量的影响
由表4可知,除营养液对拉秧期的基质NH4+-N含量无显著影响外,营养液、菌剂及二者的交互作用对两个时期基质中的NH4+-N、NO3--N含量及有效态氮总量均有极显著影响(<0.01)。在两种养分水平下,添加两种微生物菌剂后均较对照处理显著提高了两个时期的基质有效态氮含量,且甲基营养型芽孢杆菌处理(NT1和FT1)的有效态氮含量均显著高于植物乳杆菌处理(NT2和FT2)。在盛果期,与CK1处理相比,NT1和NT2处理的基质NH4+-N、NO3--N含量及有效态氮总量分别显著提高了246.77%和184.41%、53.46%和51.10%、63.33%和57.91%;营养液供应条件下,与CK2相比,FT1和FT2处理的基质NH4+-N、NO3--N含量及有效态氮总量分别显著提高了400.26%和170.98%、62.85%和36.80%、72.70%和36.95%。在拉秧期,两种养分水平下,以甲基营养型芽孢杆菌处理的基质有效态氮含量有最大值,且NT1和FT1处理的基质有效态氮总含量分别显著高于CK1和CK2处理25.48%和86.46%。
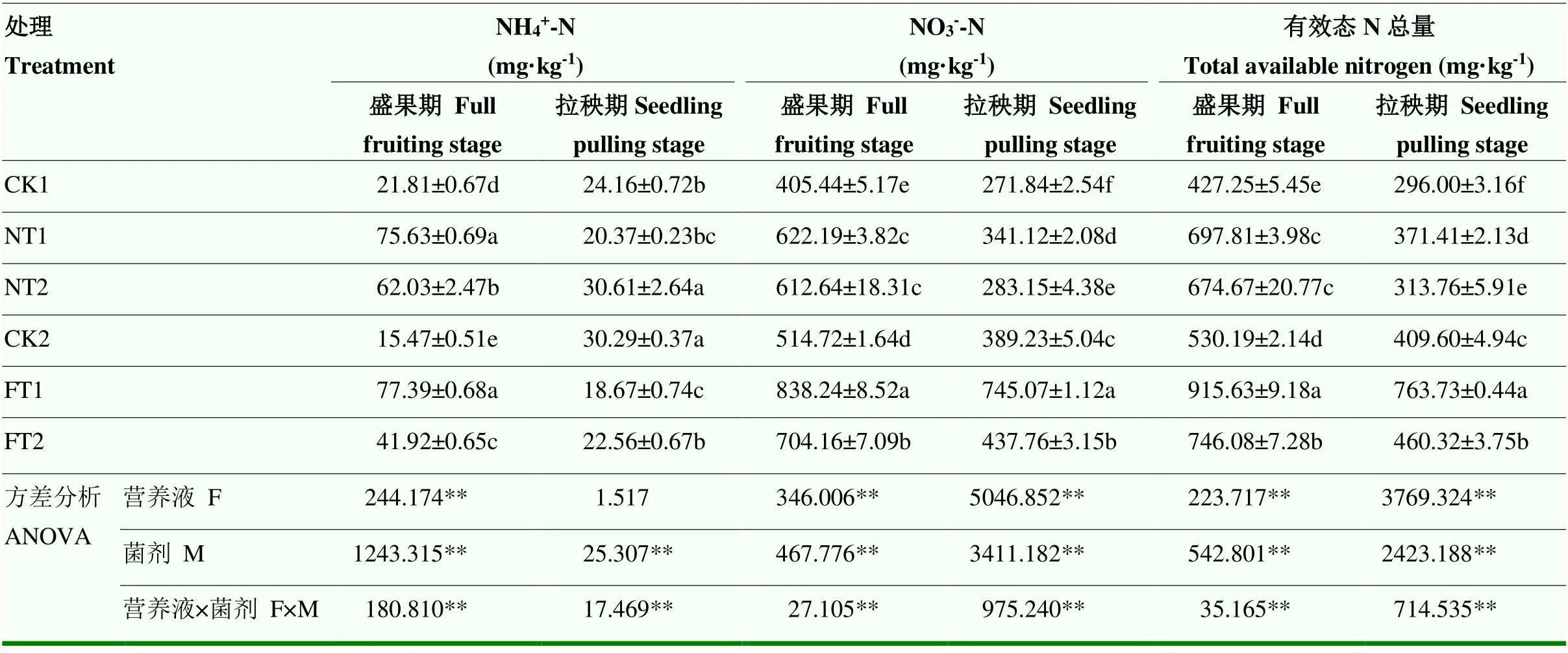
表4 两种微生物菌剂对基质有效态氮含量的影响
2.7 两种微生物菌剂对黄瓜肥料利用率的影响
两种菌剂处理的N、P、K肥料利用率均显著高于CK2对照,其中,FT2处理的N和K肥利用率最高,分别比CK2处理显著提高了102.45%和120.47%,P肥利用率比CK2处理显著提高了367.92%,FT1处理的N、P、K肥料利用率分别比CK2处理显著提高了82.90%、483.79%和75.61%(图3)。
2.8 盛果期根际环境与果实品质的相关性分析
基质酶活性、有效态氮含量与果实品质的相关性分析结果表明(表5),基质脲酶活性与果实游离氨基酸、维生素C含量有极显著正相关性(<0.01),与有机酸和可溶性糖含量呈显著正相关(<0.05);基质蔗糖酶活性仅与果实还原糖含量呈显著正相关(<0.05)。基质过氧化氢酶活性除与可溶性总糖和还原糖含量有极显著正相关性外,还与果实维生素C含量显著正相关(<0.05),而基质磷酸酶活性与果实游离氨基酸和可溶性总糖含量呈极显著正相关,与有机酸和维生素C含量呈显著正相关(<0.05)。基质有效态氮含量中,NH4+-N含量仅与果实还原糖含量呈显著正相关性(<0.05),而NO3--N含量、有效态氮总量与果实游离氨基酸、有机酸、可溶性总糖、还原糖和维生素C含量均有极显著正相关性(<0.01)。
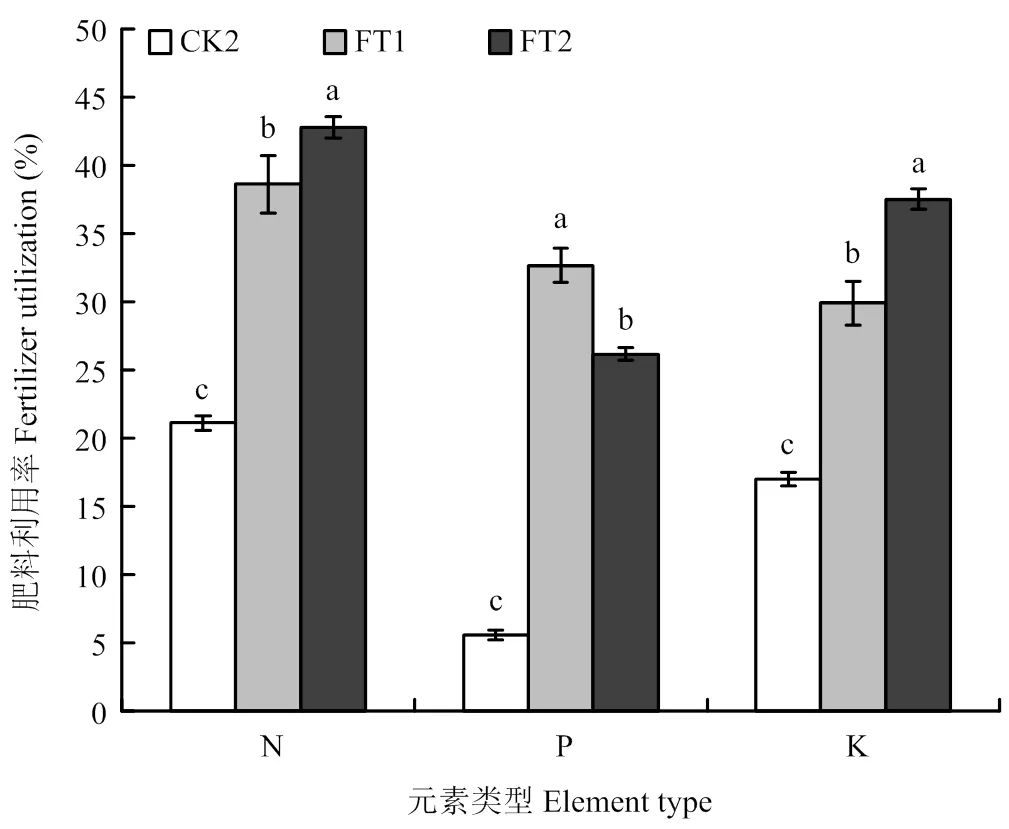
图3 两种微生物菌剂对黄瓜肥料利用率的影响
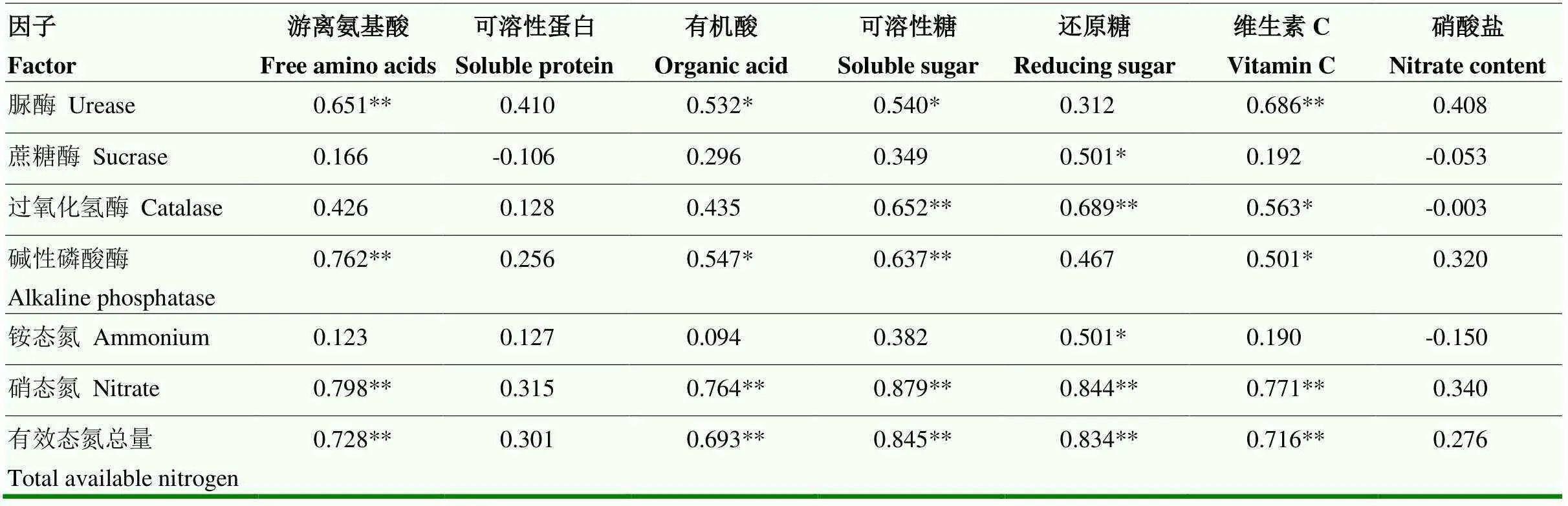
表5 盛果期根际环境与果实品质的相关性分析
3 讨论
农业生态系统中,根际有益微生物不仅通过影响根际介质结构与肥力[21],间接影响作物生产过程,还可通过定殖于作物根系表面或其内部[22],直接影响植物的生长与健康,其作用机制主要包括:通过矿化、硝化等过程活化土壤养分[23],提高速效养分供给量;合成IAA、GA等植物生长调节物质[24-25],促进植株生长发育;分泌水解酶、抗菌素等代谢产物防治土传病虫害[26];诱导作物抗逆性等,在促进土壤或基质能量转化和物质循环的同时[27-28],也调节着植物生长发育过程[29],促使达到增产提质的最终目的。外源添加微生物制剂可促使根际形成合理的微生物群落结构,提高根际养分平衡供应能力,维持根际生态系统稳定性和可持续性,进而提高作物产量和品质。但不同微生物菌剂的功能、作用方式及其最适作用浓度间存在差异。枯草芽孢杆菌菌剂在5×105—10×105CFU/株范围内灌根处理,可通过促进植株元素吸收量进而促进黄瓜秧苗的生长,提高成苗质量[30];解淀粉芽孢杆菌FZB-42在2.5×1011CFU/株菌剂用量下能够显著促进番茄和黄瓜对养分的吸收、积累,进而加快茎、叶和根系的生长速度,提高其产量[31];短短芽孢杆菌CH1和枯草芽孢杆菌CH2菌剂在109CFU/mL浓度下浸种处理后可加快黄瓜生长速度,提高其干物质和元素积累量,并有效提高可溶性糖、Vc和蛋白质等品质指标含量[32]。本研究发现,灌根添加7.5×1010CFU/株甲基营养型芽孢杆菌和植物乳杆菌菌剂在不同养分水平条件下均可促进黄瓜植株干物质积累和产量形成,且甲基营养型芽孢杆菌的增产效果更稳定。前人研究表明,根际接种海洋侧孢短芽孢杆菌和细黄链霉菌菌剂可显著提高黄瓜和番茄的游离氨基酸、可溶性糖、可溶性蛋白等营养品质[33],根际接种链霉菌S506菌剂后黄瓜果实可溶性固形物、维生素C等含量显著升高,而硝态氮含量显著降低[34],本试验发现,在两种养分水平下,甲基营养型芽孢杆菌和植物乳杆菌灌根处理均可提高黄瓜果实品质,但不同养分水平下对果实品质影响效果存在差异,整体上以营养液供应配合添加甲基营养型芽孢杆菌处理的黄瓜品质最优。结合不同养分水平条件下基质速效养分含量和植株元素积累量的变化趋势推测,在灌溉清水条件下,施入两种菌剂均可促进基质有机氮等有机养分的转化,在满足微生物自身生长需求的同时,提高了基质速效氮的供应量和果实氮素分配总量,进而引起植株的生理代谢过程变化,因此,黄瓜果实的游离氨基酸、硝态氮含量显著提高,但由于无外源养分供应时,基质元素供应量有限,随栽培时间延长,微生物的作用效果降低;而在营养液供应时,根际养分相对充足,“根际环境-微生物-植株”之间的互作关系发生改变,根系生长健壮,微生物的根系趋化性增强,更趋向参与植株对元素吸收的调节和对养分平衡运输的调控,并促使果实品质指标整体提升。但其具体机制仍待进一步研究。
根际微生物作为基质生物肥力的核心,其养分活化功能主要包括溶解无机磷、分解有机磷、氮素矿化和钾素释放与固定等[35],而分泌土壤酶是其发挥作用的有效途径之一。土壤酶活性强弱是表征土壤熟化和肥力水平高低的重要指标[28]。植株根际接种微生物菌剂可提高土壤脲酶、蔗糖酶、碱性磷酸酶、过氧化氢酶活性,但在植株不同生长阶段影响效果不同,且基质酶活性与微生物数量和作用时间有关[36]。本研究结果表明,两种微生物菌剂对营养液供应的基质酶活性影响效果大于浇灌清水,且甲基营养型芽孢杆菌对基质脲酶和碱性磷酸酶的影响优于植物乳杆菌,而蔗糖酶和过氧化氢酶受植物乳杆菌影响更大。这表明根际养分水平和植株长势会显著影响菌剂对土壤酶活性的调控,在无营养液供应条件下,基质有机质含量高而速效养分含量低,根际添加菌剂后促进基质中有机养分向速效养分转化,造成基质中速效养分含量和植株元素吸收、积累量提高,但由于无营养供应时微生物定殖、代谢、扩繁所必须养分相对匮乏,因此微生物的繁殖系数较低。同时,可能受酶反应底物含量的影响,前期底物分解较快,而中后期底物缺乏,造成基质脲酶活性降低,但有效态氮含量的增加不仅与脲酶活性有关,与基质硝酸还原酶、亚硝酸还原酶等基质酶活性均有关,因此,结合菌剂处理后基质有效态氮含量和脲酶活性的变化趋势推测,在无营养液供应时,两种微生物菌株可通过除脲酶外的其他酶促或非酶促途径提高基质有效态养分供给量;而在营养液供应条件下,根际养分相对充足,微生物可有效定殖和扩繁,持续促进根系生长及对元素的吸收与利用,且该条件下植株生长相对健壮,微生物和植株的协同分泌作用使基质酶活性普遍提高,即使在拉秧期,基质速效养分含量和植株长势仍优于无营养液供应组分,该结果与闫杨等[37]的研究结果相同,后期可继续深入研究两种微生物菌株对基质元素转化的具体作用机制。
本试验条件下,营养液和菌剂对黄瓜产量和游离氨基酸、可溶性蛋白和维生素C含量等品质指标均有极显著影响,但整体来看,营养液对黄瓜产量和品质的影响更大,说明虽然施用两种微生物菌剂在不同养分水平条件下均可提高黄瓜产量和果实品质,但其影响效果仍不能完全替代外源养分供应对黄瓜产量、品质的促进作用。因此,在应用过程中,结合外源养分供应,有助于达到更优的增产提质效果。此外,研究结果显示,NO3--N含量和有效态氮总量与果实品质指标间相关性较强,脲酶、碱性磷酸酶、NO3--N含量和有效态氮总量均与游离氨基酸含量呈极显著正相关,这表明根际添加微生物菌剂可能引起植株氮代谢等生理代谢过程的变化。
4 结论
在两种养分水平条件下,用7.5×1010CFU/株甲基营养型芽孢杆菌或植物乳杆菌菌剂灌根均可通过提高基质酶活性,加速根际速效养分的供给,提高根际有效态氮等速效养分含量,加速植株对元素的吸收、转运、同化和积累,提高养分利用率,进而提高黄瓜产量和品质,且以营养液供应条件下添加甲基营养型芽孢杆菌的FT1处理产量和品质效果最优。综上,在有机基质栽培方式下,推荐在营养液供应时配合添加7.5×1010CFU/株‘VL-10’型甲基营养型芽孢杆菌菌剂。
[1] 孙光闻, 陈日远, 刘厚诚. 设施蔬菜连作障碍原因及防治措施. 农业工程学报, 2005, 21(增刊): 184-188.
SUN G W, CHEN R Y, LIU H C. Causes and control measures for continuous cropping obstacles in protected vegetable cultivation. Transactions of the Chinese Society for Agricultural Machinery, 2005, 21(Supp): 184-188. (in Chinese)
[2] 徐小莲. 我国蔬菜无土栽培现状与发展趋势. 农业工程, 2019, 10(9): 121-123.
XU X L. Current situation and development trend of vegetable soilless cultivation in China. Agricultural Engineering, 2019, 10(9): 121-123. (in Chinese)
[3] 祝英, 彭轶楠, 巩晓芳, 张军, 王治业, 郭增祥, 马坤源, 周剑平, 杨晖. 不同微生物菌剂对当归苗生长及根际土微生物和养分的影响. 应用与环境生物学报, 2017, 23(3): 511-519.
ZHU Y, PENG Y N, GONG X F, ZHANG J, WANG Z Y, GUO Z X, MA K Y, ZHOU J P, YANG H. Effects of different microbial agents on growth of Angelica sinensis and microorganism population and nutrients of rhizosphere soil. Chinese Journal of Applied & Environmental Biology, 2017, 23(3): 511-519. (in Chinese)
[4] 李艳玲. 根际微生物群落对挥发性有机物和作物生长的影响[D]. 北京: 中国农业科学院, 2019.
LI Y L. Effects of rhizosphere microbiomes on volatile organic compounds and crop growth [D]. Beijing: Chinese Academy of Agricultural Sciences, 2019. (in Chinese)
[5] 蒋静静, 屈锋, 苏春杰, 杨剑锋, 余剑, 胡晓辉. 不同肥水耦合对黄瓜产量品质及肥料偏生产力的影响. 中国农业科学, 2019, 52(1): 86-97.
JIANG J J, QU F, SU C J, YANG J F, YU J, HU X H. Effects of different water and fertilizer coupling on yield and quality of cucumber and partial factor productivity of fertilizer. Scientia Agricultura Sinica, 2019, 52(1): 86-97. (in Chinese)
[6] 王鹏勃, 李建明, 丁娟娟, 刘国英, 潘铜华, 杜清洁, 常毅博. 水肥耦合对温室袋培番茄品质、产量及水分利用效率的影响. 中国农业科学, 2015, 48(2): 314-323.
WANG P B, LI J M, DING J J, LIU G Y, PAN T H, DU Q J, CHANG Y B. Effect of water and fertilizer coupling on quality, yield and water use efficiency of tomato cultivated by organic substrate in bag. Scientia Agricultura Sinica, 2015, 48(2): 314-323. (in Chinese)
[7] 徐刚, 高文瑞, 王欣, 李德翠, 孙艳军, 韩冰, 史珑燕. 水肥耦合对基质栽培辣椒前期产量和光合作用的影响. 中国农学通报, 2018, 34(14): 40-47.
XU G, GAO W R, WANG X, LI D C, SUN Y J, HAN B, SHI L Y. Water and fertilizer coupling effect on early yield and photosynthesis of pepper cultivated in organic substrate. Chinese Agricultural Science Bulletin, 2018, 34(14): 40-47. (in Chinese)
[8] MADHAIYAN M, POONGUZHALI S, KWON S W, SA T M.sp. nov. a methanol-utilizing, plant-growth promoting bacterium isolated from rice rhizosphere soil. International Journal of Systematic and Evolutionary Microbiology, 2010(60): 2490-2495.
[9] 吕倩, 胡江春, 王楠, 王雪梅, 王书锦. 南海深海甲基营养型芽孢杆菌SHB114抗真菌脂肽活性产物的研究. 中国生物防治学报, 2014, 30(01): 113-120.
LÜ Q, HU J C, WANG N, WANG X M, WANG S J. Anti-fungal lipopeptides produced bySHB114 isolated from South China sea. Chinese Journal of Biological Control, 2014, 30(1): 113-120. (in Chinese)
[10] 康兴娇, 申红妙, 贾招闪, 杨佳瑶, 冉隆贤, 甄志先. 葡萄霜霉病生防菌甲基营养型芽胞杆菌T3的鉴定及其防治效果. 中国生物防治学报, 2016, 32(6): 775-782.
KANG X J, SHEN H M, JIA Z S, YANG J Y, RAN L X, ZHEN Z X. Identification ofT3 and its control effect on grape downy mildew. Chinese Journal of Biological Control, 2016, 32(6): 775-782. (in Chinese)
[11] 刘晶晶, 高丽娟, 师建芳, 王小芬, 袁旭峰, 崔宗均. 乳酸菌复合系和植物乳杆菌提高柳枝稷青贮效果. 农业工程学报, 2015, 31(9): 295-302.
LIU J J, GAO L J, SHI J F, WANG X F, YUAN X F, CUI Z J. Lactic acid bacteria community andimproving silaging effect of switchgrass. Transactions of the Chinese Society for Agricultural Engineering, 2015, 31(9): 295-302. (in Chinese)
[12] 王成, 王益, 周玮, 骈瑞琪, 张庆, 陈晓阳. 植物乳杆菌和含水量对辣木叶青贮品质和单宁含量的影响. 草业学报, 2019, 28(6): 109-118.
WANG C, WANG Y, ZHOU W, PIAN R Q, ZHANG Q, CHEN X Y. Effects of(LP) and moisture on feed quality and tannin content ofleaf silage. Acta Prataculturae Sinica, 2019, 28(6): 109-118. (in Chinese)
[13] 闫艳华, 王海宽, 肖瑞峰, 宗志友, 沈发迪, 孙瑶, 戚薇. 一株乳酸菌对番茄灰霉病的防效及对几种防御酶活性的影响. 微生物学通报, 2011, 38(12): 1801-1806.
YAN Y H, WANG H K, XIAO R F, ZONG Z Y, SHEN F D, SUN Y, QI W. Bio-control effects of a lactic acid bacteria on tomato botrytis blight and its induction on defense-related enzymes. Microbiology, 2011, 38(12): 1801-1806. (in Chinese)
[14] 刘聪, 谯江兰, 仝少杰, 张瑞芳, 周大迈, 张爱军, 王红, 王亚芹. 微生物菌剂对设施甜瓜产量和品质的影响. 江苏农业科学, 2019, 47(19): 168-171.
LIU C, QIAO J L, TONG S J, ZHANG R F, ZHOU D M, ZHANG A J, WANG H, WANG Y Q. Effects of microbial agents on yield and quality of melon in facilities. Jiangsu Agricultural Sciences, 2019, 47(19): 168-171. (in Chinese)
[15] 鲁凯珩, 金清, 曹沁, 李珊珊, 孙舒荣, 蒋秋艳, 金杰人, 凌丽晨, 符歆灏, 杜萱, 肖明. 不同微生物菌剂对田间西红柿品质以及土壤酶活性的影响. 上海师范大学学报(自然科学版), 2019, 48(2): 197-206.
LU K H, JING Q, CAO Q, LI S S, SUN S R, JIANG Q Y, JIN J R, LING L C, FU X J, DU X, XIAO M. Effects of different microbial agents on tomato quality and soil enzyme activity.Journal of Shanghai Normal University (Natural Sciences), 2019, 48(2): 197-206. (in Chinese)
[16] 高君凤. 植物生理学实验指导. 北京: 高等教育出版社, 2006.
GAO J F. Plant Physiology Experiment Guidance. Beijing: Higher Education Press, 2006. (in Chinese)
[17] 张佼, 屈锋, 朱玉尧, 杨甲甲, 胡晓辉. 增施有机肥和微生物菌剂对春季杨凌设施番茄产量和品质的影响. 西北农业学报, 2019, 28(5): 767-773.
ZHANG J, QU F, ZHU Y Y, YANG J J, HU X H. Effects of more organic fertilizer and microbial agents on yield and quality of spring greenhouse tomato in Yangling. Acta Agriculturae Boreali- Occidentalis Sinica, 2019, 28(5): 767-773. (in Chinese)
[18] 关松荫. 土壤酶及其研究法. 北京: 农业出版社, 1986.
GUAN S Y. Soil Enzyme and Its Research Method. Beijing: Agricultural Publishing House, 1986. (in Chinese)
[19] 鲍士旦. 土壤农化分析第三版. 北京: 中国农业出版社, 2000.
BAO S D. Third Edition of Soil Agrochemical Analysis (3rd edition). Beijing: China Agricultural Publishing House, 2000. (in Chinese)
[20] 李格, 白由路, 杨俐苹, 卢艳丽, 王磊, 张静静, 张银杰. 华北地区夏玉米滴灌施肥的肥料效应. 中国农业科学, 2019, 52(11): 1930-1941.
LI G, BAI Y L, YANG L P, LU Y L, WANG L, ZHANG J J, ZHANG Y J. Effect of drip fertigation on summer maize in North China., 2019, 52(11): 1930-1941. (in Chinese)
[21] BERENDSEN R L, PIETERSE C M J, BAKKER P A H M. The rhizosphere microbiome and plant health. Trends in Plant Science, 2012, 17(8): 478-486.
[22] CROWLEY D. Microbial Siderophores in The Plant Rhizosphere. Iron Nutrition in Plants and Rhizospheric Microorganisms:Springer Netherlands, 2006: 169-198.
[23] 陆引罡, 谢永平, 湛方栋, 丁美丽. 植烟黄壤微生物生态特征与氮素的矿化和硝化作用. 中国烟草科学, 2010, 31(2): 29-33.
LU Y G, XIE Y P, ZHAN F D, DING M L. Microbial ecological characteristics and nitrogen mineralization and nitrification in tobacco growing yellow soil. Chinese Tobacco Science, 2010, 31(2): 29-33. (in Chinese)
[24] ESITKEN A, PIRLAK L, TURAN M, Sahin F. Effects of floral and foliar application of plant growth promoting rhizobacteria(PGPR) on yield, growth and nutrition of sweet cherry. Scientia Horticulturae, 2006, 110(4): 324-327.
[25] HAN J G, SUN L, DONG X Z, CAI Z Q, SUN X L, YANG H L, WANG Y S, SONG W. Characterization of a novel plant growth-promoting bacteria strainHR4 both as a diazotroph and a potential biocontrol agent against various plant pathogens. Systematic and Applied Microbiology, 2005, 28: 66-76.
[26] PINEDA A, ZHENG S J, VANLOON J J, PIETERSE M J, DICKE M. Helping plants to deal with insects: The role of beneficial soil-borne microbes. Trends in Plant Science, 2010, 15(9): 507-514.
[27] MENG Q, JIANG H, HAO J J. Effects of Bacillus velezensis strain BAC03 in promoting plant growth. Biological Control, 2016, 98: 18-26.
[28] POONGUZHALI S, MADHAIYAN M, SA T M. Cultivation-dependentcharacterization of rhizobacterial communities from field grown Chinese cabbagesppand screening of traits for potential plant growth promotion. Plant Soil, 2016, 286: 167-180.
[29] TORAL L, RODRIGUEZ M, BEJAR V, SAMPEDRO I. Antifungal activity of lipopeptides fromXT1 CECT8661 against. Front Microbiol, 2018, 9: 1315.
[30] 康少辉, 苏浴源, 栗淑芳, 申领艳, 闫凤岐, 刘晓婕, 吕丽霞. 不同浓度枯草芽孢杆菌对黄瓜秧苗长势和质量的影响. 河北农业科学, 2014, 18(3): 52-53, 56.
KANG S H, SU Y Y, LI S F, SHEN L Y, YAN F Q, LIU X J, LÜ L X. Effects of different concentrations ofon the growth and quality of cucumber seedlings. Journal of Hebei Agricultural Sciences, 2014, 18(3): 52-53, 56. (in Chinese)
[31] 蒋春良. 解淀粉芽孢杆菌FZB42 sRNA Igr3927的表达和功能研究[D]. 南京: 南京林业大学, 2015.
JIANG C L. Bacillus amyloliquefaciens FZB42 sRNA Igr3927 transcription analysis [D]. Nanjing: Nanjing Forestry University, 2015. (in Chinese)
[32] 杨文香, 张汀, 刘大群. 三株链霉菌对黄瓜白粉病及黄瓜生长的影响. 河北农业大学学报, 2005, 28(4): 80-83, 92.
YANG W X, ZHANG D, LIU D Q. Effects of threestrains on the growth of cucumber plant and against cucumber powdery mildew. Journal of Agricultural University of Hebei, 2005, 28(4): 80-83, 92. (in Chinese)
[33] 朱金英. 微生物菌剂在设施黄瓜和番茄上的应用效果研究[D]. 泰安: 山东农业大学, 2014.
ZHU J Y. Study on the application of microbial agents in cucumber and tomato cultivated in greenhouse [D]. Tai’an: Shandong Agricultural University, 2014. (in Chinese)
[34] 张翠绵, 李洪涛, 李晓芝, 贾楠, 胡栋, 王占武. 链霉菌S506对设施黄瓜根际生态和生产性状的影响. 中国农业科技导报, 2010, 12(5): 98-102.
ZHANG C M, LI H T, LI X Z, JIA N, HU D, WANG Z W. Effect ofsp. S06 on rhizosphere ecosystem and production traits of cucumber in facilities. Journal of Agricultural Science and Technology, 2010, 12(5): 98-102. (in Chinese)
[35] 陆雅海, 张福锁. 根际微生物研究进展. 土壤, 2006, 38(2): 113-121.
LU Y H, ZHANG F S. The advances in rhizosphere microbiology.Soil, 2006, 38(2): 113-121. (in Chinese)
[36] 庞强强, 蔡兴来, 周曼, 赵枢纽, 李德明. 微生物菌肥对设施白菜生长、品质和土壤酶活性的影响. 热带农业科学, 2018, 38(4): 20-23.
PANG Q Q, CAI X L, ZHOU M, ZHAO S N, LI D M. Effects of microbial fertilizer on the growth, quality and soil enzyme activities of pakchoi in the solar greenhouse. Chinese Journal of Tropical Agriculture, 2018, 38(4): 20-23. (in Chinese)
[37] 闫杨, 刘月静, 王帅珂, 曲辉, 范治平, 韩军, 程文静, 陈芳. 生防芽孢杆菌对黄瓜根际土壤酶活性的影响. 江苏农业科学, 2019, 47(7): 108 - 111.
YAN Y, LIU Y J, WANG S K, QÜ H, FAN Z P, HAN J, CHENG W J, CHEN F. Effect of biocontrol bacillus on the enzyme activity of the rhizosphere soil of cucumber. Jiangsu Agricultural Sciences, 2019, 47(7): 108-111. (in Chinese)
Effects of Two Microbial Agents on Yield, Quality and Rhizosphere Environment of Autumn Cucumber Cultured in Organic Substrate
WANG JunZheng, ZHANG Qi, GAO ZiXing, MA XueQiang, QU Feng, HU XiaoHui
College of Horticulture, Northwest A&F University/Key Laboratory of Protected Horticultural Engineering in Northwest, Ministry of Agriculture and Rural Affairs, Yangling 712100, Shaanxi
【】A bag-cultivated experiment was conducted to test the potential of two microbial agents (and) on the yield, quality and rhizosphere environment of autumn cucumber using organic substrate as a growth medium. The results of the experiment were helpful to develop the new functional type of microbial agents to guide the high quality and high efficiency production of cucumber. 【】Cucumber cultivar ‘Bonai 526’ was sown in a bag of organic substrate. There were a total of six treatments, including CK1 (Irrigation of water and non-application of microbial agents), NT1 (Irrigation of water and application ofagents), NT2 (Irrigation of water and application ofagents), CK2 (Irrigation of nutrient solution and non-application of microbial agents), FT1 (Irrigation of nutrient solution and application ofagents), and FT2 (Irrigation of nutrient solution and application ofagents). The microbial agents (‘VL-10’ andas ‘LYS-1’) were added to the cucumber rhizosphere at the rate of 2.5×1010CFU/plant on 20th, 35th and 50th day. 【】Compared with CK1 and CK2 treatment,inoculation in both of the nutrient levels increased the dry matter content by 13.51% and 15.02%, and yield by 20.83% and 15.63%, respectively;increased the dry matter content by 11.43% and 8.42%, and the yield by 17.42% and 14.96%, respectively. The fruit quality under FT1 treatment was the best; compared with CK2 treatment, its content of free amino acid, organic acid, soluble sugar, reducing sugar and vitamin C were significantly increased by 10.61%, 28.93%, 22.92% and 39.88%, respectively, , followed by FT2 treatment. The accumulation of phosphorus and potassium were significantly higher under both NT1 (7.43% and 10.60%) and NT2 (13.50% and 8.19%) compared with CK1 treatment (<0.05). Compared with CK2 treatment, the accumulation of nitrogen, and potassium were significantly higher under FT2 (24.18% and 26.25%), while the phosphorus concentration in plants were significantly higher under FT1 (17.16%). Compared with CK2 treatment, the nitrogen, phosphorus and potassium fertilizer utilization rates under FT1 treatment were significantly increased by 82.85%, 483.90% and 75.60% (<0.05), respectively, which under FT2 treatment was significantly increased by 102.42%, 367.98% and 120.46%, respectively (<0.05). Compared with CK1 treatment, the treatments NT1 and NT2 improved soil enzymatic activities of sucrase (100.66% and 116.60%), catalase (3.39% and 4.10%) and alkaline phosphatase (6.99% and 95.08%) at the full fruiting stage, among which catalase and alkaline phosphatase activities were still higher at the end of the experiment. Compared with CK2 treatment, the FT1 treatment significantly improved soil enzymatic activities of urease (3.75% and 13.13%), sucrase (68.62% and 31.68%) and alkaline phosphatase (18.00% and 109.64%) in the full fruiting period and the seedling pulling period, while the urease (4.95% and 6.12 %), sucrase (24.93% and 63.35%) and alkaline phosphatase activity (26.99% and 84.01%) under FT2 treatment (<0.05). The effect ofagent on the urease and alkaline phosphatase activities were better than that ofagent. Moreover, the substrate incubated withshowed significantly higher available nitrogen content (63.33% and 72.70%) (<0.05) compared with their respective controls at the full fruiting stage, and the increase was 25.48% and 86.46% at the end of the experiment, respectively. 【】In conclusion, adding 7.5×1010CFU/plant ofto the substrate could improve the rhizosphere environment of cucumber and promote the absorption, assimilation and accumulation of essential elements by the plant. Moreover, it could effectively improve the yield and fruit quality of cucumber.
microbial agents; cucumber; substrate cultivation; yield; fruit quality; rhizosphere environment

10.3864/j.issn.0578-1752.2021.14.013
2020-08-30;
2020-11-24
陕西省重点研发计划(2019TSLNY01-05)、陕西省农业科技创新转化项目(NYKJ-2019-YL02,NYKJ-2020-YL-09)、西北农林科技大学试验示范站(基地)科技创新与成果转化项目(TGZX2019-23)
王君正,E-mail:wjz20190915@163.com。通信作者胡晓辉,E-mail:hxh1977@163.com
(责任编辑 赵伶俐)

