基于植物电信号的小麦苗期等渗干旱胁迫与盐胁迫辨识
李进海 李 洋 RICARDO Ferraz de Oliveira 姚杰鹏 黄 岚 王忠义
(1.中国农业大学信息与电气工程学院, 北京 100083;2.中国农业大学现代精细农业系统集成研究教育部重点实验室, 北京 100083;3.中国农业大学农业农村部农业信息获取技术重点实验室, 北京 100083;4.圣保罗大学路易斯·德奎罗兹农业学院, 皮拉西卡巴 3538709)
0 引言
干旱胁迫与盐胁迫是植物在生长发育过程中两种常见的非生物胁迫,是导致作物减产的重要原因,严重威胁着粮食安全[1-2]。干旱造成的高渗透胁迫会导致植物细胞脱水、胞内膨压降低,从而破坏植物体内的水分平衡。长时间的干旱胁迫会进一步产生次级胁迫,导致植物代谢发生紊乱,使细胞膜的选择透性发生改变、无机盐离子与各类小分子外渗[3-5]。如果不能及时缓解干旱,则细胞会发生自溶,甚至在质膜和液泡膜上产生机械破裂,最终导致植物死亡。盐胁迫又被称为盐害,是由于土壤中盐分过多而产生的一种常见逆境胁迫,可分为原初盐害和次生盐害[1]。原初盐害破坏植物细胞质膜的选择透性,扰乱细胞正常代谢,使大量的K+和有机溶质外流,同时大量毒害离子进入胞质,产生离子毒害;次生盐害则进一步导致细胞水分亏缺,产生生理干旱,从而抑制作物生长[6-8]。干旱胁迫与盐胁迫都属于逆境胁迫,如果逆境胁迫在作物感知的早期阶段能被及时解除,则胁迫产生的伤害是可逆的,若胁迫继续持续,则对植物细胞的膜系统产生不可逆的伤害,导致作物减产,甚至绝收。因此,在逆境胁迫的早期,准确辨识胁迫、进而采取相应的补救措施对保障作物的生长至关重要。由于干旱胁迫与盐胁迫均会引发渗透胁迫,使植物不能获得充足的水分,导致植物茎叶出现萎蔫等相似的形态变化,这种变化除了采用生理生化方法外,很难用直观的方法进行区分[9-10]。因此有必要探索一种简单有效的干旱胁迫与盐胁迫辨识方法。
鉴于此,本文结合支持向量机在小样本下良好的分类推广能力[11-14],提出一种基于植物电信号的干旱胁迫与盐胁迫辨识方法,以期在胁迫出现的早期实现对这2种胁迫的准确辨识,降低干旱胁迫与盐胁迫对农作物产量和品质的影响。
1 材料与方法
1.1 材料选择与培养
实验样品采用京411品种的小麦(中国农业大学农学院提供)。挑选颗粒饱满的小麦种子浸入0.5%次氯酸钠溶液中消毒30 min,随后用去离子水冲洗干净。将处理后的小麦种子放入去离子水中,并在暗处浸种12 h。挑选萌发一致的种子置于带有发芽纸的培养皿中,以10 mL去离子水浸湿发芽纸,随后放入人工气候培养箱中培养。光照/黑暗(光/暗)周期为14 h/10 h,温度25℃,相对湿度60%。每日添加去离子水,防止发芽纸干涸,4~5 d后可将小麦幼苗用于实验。
1.2 等渗干旱胁迫与盐胁迫处理
本文使用甘露醇溶液和NaCl溶液处理小麦幼苗根部,用以模拟植物在生长过程中遇到的干旱胁迫和盐胁迫。选择长势相近的幼苗分为3组,分别设置为对照组、甘露醇(MAN)胁迫(干旱胁迫)组和NaCl胁迫(盐胁迫)组。为了使小麦幼苗呈现相近的萎蔫状态,配置渗透势相同的甘露醇(324 mmol/L,-1.49 MPa)和NaCl溶液(300 mmol/L,-1.49 MPa)。甘露醇溶液的渗透势计算公式[15]为
ΨMAN=-0.007 8CMANT-2.275CMAN
式中ΨMAN——甘露醇溶液的渗透势,MPa
CMAN——甘露醇溶液的摩尔浓度,mol/L
T——开氏温度,25℃时为298.13 K
NaCl溶液的渗透势按照范托夫公式计算
ΨNaCl=10-6CNaClRT
式中ΨNaCl——NaCl溶液的渗透势,MPa
CNaCl——NaCl溶液的摩尔浓度,mol/L
R——理想气体常数,8.314 J/(K·mol)
由于NaCl在溶液中会完全电离成Na+和Cl-,所以NaCl溶液的渗透势为2倍的ΨNaCl。将培养好的小麦幼苗置于10 mL的小烧杯中,每只烧杯加入5 mL的甘露醇或NaCl溶液胁迫小麦根部12 h,对照组则继续使用去离子水培养。对照组设置的目的是为了验证电信号是否能够辨识胁迫。
1.3 植物电信号采集
植物电信号的采集采用文献[16-17]中的方法,通过光/暗循环刺激产生稳定的叶表面电位,前期研究将这种电位称为光诱导生物电发生(Light-induced bioelectrogenesis,LIB)[18-19]。图1a为植物电信号测量盒。测量盒分为相互独立的4室,在嵌有Ag/AgCl电极(图1a中Ei)的盒盖与盒底分别加入琼脂凝胶用作叶表面电位的记录电极。记录电极的制备方法为:用磁力搅拌器搅拌并加热琼脂溶液(50 mL;0.5%琼脂和10 mmol/L KCl),直到琼脂溶液沸腾。随后分别在每个独立室的盒盖与盒底加入15 mL沸腾后的琼脂溶液,盒盖与盒底处的Ag/AgCl电极完全浸入琼脂溶液中。当琼脂溶液凝固为琼脂凝胶后,即完成了记录电极的制备。埋入式Ag/AgCl电极连接信号采集系统(RM6240BD型,成都仪器厂),记录电极(Ei+)和参比电极(Ei-)则分别连接到采集系统探头的输入端和接地端。由于植物电信号属于微弱信号,需要在探头与采集系统间连接高输入阻抗放大器(SWF-1B型,成都仪器厂)才能有效测量。使用卤钨灯(MHAA-100W型,MORITEX,日本)作为刺激光源,光源放置在法拉第屏蔽网外。鹅颈式光纤(A08400型,MORITEX,日本)穿过屏蔽网,光纤的一端位于记录电极上方10 cm处。该方法可同时采集4株小麦幼苗的叶表面电位。光/暗刺激的循环周期为20 min(光、暗各10 min),光通量密度为240 μmol/(m2·s)。由于植物电信号相较于动物信号而言属于慢变信号,因此采用直流模式采集[20]。图1b为不同胁迫模式下采集到的单周期小麦叶表面电位,用于干旱胁迫与盐胁迫的早期识别。
2 数据处理与方法实现
2.1 波形选择
光/暗循环刺激产生的植物叶表面电位在波形上具有很好的重复性,但在刺激开始的早期,波形的规律性变化尚不十分明显,需要经过2~3个完整周期后才能达到稳定,因此本文选取第4个完整的光/暗周期的波形用于等渗条件下的干旱胁迫与盐胁迫的识别(图2)。
2.2 数据预处理
数据提取时,间隔2 s取一点,20 min共计588个点(计时器存在误差,实际时间略短于20 min)。由于参考电位、接触电位和植株个体差异的影响,不同样本表面电位的基线值并不相同,因此在分类前需要对采集的数据进行去基线处理,同时为了使分类模型加速收敛,分别对每个样本数据进行归一化处理。归一化公式为
(1)
式中Xnew——归一化值
X——原始信号幅值
Xmax——原始信号最大幅值
Xmin——原始信号最小幅值
每个信号样本包含588数据点,每个数据点作为一个特征。
2.3 基于一对一分类策略的支持向量机
SVM算法最初被广泛应用于二值分类问题,后被推广到有M个类的分类问题。处理M类分类问题时,需要构造一系列多类分类机。OVOSVM即是在每2个类之间都构造一个二类分类SVM[21-22]。对于一个M类多分类问题,可得
(2)
式中t——第i类和第j类数据并集中样本的索引
φ——输入空间到特征空间的非线性映射
C——惩罚参数
ω——分类超平面法方向
b——偏置
ξ——引入的松弛变量
xt——第t个样本
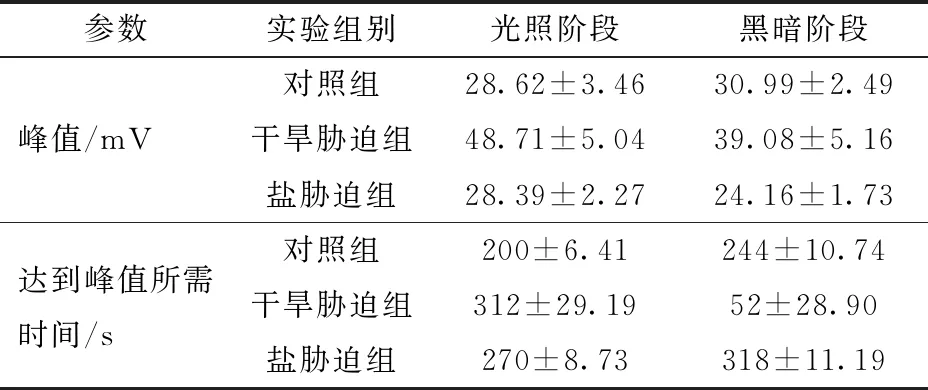
对于第i类和第j类数据,i,j∈{1,2,…,M},i 光/暗循环刺激下出现的植物叶表面电位在幅值上的波动,是叶片与记录电极接触处的群体细胞(叶肉细胞、表皮细胞和保卫细胞)膜电位在时空变化时叠加的结果,而非单一某种细胞的单独作用。因此,光/暗诱导叶表面电位的波形形状不同于强光刺激下任一类型细胞膜电位的变化,其波形幅值低于光刺激下单个叶肉细胞产生的膜电位的振幅[23]。这可能是由于在相同的光照条件下,不同种类细胞表现出不同的极化状态或极化幅度造成的。叶肉细胞和表皮细胞的质膜在强光刺激下去极化,而保卫细胞的质膜则表现为超极化,这使得群体细胞膜变化的叠加态在时空变化时的幅值存在相互抵消的情况。光诱导产生的植物叶表面电位的波形与幅值主要与光通量密度、光质和光/暗周期3个因素有关[24]。光通量密度主要影响波形的幅度,在一定范围内光通量密度与幅值成正比,光通量密度越大,波形的峰峰值越大,但当光通量密度达到一定数值时,波形不再有明显变化。对于小麦,220 μmol/(m2·s)左右的光通量密度即可使波形的变化幅度趋于稳定。光诱导植物叶表面电位与光质密切相关,其对绿光的敏感性最低,而蓝光诱导的波形变化则接近全光谱时的波形,由于蓝光对叶肉细胞的刺激性最强[25-26],因此在光诱导产生的植物叶表面电位中,叶肉细胞对电位变化的贡献度最大。光/暗周期的长短设置对波形的变化趋势影响很大,光/暗周期选择的依据是有足够的时长使电位变化趋于恒定。如图3所示,不同胁迫下,以10 min/10 min为周期的光/暗循环刺激均可使波形达到峰值后进入相对稳定的变化状态。但不同胁迫下光诱导植物电信号的峰值幅度以及波形进入峰值的所需时间不同(表1),这些差异化的特征,可以用于辨识不同类型的胁迫。在此基础上,为了提高分类的准确性,每个波形样本的所有数据点均作为特征点。 表1 不同胁迫下光诱导叶表面电位的峰值及达到峰值所需时间 采用多分类支持向量机对正常条件下的样本以及等渗干旱胁迫和盐胁迫条件下的样本进行分类,随机划分样本的训练集与测试集,对所建立的模型,采取网格搜索法对惩罚因子C与高斯核γ进行参数选择。为了进一步得到最优参数,实验均采用三折交叉验证。另外,在投票之前先对正常样本与干旱胁迫样本、正常样本与盐胁迫样本、干旱胁迫样本与盐胁迫样本分别做出预测,用以验证植物叶表面电位是否可以用于胁迫辨识,随后对3种样本进行投票预测。最后经过网格搜索,得到最优参数。实验结果如表2所示。 表2 分类结果 本课题组曾采用以提取主成分作为特征,选择波形参数等方法对电信号进行分类,但因为无法利用波形的细节信息导致分类效果受到影响[16];也曾利用一维卷积神经网络自动提取波性特征用于分类[17],这类深度学习的方法需要较多的样本。因此,以整个波形数据点作为特征进行分类。使用OVOSVM对原始数据进行分类,每个点为一个特征,共计588个特征。3种不同条件下采集的样本数据在三折交叉验证后分类准确率为96.30%,网格搜索得到的最优参数C为16,γ为4,标准差为±0.059 3。正常状态与干旱胁迫以及干旱胁迫与盐胁迫二分类的准确率均达到100%,正常状态与盐胁迫二分类的准确率为94.44%。分类结果表明植物电信号可以用于辨识胁迫,并且可以实现对早期等渗干旱胁迫与盐胁迫的辨识。 植物在外界刺激下会产生电信号,这种信号是植物对外界刺激的最初响应,携带着生理变化产生的信息[27-29]。干旱胁迫与盐胁迫均会产生渗透胁迫,可以影响细胞膜的离子交换过程,但由于胁迫类型不同,影响离子交换的方式也存在巨大差异。干旱胁迫主要导致大量的无机盐离子外流,而盐胁迫则会破坏植物细胞内的Na+/K+平衡,K+大量外流的同时伴随着大量的Na+和Cl-等毒害离子进入细胞。逆境胁迫导致的细胞在离子交换上的差异,必然会使细胞膜电位产生不同的变化。叶表面电位为测试电极与叶片接触处群体细胞膜电位在空间上的叠加,胁迫导致的膜电位变化,宏观上表现为植物对光响应时的敏感性出现差异[23]。相较于膜电位的获取困难,叶表面电位获取相对简单,因此可以通过获取叶表面电位的方法达到辨识早期干旱胁迫与盐胁迫的目的。这种差异在逆境胁迫的早期阶段就可以得到验证,既不需要对形态表型进行长期评估,也不需要使用复杂的生理生化方法进行测量。即使是对于干旱胁迫与盐胁迫这种可导致植物外观形态上出现相似变化的逆境胁迫,辨识的效果也很明显。 (1)提出了一种基于植物电信号的逆境胁迫辨识方法,该方法可在不使用生理生化方法验证的前提下准确辨识胁迫,方法简单有效。 (2)通过光/暗诱导获取的稳定植物叶表面电位,结合支持向量机在小样本下良好的分类推广能力,实现了等渗条件下干旱胁迫与盐胁迫的辨识,本研究可为作物的抗逆与育种研究提供一种新的手段。 (3)植物电信号携带丰富的生理信息,是植物与外界环境信息交流的重要途径,本研究作为植物电信号实际应用范例,可进一步促进植物电信号解译工作的开展。3 结果与讨论
3.1 光/暗刺激诱导的植物叶表面电位及其特征
3.2 多维特征的OVOSVM分类

3.3 光诱导叶表面电位辨识等渗干旱胁迫与盐胁迫的机制
4 结论

