I131联合TSH抑制治疗对术后中高危组甲状腺乳头状癌患者心肌纤维化及心房颤动的影响
汪秀衡 刘克皝 刘 垚 胡恒境
1 南华大学附属第一医院 核医学科(衡阳 421000) 2 中南大学湘雅医院 核医学科(长沙 410000) 3 南华大学附属第一医院心内科(衡阳421000)
甲状腺乳头状癌(PTC)是常见的内分泌系统肿瘤,生物行为温和,恶性程度最低,约占甲状腺癌的85%[1]。临床研究表明,甲状腺乳头状癌手术治疗效果较好,但其易复发和发生转移,影响患者预后[2]。根据2018版甲状腺癌诊疗规范,中、高危组PTC患者手术切除后行I131联合促甲状腺激素(TSH)抑制治疗可以改善患者预后,延长生存期。但在后期随访中发现,PTC患者I131治疗后长期TSH抑制治疗,会加重心脏负担,引发心血管不良事件的发生[3],导致心律失常、心肌缺血、室间隔或室壁肥厚、心脏舒张或收缩功能障碍[4]。长期TSH抑制治疗可能引起心脏节律的异常。研究发现低水平TSH 是心房颤动的独立诱因[5],也是心律失常的独立危险因素。本研究对我院收治的69例中、高危组PTC术后患者予以I131联合TSH抑制治疗随访3年,通过患者症状、心电图、超声心动图、血清心肌纤维化因子及乳酸脱氢酶相关指标,探讨了I131联合TSH抑制治疗对术后中高危组 PTC 患者心肌纤维化及心房颤动的影响。
1 资料与方法
1.1 一般资料
选取2016年8月—2017年8月南华大学附属第一医院收治的甲状腺乳头状癌中、高危组患者69例。男性中危组21例、高危组8例,女性中危组28例、高危组12例,年龄(39.6±3.2)岁。
纳入标准:①患者均行甲状腺全切或近全切手术,术后病理检查确诊为PTC,并经美国癌症联合会(AJCC)第8版复发危险度分层分为中高危组;②术前甲状腺功能指标水平无异常;③所有患者术后均行I131联合TSH抑制治疗,中危组患者 TSH 控制在 0.1~0.5 mU/L,高危组患者 TSH<0.1 mU/L;④患者均签署知情同意书。
排除标准:① PTC 合并心血管相关疾病者;②合并其他类型甲状腺疾病者;③3个月内服用影响心脏结构和功能的药物;④高血压、糖尿病患者;⑤严重肝肾功能障碍者。
1.2 方法
所有患者均行甲状腺全切或近全切手术,I131治疗前对患者问诊,进行心电图、超声心动图、血清心肌纤维化相关因子可溶性基质溶素- 2(sST2)、生长分化因子-15(GDF-15)、半乳糖凝集素- 3 (GAL- 3)及乳酸脱氢酶(LDHA)相关指标检测。术后1月口服I131150 mCi清除残余甲状腺同时兼顾清除残余转移灶,72小时后晨起空腹口服左甲状腺素钠片 [ 商品名:优甲乐;生产厂家: Merck KGaA(德国默克公司);国药准字: H20140052] 行TSH抑制治疗,中危组患者 TSH 控制在 0.1~0.5 mU/L,高危组患者 TSH<0.1 mU/L,且游离性三碘甲状腺原氨酸(T3 )、甲状腺素(T4 )控制在正常范围内。治疗后嘱患者3个月进行1次复诊或自觉不适及时复诊,观察患者心血管系统症状、心房颤动及心肌纤维化发生情况,进行心电图、超声心动图、血清心肌纤维化相关因子可溶性基质溶素- 2(sST2)、生长分化因子-15(GDF-15)、半乳糖凝集素- 3 (GAL- 3)及乳酸脱氢酶(LDHA)相关指标检测,治疗期间动态复查患者甲状腺球蛋白、甲状腺球蛋白抗体、甲状腺及颈部淋巴结彩超及肺部 CT,同时观察患者 TSH 抑制治疗的不良反应,根据复查结果及时调整左甲状腺素钠片剂量,连续治疗并随访3年。
1.3 检测指标
1.3.1 患者主观症状 术前及随访期询问患者主观症状,内容包括是否有心悸、心慌、胸闷、气短、心绞痛、晕厥等症状,是否有严重心血管事件发生情况。医务人员记录并统计例数。
1.3.2 心电图检测 采用同步12导联心电图对术前及随访期患者进行检查,医务人员记录并统计房颤心电图例数。
1.3.3 超声心动图检测 对术前及随访期患者进行超声心动图检测,记录室间隔厚度(IVS)、左房内径 (LA)、左室舒张期内径(LVIDd)、左室射血分数(LVEF)、左室后壁厚度(LVPW)、二尖瓣血流 E 峰流速(MVE)、二尖瓣血流 A 峰流速(MVA),计算 MVE/MVA。
1.3.4 血清乳酸脱氢酶检测 抽取患者术前及随访期肘静脉血 5 mL,采用酶联免疫吸附法检测LDHA含量。试剂盒购于上海科华生物工程股份有限公司。
1.3.5 血清心肌纤维化相关因子检测 抽取患者术前及随访期肘静脉血 5 mL,采用酶联免疫吸附法检测血清心肌纤维化相关因子,包括可溶性基质溶素- 2(sST2)、生长分化因子-15(GDF-15)、半乳糖凝集素- 3 (GAL- 3)。sST2试剂盒和GDF-15试剂盒购于齐一生物科技有限公司,GAL- 3试剂盒购于江莱生物。
1.4 统计学分析

2 结 果
2.1 两组患者I131联合TSH抑制治疗前后心血管系统症状情况比较
治疗前及治疗后1年内,两组患者均未出现心血管系统症状。治疗后2年内,高危组患者中心慌、心悸、胸闷等心血管系统症状发生率 30% (6/20)高于中危组的 4.1% (2/49)。治疗后3年内,高危组患者中心慌、心悸、胸闷等心血管系统症状发生率 40% (8/20)高于中危组的 8.2% (4/49)。整个随访期无患者发生心绞痛等严重心血管事件。
2.2 两组患者I131联合TSH抑制治疗前后心房颤动心电图情况比较
治疗前及治疗后1年内,两组患者均未出现心房颤动。治疗后2年和3年内,高危组患者心房颤动发生率分别为 25% (5/20)、40% (8/20),高于中危组的 6.1% (3/49)、 16.3% (8/49)。
2.3 两组患者I131联合TSH抑制治疗前后超声心动图情况比较
治疗前,两组患者超声心动图指标的差异均无统计学意义(P>0.05)。治疗后,高危组患者IVS(t=5.923, 4.675,P=0.031, 0.037)和LA(t=7.245, 6.676,P=0.023,0.039)高于治疗前及中危组治疗后,高危组患者MVE/MVA(t=- 5.327, - 4.746,P<0.001)、LVIDd(t=- 8.301, - 654,P=0.038,0.029)及LVEF(t=-11.874, -10.856,P=0.027,0.031)水平低于治疗前及中危组治疗后,差异有统计学意义(P<0.05),见表1。
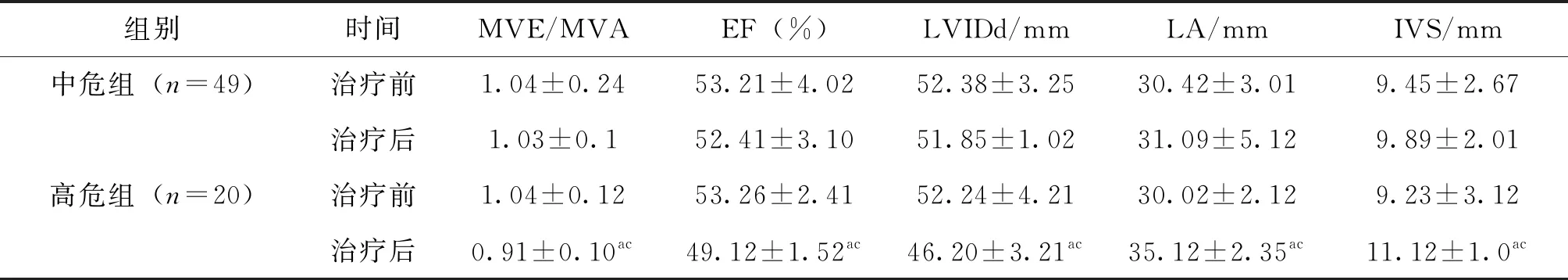
表1 两组患者I131联合TSH抑制治疗前后超声心动图情况比较
2.4 两组患者I131联合TSH抑制治疗前后乳酸脱氢酶比较
治疗前,两组患者血清LDHA水平的差异均无统计学意义(P>0.05)。治疗后,高危组患者血清LDHA(t=14.645, 12.487,P=0.001, <0.001)水平高于治疗前及中危组治疗后,差异有统计学意义(P<0.05),见表2。

表2 两组患者I131联合TSH抑制治疗前后乳酸脱氢酶比较
2.5 两组患者I131联合TSH抑制治疗前后心肌纤维化指标比较
治疗前,两组患者血清sST2、GDF-15及GAL- 3水平的差异均无统计学意义(P> 0.05)。治疗后,高危组患者血清sST2(t=11.453, 10.673,P=0.011, 0.015)、GDF-15(t=14.902, 8.456,P=0.001, 0.001)及GAL- 3(t=18.343, 16.342,P=0.001, 0.001)水平高于治疗前及中危组治疗后,差异有统计学意义(P<0.05),见表3。

表3 两组患者I131联合TSH抑制治疗前后心肌纤维化指标比较
3 讨 论
目前临床对甲状腺乳头状癌治疗以外科手术为主,根据患者病情采取最理想的手术方式,防止肿瘤复发。由于甲状腺解剖结构和位置较为特殊,患者实施外科手术后,易导致甲状腺组织残存,特别是中高危组患者,术后进行I131治疗十分重要[6]。I131通过发射β射线的方式清除残余甲状腺、甲状腺组织中所残留微小病灶及转移灶[7]。甲状腺组织及残留病灶破坏后大量甲状腺激素释放入血,不仅使心肌耗氧量增加,造成心肌氧供失衡,还提高心脏β受体对儿茶酚胺的敏感性,导致冠状动脉痉挛、短暂性栓塞及微循环障碍等,可能诱发心肌病。
PTC是一种激素依赖性肿瘤,肿瘤细胞表面 TSH 受体与TSH特异性结合,通过 PKA 通路调节甲状腺抗体及钠碘转运酶等的表达,促进癌细胞生长[4]。左甲状腺素钠片中存在甲状腺素,利用下丘脑-垂体-甲状腺轴的负反馈调节,能够实现对TSH分泌的有效抑制,减少肿瘤增殖、复发及转移[8]。根据2018版甲状腺癌诊疗规范,中危组患者TSH控制在0.1~0.5 mU/L,高危组患者TSH<0.1 mU/L。长期TSH抑制治疗易造成PTC部分患者术后甲状腺激素水平偏高,通过加重心脏负荷、引起心脏重构及诱发冠状动脉痉挛栓塞导致心律失常、室间隔或室壁肥厚、心脏舒张或收缩功能障碍[9]。本研究探讨69例中高危组患者术后行I131联合TSH抑制治疗3年内心肌纤维化和心房颤动的发生情况,为后续临床治疗提供理论依据。
本次研究通过患者症状、心电图、超声心动图、心肌纤维化因子及血清乳酸脱氢酶指标对I131联合TSH抑制治疗术后中高危组甲状腺乳头状癌患者心肌纤维化及心房颤动的影响。结果表明,I131联合TSH抑制治疗会增加PTC患者心肌纤维化和心房颤动的发生概率,且高危组PTC患者心肌纤维化和房颤的发生率高于中危组。国外文献报道,血浆 TSH 浓度<0.1 mU/L的患者心房颤动发病率比亚临床甲状腺功能亢进状态患者和甲状腺功能正常人群都高[10],与本研究结果相似。I131治疗发射β射线破坏残留甲状腺组织及转移灶释放甲状腺激素会引起心率增快,心肌有效不应期缩短,心电传导加速,心脏负荷过重,导致左心室肥厚[11]。长期低水平的 TSH 可能引起心脏节律的异常,甚至导致心房颤动[12],增加心血管事件的发生。本研究中术后中高危组PTC患者I131联合TSH抑制治疗后2年、3年分别有11.6%和17.4%患者出现胸闷、心悸、心慌、气促等症状,分别有10.1%和15.9%患者出现心房颤动心电图,与文献报道相符。本研究未出现心血管严重事件。但在临床工作中仍应长期随访心血管系统,以减少不良事件的发生并早期干预治疗,避免心血管死亡事件发生。
本研究通过观察患者超声心电图结果发现,治疗后,高危组患者IVS和LA高于治疗前及中危组治疗后,高危组患者MVE/MVA、LVIDd及LVEF水平低于治疗前及中危组治疗后。长期处于低TSH水平患者,可能通过激发体内炎症反应和氧化应激相关信号通路以及肾素-血管紧张素-醛固酮系统导致心肌纤维化及心肌细胞肥大,促进心室重构[13]。本研究发现控制TSH水平越低,患者房颤及心肌纤维化发生概率越高,此发现尚无很多文献报道。通过增加心肌纤维化因子sST2、GDF-15及GAL- 3对患者心肌纤维化评估。 sST2 是白细胞介素(IL)-1 受体家族成员,是炎症和纤维化的生物标志物,sST2 水平是 AF患者全因死亡的独立预测因素[14]。GDF-15是转化生长因子-β超家族成员之一,心肌缺氧和心肌压力负荷增加可引起GDF-15分泌增加,促使GDF-15保护心室心肌细胞抵抗不同凋亡,促进心肌细胞肥厚性生长[15-16]。Gal- 3 是新型的循环标志物, 已证实其参与心肌细胞的凋亡、纤维化的演化过程, 且与心房颤动及心室重构密切相关[17-18]。本研究结果发现治疗后,高危组患者血清sST2、GDF-15及GAL- 3水平高于治疗前及中危组治疗后,与心脏重构时间一致。此外,本研究观察了血清乳酸脱氢酶A水平的变化。LDHA是Warburg 效应的关键酶之一, 既往认为Warburg 效应主要存在于肿瘤细胞中, 但近来发现冠心病、 心衰等纤维化的心肌组织中也存在 Warburg 效应, 且研究发现糖代谢模式的改变涉及房颤的发生发展。本课题组最先发现 Warburg 效应与房颤有相关性[19]。本研究通过观察Warburg 效应关键酶LDHA含量变化来评估I131联合TSH抑制治疗术后中高危组甲状腺乳头状癌患者心肌纤维化及房颤影响。
综上所述,I131联合TSH抑制治疗会增加术后中高危组甲状腺乳头状癌患者心肌纤维化及房颤发生率,且高危组患者心肌纤维化及房颤发生率高于中危组患者。在治疗过程中,对患者应密切随访防止恶性心血管事件发生。针对高危组患者,必要时可提供临床干预。

