输入性新型冠状病毒肺炎首诊影像学特点与临床严重度分级的相关性
吴 莉 ,杨云辉 ,张 靖 ,杨章聪 ,苏 宇 ,温勇坚 ,吴玉春 ,王 鹏 ,李志鹏 ,赵 卫 ,韩 丹 ,王瑞东 ,何 波
(1)昆明医科大学第一附属医院医学影像科,云南 昆明 650032;2)西双版纳州人民医院医学影像科,云南 西双版纳 666100;3)玉溪市人民医院CT室,云南 玉溪 653100;4)威信县人民医院医学影像科,云南 威信 657900;5)大理市第一人民医院放射影像科,云南 大理 671000;6)云南省第三人民医院放射科,云南 昆明 650011;7)寻甸县第一人民医院医学影像科,云南 寻甸 655200;8)云南省第二人民医院放射科,云南 昆明 650021;9)云南省传染医院/云南省艾滋病关爱中心医学影像科,云南 昆明 650300)
2019年12月底中国武汉地区爆发了由新型冠状病毒(SARS-CoV-2)感染引起的肺炎,2020年2月11日WHO正式命名为新型冠状病毒肺炎(Corona Virus Disease-19,COVID-19)。COVID-19来势凶猛,传播速度快,短期内席卷全国,截止目前(2020.03.5)死亡率约为3.43%,虽较SARS(14%~15%,WHO 2003.05.07)及MERS(34.40%,2012)低,但目前全球死亡人数远超过了SARS和MERS死亡的总人数[1]。临床确诊主要采用RTPCR检测新型冠状病毒核酸的方法,但在目前处在疾病爆发时期,存在核酸试剂盒紧缺、检测速度慢,假阴性率较高等缺点[2]。HRCT检查方便快捷,对病变范围显示准确,早期对于疑似病例的筛查、诊断、临床分型、疾病的演变及转归的判断具有不可替代的作用[3],本文总结了云南地区输入性新型冠状病毒肺炎116病例首诊影像学特点,将其与该病的临床分期进行比较,旨在为非武汉地区COVID-19的诊疗提供依据,有助于疾病的早诊断、早隔离、早治疗,助力于疫情防控,减少疾病传播。
1 资料与方法
1.1 一般资料
回顾性收集2020年1月21日至2020年2月25日云南省确诊COVID-19肺炎患者151例,纳入标准:据国家卫生健康委员会颁布《新型冠状病毒感染的肺炎诊疗方案(试行第七版)[4]中的诊断标准确诊病例;确诊3 d内完成首次胸部HRCT检查,有完整的临床及实验室检查资料。排除标准:非输入型病例,临床资料不全。其中输入型病例116例,轻型24例,普通型80例,重型10,危重型2例,平均年龄(41.42±3.08)岁,年龄范围5~84岁,男59例,平均年龄(38.30±2.05)岁,女57例,平均年龄(44.71±9.13)岁。将年龄分为:小于20岁;21岁~50岁;51岁~70岁;大于70岁4组。
1.2 检查方法
所有患者均采用16排及以上Siemens、GE、Philips、联影CT机扫描。扫描范围:肺底至肺尖;扫描参数:管电压120 kV,管电流90~280 mAs,准直0.6~1.25 mm,重建层厚1.0~1.25 mm,重建间隔1.0 mm,矩阵512×512,骨算法重建。肺窗:窗宽1 400 HU/窗位700 HU、纵膈窗:窗宽350 HU/窗位40 HU。
1.3 图像分析
由两名经验丰富,参加昆明医科大学第一附属医院搭建的与咸宁市中心医院“云平台“影像会诊”的高年资影像科副主任医师,采用双盲法对图像进行评价,意见不统一经协商,达成一致后记录,评价内容包括:
(1)累及侧别:左侧肺、右侧肺、双侧肺;
(2)累及部位:双肺上叶、中叶、下叶,累及左肺上叶舌段记为中叶;肺门区、胸膜下区、中间带,在横断、冠状面将肺野由肺门至胸膜等分为三份,最内侧称肺门区、最外侧称胸膜下区,两区间称肺野中区;
(3)累及范围评分:按照经典双肺分段标准,每累及1个肺段按1分计算,共18分;
(4)病变形状:楔形;圆形、椭圆形;带状;盘状。楔形为按肺小叶分布,尖端指向肺门,底部宽与胸膜平行;带状指病变累及范围大于等于2段,长轴与胸膜平行,垂直胸膜测量厚度小于等于1 cm;盘状指病变累及范围大于等于2段,长轴与胸膜平行,垂直胸膜测量厚度大于1 cm。
(5)病变特点:纯磨玻璃密度(GGO);GGO伴小叶间隔增厚,即铺路石征(paving pattern,PP);GGO伴实变;血管增粗征(vascular enlargement sign,VES)即GGO内见增粗血管;GGO内充气支气管征征;GGO内支气管壁增厚;GGO伴纤维索条;病灶内支气管变形;晕征(halo sign,HS),病灶多为圆形,病变中心为实变,周围环绕环形磨玻璃密度;反晕征(reversed halo sign,RHS),病变中心呈磨玻璃密度,周围环绕实变;纯实变;胸膜下透亮影,即病变与胸膜间2~3 mm条形低密度,以上共12个影像特征。
(6)肺外病变:胸腔积液,胸膜增厚,纵膈肺门淋巴结增大(短径大于1 cm)。
1.4 统计学处理
采用SPSS19.0进行统计学分析,定性资料采用[n(%)]表示,所有计量资料均符合正态分布,采用表示;将定性资料的4种临床分型比较采用Fisher's 确切概率法,两两比较采用Z-test,计数资料的4种临床分型比较采用方差分析,正态分布且方差齐则采用LDS法,方差不齐采用Tamhane' s法,非正态分布则采用Kruskal-Wallis秩和检验,两两比较采用Mann-Whitney检验。P<0.05为差异有统计学意义。
2 结果
2.1 云南省输入性COVID-19首诊病例不同临床分型临床特征及实验室检查的比较
2.1.1 云南省输入性COVID-19首诊病例不同临床分型临床特征比较116例输入型患者中,男女患病差异无统计学意义(χ2=1.288,P=0.808);不同年龄组间患病差异有统计学意义(χ2=19.589,P=0.006),其中21~55岁患病率较高,约占44.83%(55/116),其次为51~70岁,约占36.21%(42/116),50~70岁患重症肺炎(6/42,14.29%)较20~50岁3/52(5.77%)高(P<0.05);发热/畏寒(70.8%)及呼吸道症状(58.4%)是新冠肺炎最常见首诊症状。从症状出现至第一次CT扫描时间平均为(4.17±1.12)d,时间越长,临床分型越重(F=2.688,P=0.049),见表1。
表1 云南省输入性COVID-19首诊病例不同临床分型临床特征比较(n=116例)()Tab.1 Comparison of clinical characteristics of imported COVID-19 cases with different clinical types in Yunnan Province(n=116 cases)()

表1 云南省输入性COVID-19首诊病例不同临床分型临床特征比较(n=116例)()Tab.1 Comparison of clinical characteristics of imported COVID-19 cases with different clinical types in Yunnan Province(n=116 cases)()
*P<0.05。
2.1.2 云南省输入性COVID-19首诊病例不同临床分型实验室指标比较不同临床分型白细胞总数、淋巴细胞总数、淋巴细胞百分比、乳酸脱氢酶(LDH)、C反应蛋白差异有统计学意义F=3.486,3.640,5.154,15.361,8.195,P均<0.05);重型、危重型淋巴细胞总数及淋巴细胞百分比较轻型与普通型明显降低(P<0.05);LDH普通型较轻型及重型低(P<0.05);C反应蛋白普通型较重型、危重型低(P<0.05),见表2。
表2 云南省输入性COVID-19首诊病例不同临床分型实验室指标比较(n=116例)()Tab.2 Comparison of laboratory indicators for different clinical types of imported COVID-19 cases in Yunnan Province(n=116 cases)()
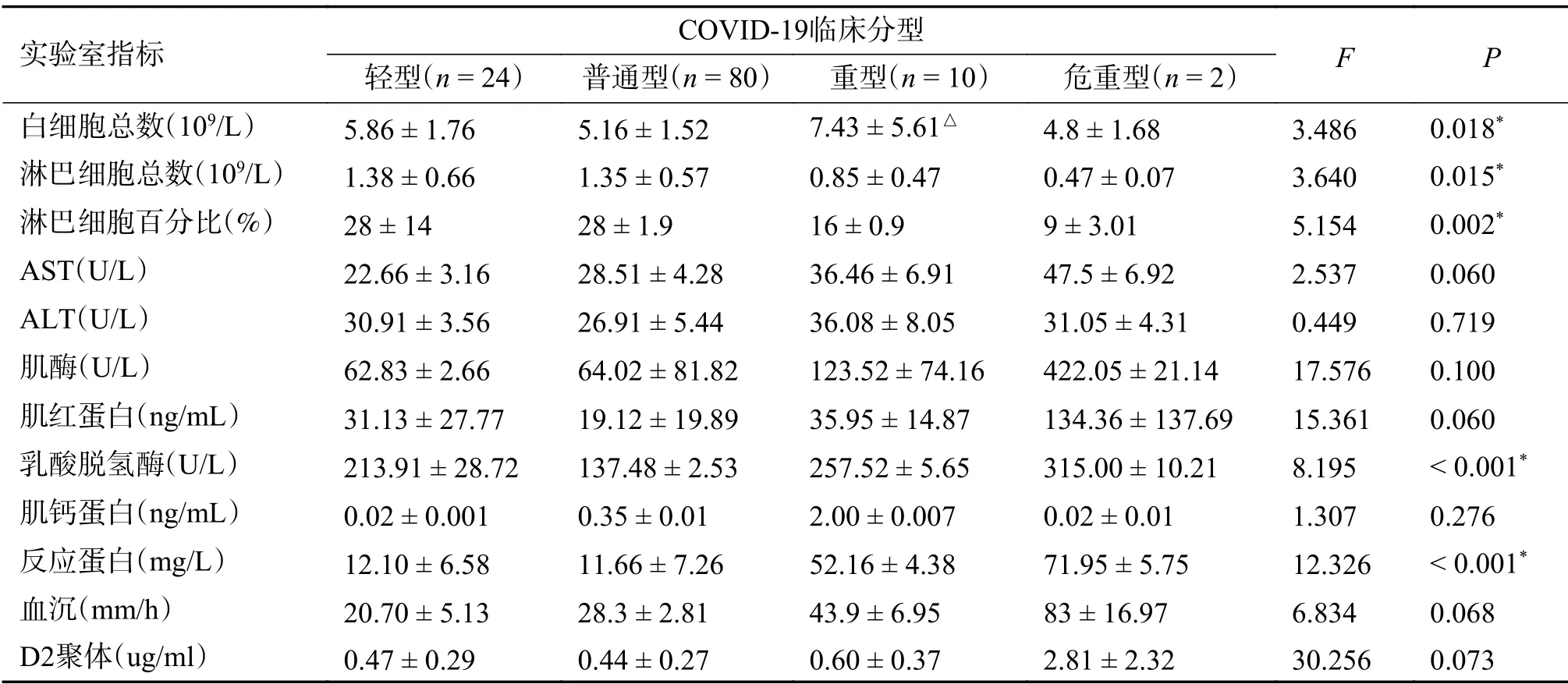
表2 云南省输入性COVID-19首诊病例不同临床分型实验室指标比较(n=116例)()Tab.2 Comparison of laboratory indicators for different clinical types of imported COVID-19 cases in Yunnan Province(n=116 cases)()
*P<0.05。
2.2 云南省输入性COVID-19首诊病例不同临床分型与影像学评估
116例患者共446个病灶,总累及范围平均评分为(4.74±2.12)分,普通型较危重型累及范围小(F=62.137,P=0.000),(P<0.05);病灶多累及双侧肺,约占70/116(78.26%),下叶85/116(37.12%)较中叶70/116(30.13%)、上叶75/116(32.75%)多见(χ2=10.190,P=0.021),胸膜下区87/229(57.24%)较肺门区29/229(19.08%)、肺中带36/229(23.68%)多见(χ2=5.187,P=0.018);圆形、椭圆形病灶多见(χ2=43.922,P=0.000),其中带状及盘状病变以重型、危重型患者多见(P<0.05);不同类型患者病变特点不同(χ2=50.974,P=0.000),其中GGO内血管增粗发生率最高,约占19.58%,其次为GGO伴索条影,约占13.71%及GGO伴小叶间隔增厚(铺路石征,PS)约占13.61%;GGO伴实变,即混合密度影,约占2.57%,少见反晕征(RHS)约占0.94%,及单纯实变影,约占1.61%。单纯GGO、PP、混合密度影、支气管充气征及晕征普通型(图1,2)较重型多见(P<0.05),GGO伴支气管壁增厚、纤维索条、支气管变形以重型(图3)、危重型(图4)多见(P<0.05);伴随病变中以胸膜增厚为最多见(χ2=42.119,P=0.000),约占73.12%,胸腔积液重型较普通型及危重型多见(P<0.05),见表3。

图1 普通型COVID-19Fig.1 Common COVID-19

图2 普通型COVID-19Fig.2 Common COVID-19

图3 重型COVID-19Fig.3 Severe COVID-19
表3 云南省输入性COVID-19首诊病例不同临床分型影像表现比较(n=116例)()Tab.3 Comparison of imaging manifestations of imported COVID-19 cases with different clinical types in Yunnan Province(n=116 cases)()
*P<0.05。
图1A-D男,46岁,武汉打工于1月18日从武汉回昆明,1月21日出现发热(37.9 ℃)干咳,1月23日就诊,24日核酸检测阳性,肺内病变累及范围评分为5分23日HRCT示:右肺中叶内侧段(图1A)、下叶外基地地段(图1B,1C)、左肺上叶下舌段(1C,1D)多发圆形磨玻璃密度影,右肺中叶内侧段呈晕征,病变中心/近中心处可见扩张肺血管,部分病变内可见扩张支气管,管壁未见明确增厚
图2A-D男,66岁,武汉来云南旅游,1月16日出现发热(38.7 ℃)胸痛,19日就诊,20日咽核酸阳性,肺内病变累及范围评分为7分19日HRCT示:双肺多发斑片状磨玻璃密度影(5,6横断面,7,8冠状面),可见铺路石征(PP)其内见血管扩张征(VES)及支气管,支气管管壁未见明确增厚
图3A-D为同一病例重型COVID-19女63岁,1月22日出现发热(38.3 ℃)、发力、气促、胸闷症状,30日就诊,31日核酸检测阳性,肺内病变累及范围评分为12分30日HRCT双肺胸膜下多发带状,盘状PP及实变,其内可见VES、支气管扩张及索条影,邻近胸膜增厚,胸膜下透亮影
图4A-E为同一病例危重型COVID-19男76岁,既往有糖尿病病史,腹泻6 d,发热(38.5 ℃)、咳嗽、咳痰、胸闷3 d,加重伴畏寒、呼吸困难半天,肺内病变累及范围评分为14分,HRCT示:双肺胸膜下多发楔形、盘状PS及实变,其内可见VES、支气管扩张及索条影,邻近胸膜增厚,胸膜下见透亮影(4A,B横断面,4C右肺矢状面,4D左肺矢状面,图E冠状面)。
3 讨论
COVID-19已经成为全球关注的公共卫生事件,为控制传染性疾病的爆发,在检测试剂盒数量不充足的情况下,放射学检查及诊断是新型冠状病毒感染诊疗的重要一环节[5],在疾病的筛查、诊断、分流、定量分级、疗效评估和随访中占有重要的地位[6],本文对116例输入性COVID-19患者回顾性分析,将不同临床类型的临床资料及影像学资料对比,为临床诊断及分型提供有力证据。
本研究显示,男(59/116,50.86%)女(57/116,49.14%)患病率差异无统计学意义,与文献报道一致[7]。但不同年龄组间患病率不同,其中21~50岁患病率较高为44.83%,而大于70岁者患病率最低为5.17%,分析其原因多与21~50岁年龄段输入型患者流动性较大,而大于70岁者流动性小有关;该病最常见的首诊临床症状是发热/畏寒及干咳等呼吸道症状,多与病毒并非直接进入下呼吸道破坏肺泡上皮,而是通过先累及鼻腔、气管粘膜上皮等上呼吸道粘膜,破坏机体免疫系统后引起相应临床症状有关;从出现症状至就诊的时间越长,则临床分型级别越高,轻型为(2.1±1.7)d、普通型为(3.05±1.2)d、重型为(5.1±3.5)d、危重型为(9±1.4)d;且年纪越大、患者基础疾病越多,则临床分型越重,因此早发现、早诊断、早隔离、重视年纪大、基础疾病多的患者感染,是控制COVID-19发展的重要手段。
本研究显示,轻型及普通型患者首诊时出现白细胞总数、淋巴细胞总数及淋巴细胞百分比减低,与文献报道[8]一致,重型、危重型患者白细胞总数、较轻型与普通型明显降低,同时伴LDH降低,C反应蛋白升高,与《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》[4]一致。
通过比较影像学表现,病变以双肺(70/116,78.26%)多发为多见,下叶(85/230,37.12%)多于中叶(70/20,30.13%)及上叶(75/230,32.75%)、胸膜下病变多于肺门区病变,尤其是右肺下叶、肺叶背侧分布多,多由于右肺下叶支气管陡、且直病毒直径小(60~120 μm),易进入且停留在下呼吸道,破坏呼吸性细支气管以远的肺泡管、肺泡囊、肺泡等结构有关[9]。本研究显示轻型及普通型患者早期病变多为圆形、椭圆形的单纯GGO(101/139,72.66%),边界清楚,后为可逐渐扩展为楔形,多由于病变以呼吸细支气管为中心,以肺小叶为单位通过肺泡孔呈“烟花样”蔓延,因此早期呈圆形或椭圆形,而随病变扩展蔓延,被胸膜阻挡,形成沿胸膜面呈宽基底的楔形。早期GGO并非肺泡内渗出形成,而是由于Ⅱ型肺泡上皮(AT2)破坏后,肺泡表面活性物质分泌减少,肺泡塌陷,同时部分凋亡、坏死的上皮细胞脱落填充肺泡腔,至其含气量减少所致;病变往往伴有血管增粗征(vascular enlargement sign,VES)及铺路石征(paving pattern sign,PPS),是由于病毒攻击不断繁殖,机体同时迅速启动细胞免疫及体液免疫系统,大量炎症因子通过血流进入肺组织,引起小叶内间隔及小叶间隔的血管充血、水肿,病变内血管扩张(VES)并引起小叶内间隔及小叶间隔增厚(PPS)[10-11],此时可称为新病灶;随病变进展,间质内血管内皮细胞通透性增加,血管内液体及细胞漏出至肺泡腔,此时出现延支气管血管束分布的GGO内实变影,且往往以小血管为中心,位于病变中央,此时称晕征(HS),若病变支气管内无渗出,则出现支气管充气征[12]。本研究显示病变内GGO伴支气管壁增厚、纤维索条以重型、危重型患者发生率高,且下肺多见,多与此类患者病变严重时支气管周围间质水肿及机体代偿性纤维组织增生有关,若纤维化严重,甚至可牵拉邻近支气管引起支气管变形及局部轻度扩张,此时可称老病灶。因此同一重、危重患者肺内可出现多种类型病灶同时存在,即新老病灶同时存在,且有上肺新、下肺旧为特点,多为病毒先累及下呼吸道,进而累及上呼吸道与下呼吸道病变共同进展有关。反晕征(RHS)本组病例少见,以往的研究显示反晕征(RHS)常见于真菌性肺炎,代表病变周围的肺内出血较病变中心多[13],本组病例发生率较低,为18/1886(0.95%),通过学习COVID-19病理,笔者考虑可能的原因为在疾病后期,病变区小肺血管内透明血栓形成,局部肺组织缺血坏死周围较中心多所致;也有可能晚期病变在吸收好转时,是以病变内以血管为中心病变早期吸收,而周边病灶吸收慢所致,因此反晕征中心往往有血管存在,亦可称为“靶征”,该征象在COVID-19中的原因有待于后期病理的进一步证实。
本研究中由于重型及危重型病例较少,有待于进一步收集病例完善;另外由于目前对COVID-19的病理学研究有限,因此影像表现笔者参考既往病毒性肺炎文献及COVID-19现有尸检及穿刺结果分析,可能存在一定偏差,期待有更多的病理学研究进一步证实。
综上所述,输入性肺炎患者,发病年龄高峰为20~50岁,初诊为重症及危重症患者多为老年且有基础疾病,病变常双肺多发,以下肺、胸膜下、背侧多见,重症、危重症患者多为新老病灶共存,上新下旧,实验室检查对临床分型有一定提示,普通型患者多以单纯GGO、晕征、铺路石伴VES、PPS及充气支气管征多见,重症危重症患者病变内出现支气管壁增厚、纤维化、支气扩张扭曲为多见,反晕征为病变以增粗血管为中心吸收的改变,多为病变吸收好转的征象。

