PD0721 单链抗体的体外原核表达条件优化及蛋白质鉴定
张煜彬 , 叶路芬 , 吴忠秀 , 薛维娜 , 何 彬 ,杨 畅 , 李勇军 , 王永林 , 刘 亭 *
(1. 贵州医科大学 贵州省药物制剂重点实验室/省部共建药用植物功效与利用国家重点实验室, 贵州 贵阳550004;2. 贵州医科大学 民族药与中药开发应用教育部工程研究中心, 贵州 贵阳 550004;3. 贵州医科大学 医药卫生管理学院,贵州 贵阳 550025;4. 贵州医科大学 药学院,贵州 贵阳 550025)
恶性肿瘤已经成为严重危害人类健康的疾病之一。 根据国家癌症中心的相关数据显示,2015 年全国新发恶性肿瘤约为392.9 万例, 男性最常见的恶性肿瘤为肺癌,女性最常见的恶性肿瘤为乳腺癌[1]。 传统恶性肿瘤的治疗手段主要为手术、化疗与放疗等多模式疗法,尽管治疗取得了进展,但由于副作用大,患者的预后不理想,长期生存也不容乐观,因此,肿瘤靶向治疗逐渐进入人们的视野[2]。
表皮生长因子(epidermal growth factor,EGF)家族是受体酪氨酸激酶(RTK)的主要类型,是参与许多癌症进程中的血管生成、细胞分化、增殖、存活的重要信号通路[3]。EGFR 家族成员可以诱导多种信号传导途径,包括PI3K / PTEN / Akt / mTORC1,Ras /Raf / MEK / ERK 和 Jak / STAT 信号通路[4-5]。 EGFR家族成员在正常细胞生长以及恶性转化、预防细胞凋亡、抗药性、肿瘤干细胞和多种癌症的转移中发挥重要作用[6]。表皮生长因子(EGF)家族受体即表皮生长因子受体 (epidermal growth factor receptor,EGFR), 是一种相对分子质量约为170 000 的跨膜糖蛋白[7],也称为 ErbB 或 HER 受体。 EGFR 拥有很多的突变体,其中最普通的就是EGFRvⅢ。 这种突变起源于其胞外区的外显子2-7 框内缺失, 导致841 个编码碱基对的丢失, 变为相对分子质量只有145 000 的糖蛋白,由于缺乏胞外的L1 和CR1(富含半胱氨酸)的亚结构域,因此没有被任何配体激活的能力[8]。 EGFRvⅢ作为组成型激活突变体,能够促进细胞内有丝分裂和生长支持信号传导,还能促进恶性肿瘤的发展,是肿瘤靶向治疗的理想靶点[9]。目前已经在许多人类恶性肿瘤中检测到EGFRvⅢ的存在,包括肺癌、结肠直肠癌、多形性胶质母细胞瘤、胸腺癌和头颈癌[10]。 然而,在包括正常乳腺组织在内的成人组织中, 并没有发现可检测水平EGFRvIII 的存在[11]。 目前针对 EGFR 的抗体药物有:针对非小细胞肺癌的吉非替尼,针对转移性结直肠癌和头颈癌的西妥昔单抗,针对胰腺癌的厄洛替尼以及针对乳腺癌的拉帕替尼等[12]。
单链抗体(single chain antibody fragment,scFv)是具有亲代抗体全部抗原结合活性的最小免疫球蛋白之一[13],其相对分子质量约为30 000,由重链可变区(VH)和轻链可变区(VL)组成,并通过柔性多肽接头连接在一起[14]。单链抗体相对分子质量小,穿透能力强,易于在原核细胞系统内表达,是抗体偶联药物中抗体部分的优选。 本课题组前期通过单克隆技术和易错PCR 技术,得到了一株亲和力较好的抗EGFRvIII 单链抗体PD0721, 通过优化该抗体在原核中的表达条件,为制备抗体偶联药物提供了科学依据。
1 材料与方法
1.1 质粒与菌株
大肠杆菌 BL21 菌株、pET-22b(+)质粒、Top10大肠杆菌:均购自TaKaRa 生物技术有限公司。
1.2 实验试剂
LB 肉汤培养基、氨苄西林、异丙基硫代半乳糖、苯甲基磺酰氟、 考马斯亮蓝R-250、BCA 蛋白质质量浓度测定试剂盒、ECL Plus 超敏发光液、 兔抗His-tag 多抗、羊抗兔 IgG(H+L) HRP、牛血清白抗体:均购于北京索莱宝科技有限公司;XhoI 和NcoI酶切试剂盒:购于TaKaRa 生物技术有限公司;SDSPAGE 凝胶制备试剂盒、PCR 反应试剂盒: 均购于BBI 生命科学有限公司; 质粒DNA 抽提试剂盒:购于上海百赛生物技术股份有限公司;PCR 引物:委托TaKaRa 生物技术有限公司合成;HisTrapTMHP 亲和层析柱:购于GE 公司。
1.3 PD0721 序列的合成以及阳性克隆的筛选和鉴定
根据大肠杆菌对密码子的偏好性进行优化,选择优化后的PD0721 序列,使用XhoI 和NcoI 双酶切质粒 pET-22b (+), 使用 T4 DNA 连接酶将重组PD0721 序列与 pET-22b(+)质粒片段进行连接,构建成重组质粒DNA,转化到Top10 大肠杆菌菌株中扩大培养。 按照质粒DNA 提取试剂盒抽提质粒DNA, 并转化到大肠杆菌BL21 中, 接种于含100 μg/mL 氨苄西林的LB 固体培养基上,37 ℃恒温培养12 h, 挑取阳性克隆, 设计PCR 引物进行菌落PCR 进行鉴定,引物设计见表1。

表1 引物Table 1 Primer
1.4 重组PD0721 蛋白的表达
挑取阳性克隆,接种至含100 μg/mL 氨苄西林的 LB 液体培养基中,37 ℃、180 r/min 培养过夜。 以1∶100 接种到含 100 μg/mL 氨苄霉素的 LB 液体培养基中扩大培养,保持 37 ℃、180 r/min,待 OD600为0.6 左右时,加入 0.6 μmol/L 的诱导剂 IPTG,低温诱导培养12 h 表达蛋白质(15 ℃),低温离心收集菌体并破碎,取上清液,使用SDS-PAGE 电泳检测表达情况。
1.5 优化大肠杆菌BL21 表达重组PD0721 蛋白的条件
1.5.1 诱导剂IPTG 浓度对重组PD0721 蛋白在大肠杆菌BL21 中表达的影响 以1∶100 比例将已经活化的重组菌接种至含100 μg/mL 氨苄西林的LB培养基中,保持 37 ℃、180 r/min,待至 OD600为 0.6左右时,在摇菌管加入诱导剂IPTG,使其终浓度分别为 0.1、0.2、0.4、0.6、0.8、1.0 μmol/L,低温(15 ℃)诱导培养12 h。 低温高速离心收集菌体,PBS 清洗两次。 超声破碎菌体并收集上清液。 使用BCA 蛋白质质量浓度试剂盒测定蛋白质质量浓度,保持蛋白质质量浓度一致的情况下,使用10 g/dL SDS-PAGE电泳进行检测。
1.5.2 温度对重组PD0721 蛋白在大肠杆菌BL21中表达的影响 以1∶100 比例将已经活化的重组菌接种至 50 mL 含 100 μg/mL 氨苄西林的 LB 培养基中,保持 37 ℃、180 r/min,待至 OD600为 0.6 左右时,在摇菌管中加入0.6 μmol/L 的IPTG, 分别置于5、8、10、15、22、33 ℃环境中,180 r/min 诱导培养。低温高速离心收集菌体,PBS 清洗两次,超声破碎菌体并收集上清液。使用BCA 蛋白质质量浓度试剂盒测定蛋白质质量浓度,保持蛋白质质量浓度一致的情况下,使用10 g/dL SDS-PAGE 电泳进行检测。
1.5.3 诱导时间对重组PD0721 蛋白在大肠杆菌BL21 中表达的影响 以1∶100 比例将已经活化的重组菌接种至含100 μg/mL 氨苄西林的LB 培养基中,保持 37 ℃、180 r/min,待 OD600为 0.6 左右时,在摇菌管中加入0.6 μmol/L 的IPTG,分别低温诱导培养 30、24、18、12、6 h(15 ℃)。 低温高速离心收集菌体,PBS 清洗两次,超声破碎菌体并收集上清液。 使用BCA 蛋白质质量浓度试剂盒测定蛋白质质量浓度,保持蛋白质质量浓度一致的情况下,使用10 g/dL SDS-PAGE 电泳进行检测。
1.5.4 菌体浓度对重组PD0721 蛋白在大肠杆菌BL21 中表达的影响 以1∶100 比例将已经活化的重组菌接种至50 mL 含100 μg/mL 氨苄西林的LB培养基中,保持 37 ℃、180 r/min,待至 OD600分别为0.2、0.4、0.6、0.8、1.0 左右时, 在摇菌管中加入 0.6 μmol/L 的 IPTG,低温诱导培养 12 h(15 ℃)。低温高速离心收集菌体,PBS 清洗两次,超声破碎菌体并收集上清液。使用BCA 蛋白质质量浓度试剂盒测定蛋白质质量浓度, 保持蛋白质质量浓度一致的情况下,使用10 g/dL SDS-PAGE 电泳进行检测。
1.6 重组PD0721 蛋白的纯化
根据1.5 中重组蛋白的优化条件, 进行重组PD0721 蛋白的诱导表达。 低温高速离心收集菌体,PBS 清洗两次,加入 100 mmol/L PMSF 和 Buffer A,用高压均质机对细菌进行破碎,低温高速离心收集上清液,过0.45 μm 滤膜。 使用镍亲和柱对目的蛋白质进行亲和层析, 使用咪唑(5、10、20、50、100、150、200、500 mmol/L)进行洗脱,收集洗脱峰。 使用10 g/dL SDS-PAGE 电泳进行检测。
1.7 重组PD0721 蛋白的Western Blotting 鉴定
纯化后的重组PD0721 蛋白经SDS-PAGE 凝胶电泳后,电转移至PVDF 膜上,经过50 mg/mL BSA封闭液封闭过夜, 一抗为按1∶1 000 比例使用50 mg/mL BSA 封闭液稀释的兔抗His 标签单抗,4 ℃孵育 2 h,TBST 洗膜 5 次;二抗为按 1∶5 000 比例使用 TBST 稀释的羊抗兔 IgG (H+L) HRP,4 ℃孵育 2 h,TBST 洗膜 5 次,ECL 显色分析结果。
1.8 重组PD0721 蛋白的N 端测序
纯化后的重组PD0721 蛋白经SDS-PAGE 凝胶电泳后,电转移至PVDF 膜上,立春红染色15 min,脱色后剪下目的条带,送至上海生工测序。
2 结果与讨论
2.1 PD0721 序列的合成以及阳性克隆的筛选和鉴定
PD0721 的核酸序列如下:
CAGGTGCAGCTGCAGGAAAGCGGCGGCGGCC TGGTGAAACCGGGCGGCAGCCTGAAACTGAGCTG CGCGGCGAGCGGCTTTACCTTTAGCAAATTTGGCA TGAGCTGGGTGCGTCAGACCCCGGATAAACGTCT GGAATGGGTGGCGACCATTAGCACCGGCGGCTAT TATACCTATTATCCGGATAGCGTGAAAGGCCGTTT TACCATTAGCCGTGATAACGCGAAAAACACCCTG TATCTGCAGATGAGCAGCCTGAAAAGCGAAGATA CCGCGATGTATTATTGCGCGCGTGGCTATAGCAGC ACCAAAGAATGGATGGATTATTGGGGCCAGGGCA CCATGGTGACCGTGAGCAGCAGCGGCGGCGGCAG CGGCGGCGGCGGCAGCGGCGGCGGCGGCAGCGA TATTCAGATGACCCAGAGCCCGAGCAGCCTGAGC GCGAGCGTGGGCGATCGTGTGACCATTACCTGCC AGGCGAGCACCGATATTGATGATGATATGAACTG GTATCAGCAGAAACCGGGCAAAACCCCGAAACTG CTGATTTATGAAGGCAACAGCTTTATTCCGGGCGT GCCGAGCCGTTTTAGCGGCAGCGGCAGCGGCACC GATTTTATTTTTACCATTAGCAGCCTGCAGCCGGA AGATATTGCGACCTATTATTGCCAGCAGCTGCAGA GCTTTAACGTGCCGCTGACCTTTGGCGGCGGCACC AAAGTGGAAATTAAA
该核酸序列根据大肠杆菌密码子的偏好性进行了优化。
随机挑取9 个菌落,菌落PCR 进行琼脂糖电泳,挑取的9 个菌落都为阳性克隆菌落,结果见图1。

图1 菌落PCRFig. 1 Colony PCR
2.2 重组PD0721 蛋白的表达
阳性克隆菌株在0.6 μmol/L 的诱导剂IPTG 条件下,低温诱导培养12 h 表达蛋白质(15 ℃),低温离心收集菌体并破碎,取上清液进行SDS-PAGE 电泳检测,结果见图2。 加入诱导剂IPTG 的菌体会表达相对分子质量为31 000 左右的重组目的蛋白质,而没有加入诱导剂的情况下菌体并不会表达目的蛋白质。
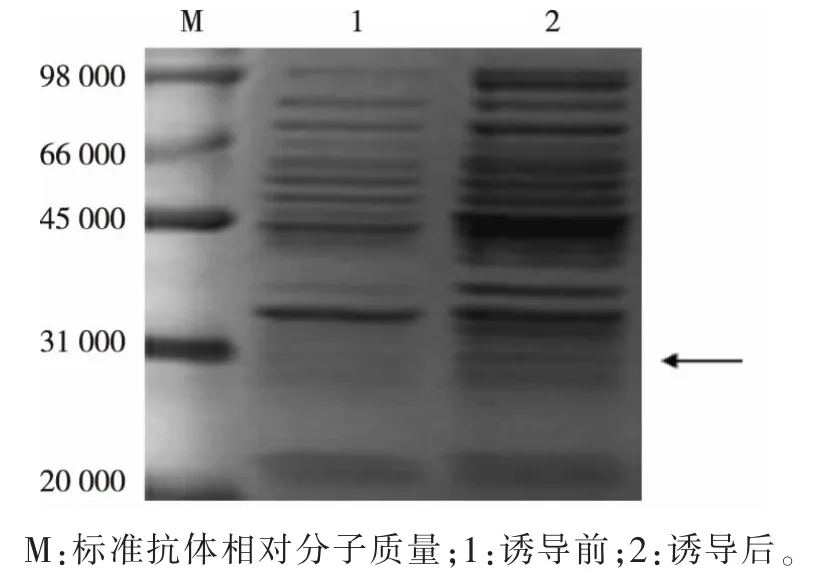
图2 IPTG 诱导大肠杆菌BL21 表达重组PD0721 蛋白Fig. 2 IPTG induced E. coli BL21 express recombinant PD0721 protein
2.3 优化重组PD0721 蛋白的表达条件
2.3.1 IPTG 浓度对重组PD0721 蛋白在大肠杆菌BL21 中表达的影响 待菌液OD600达到0.6 左右,分别加入不同浓度的诱导剂 IPTG(0.1、0.2、0.4、0.6、0.8、1.0 μmol/L),低温 15 ℃诱导培养 12 h。 超声破碎菌体并收集上清液,使用BCA 蛋白质质量浓度试剂盒测定蛋白质质量浓度后,进行SDS-PAGE 电泳检测,结果见图3。在OD600为0.6、诱导时间为12 h、诱导温度为15 ℃的情况下, 当诱导剂浓度在0.1~0.6 μmol/L 范围内时,PD0721 蛋白的表达量随着诱导剂浓度的增加而增加; 当诱导剂浓度在0.6~1.0 μmol/L 范围内时,PD0721 蛋白的表达量随着诱导剂浓度的增加而降低; 当诱导剂浓度为0.6 μmol/L时,PD0721 蛋白的表达量最大。

图 3 不同浓度 IPTG 对重组 PD0721 蛋白表达影响的SDS-PAGEFig. 3 SDS-PAGE analysis of the expression of recombinant PD0721 in different inducer IPTG concentration
2.3.2 温度对重组PD0721 蛋白表达的影响 待菌液 OD600达到 0.6 左右,加入浓度为 0.6 μmol/L 的诱导剂IPTG 后, 分别将菌液放置于不同温度(5、8、10、15、22、33 ℃)中培养 12 h。超声破碎菌体并收集上清液,使用BCA 蛋白质质量浓度试剂盒测定蛋白质质量浓度后,进行SDS-PAGE 电泳检测,结果见图4。在OD600为 0.6、诱导时间为12 h、诱导剂IPTG浓度为0.6 μmol/L 的情况下, 当诱导温度在15 ℃以内时,PD0721 蛋白的表达量随着诱导温度的增加而增加;当诱导温度超过15 ℃时,PD0721 蛋白的表达量随着诱导温度的增加而降低;当诱导温度为15 ℃时,PD0721 蛋白的表达量最大。

图4 不同诱导温度对重组PD0721 蛋白表达影响的SDSPAGEFig. 4 SDS-PAGE analysis of the expression of recombinant PD0721 at different induced temperature
2.3.3 诱导时间对重组PD0721 蛋白在大肠杆菌BL21 中表达的影响 待菌液OD600达到0.6 左右,加入浓度为 0.6 μmol/L 的诱导剂 IPTG 后, 分别低温(15 ℃)诱导培养 30、24、18、12、6 h。 超声破碎菌体并收集上清液,使用BCA 蛋白质质量浓度试剂盒测定蛋白质质量浓度后, 进行SDS-PAGE 电泳检测,结果见图 5。 在 OD600为 0.6、诱导温度为 15 ℃、诱导剂浓度为0.6 μmol/L 的情况下,当诱导时间大于12 h 时,PD0721 蛋白的表达量随着诱导时间的减少而增加;当诱导时间小于12 h 时,PD0721 蛋白的表达量有所降低;当诱导时间为12 h 时,PD0721蛋白的表达量最大。

图5 不同诱导时间对重组PD0721 蛋白表达影响的SDSPAGEFig. 5 SDS-PAGE analysis of the expression of recombinant PD0721 under different induction times
2.3.4 菌体浓度对重组PD0721 蛋白在大肠杆菌BL21 中表达的影响 待菌液OD600分别达到0.2、0.4、0.6、0.8、1.0 左右, 加入浓度为 0.6 μmol/L 的诱导剂 IPTG 后,低温(15 ℃)诱导培养 12 h,超声破碎菌体并收集上清液。使用BCA 蛋白质质量浓度试剂盒测定蛋白质质量浓度后,进行SDS-PAGE 电泳检测,结果见图6。 在诱导时间为12 h、诱导温度为15 ℃、诱导剂浓度为 0.6 μmol/L 的情况下,当 OD600小于0.6 时,PD0721 蛋白的表达量随着菌体浓度的增加而增加;当OD600大于0.6 时,PD0721 蛋白的表达量有所降低;当菌液OD600约为0.6 时,PD0721 蛋白的表达量最大。

图6 不同菌体浓度对重组PD0721 蛋白表达影响的SDSPAGEFig. 6 SDS-PAGE analysis of the expression of recombinant PD0721 with different bacterium densities
2.4 重组PD0721 蛋白的纯化
目的蛋白质末端携带了6 个组氨酸标签,可以使用Ni2+柱进行纯化。在15 ℃和0.6 μmol/L 诱导剂IPTG 的条件下进行蛋白质表达。 收集并裂解菌体,裂解液离心过滤后,进行Ni2+柱亲和层析。考察不同浓度的咪唑(5、10、20、50、100、150、200、500 mmol/L)的洗脱效果,获得最佳的纯化方案,结果见图7。 经过Ni2+柱亲和层析后, 当咪唑的浓度为150 mmol/L时,能够得到纯度较高的PD0721 蛋白。
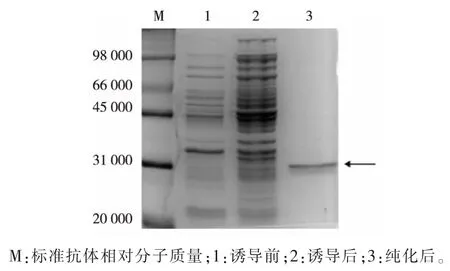
图7 纯化后重组PD0721 蛋白的SDS-PAGE 分析Fig. 7 SDS -PAGE analysis of recombinant PD0721 protein after purification
2.5 重组PD0721 蛋白的Western Blotting 鉴定
纯化后的样品经过Western Blotting 电泳后,结果见图8。 在31 000 附近观察到可见特异条带,相对分子质量与重组PD0721 蛋白基本相同, 表明重组PD0721 蛋白在大肠杆菌BL21 中成功表达。

图8 纯化后重组PD0721 蛋白的Western Blotting 鉴定Fig. 8 Western Blotting analysis of purified recombinant PD0721 protein
2.6 重组PD0721 蛋白的N 端测序
利用 Edman 降解法将重组 PD0721 蛋白 N 端的氨基酸依次水解, 借助高效液相色谱分析其序列, 结果见图9-10。 样品的N 端序列为Met-Gln-Val-Gln-Leu(简写 MQVQL)与重组 PD0721 蛋白的序列一致,结合Western Blotting 的实验结果,表明纯化的蛋白质为重组PD0721 蛋白。

图9 重组PD0721 蛋白的N 端氨基酸序列分析图Fig. 9 N-terminatio amino acid sequencing map of recombinant PD0721 protein
3 结 语
原核表达中的目的蛋白质经常发生错误的折叠,且原核本身就没有翻译后修饰的环节,比较容易形成包涵体,可以采用降低诱导温度或降低IPTG浓度并延长诱导时间来改善; 该质粒为分泌型表达,将蛋白质输出到细胞周质中。

图10 N 端测序序列与重组PD0721 蛋白序列比对Fig. 10 Sequence alignment of N end sequencing and recombinant PD0721 protein sequencing
通过将转化重组质粒的大肠杆菌在不同诱导剂浓度下培养, 发现诱导剂浓度为0.6 μmol/L 时,PD0721 蛋白的表达量最大;诱导剂IPTG 的作用是激活乳糖操纵子, 使细菌开始合成外源蛋白质,但当诱导剂浓度过高时,细菌合成的外源蛋白质更容易形成包涵体,导致可溶性降低,含量减少[15]。 诱导温度为l5 ℃时,目的蛋白质的表达量最多;诱导温度低时,热休克蛋白未被激活,其对蛋白质的降解作用就比较弱, 有助于形成蛋白质的活性空间结构;但如果温度过低,促进蛋白质折叠的伴侣蛋白质活性被抑制,反而降低了可溶性蛋白质的表达量[16];温度过高时,大肠杆菌则开始增殖,不利于表达蛋白质。 当诱导时间为12 h 时,重组目的蛋白质表达量最大;可溶性蛋白质的表达量随着时间的增加先增加后减少,表明诱导时间过长可能导致可溶性蛋白质变性为包涵体蛋白质,过长的诱导时间反而不利于可溶性蛋白质的获得[17]。 菌液OD600约为0.6 时,PD0721 蛋白的表达量最大;菌液浓度过低,菌体尚处于迟缓期, 加入IPTG 诱导剂将会对还未适应新环境的菌体产生一定的影响;若菌液浓度过高,菌体开始进入稳定期,菌体繁殖速度开始下降,培养基内毒性产物开始增多,不利于重组蛋白质的积累。 作者优化了诱导重组PD0721 蛋白表达的诱导剂浓度、诱导温度、诱导时间以及菌体浓度等几个重要条件,为后续获得更多的重组目的蛋白质打下了坚实的基础。
在后续的蛋白质纯化实验中,选择裂解菌体之后的上清液用于纯化, 是由于重组PD0721 蛋白属于可溶性蛋白质,而沉淀中的蛋白质大多数是以包涵体的形式存在的,没有生物活性与功能。 上清液中的目的蛋白质经过镍柱亲和层析纯化之后使用SDS-PAGE 分析、Western Blotting 鉴定以及蛋白质的N 端测序鉴定,可确认为目的蛋白质,为后续研究重组PD0721 蛋白与细胞毒性药物偶联提供了一定的基础。

