宫颈高级别病变LEEP手术后2年内复发的相关因素研究
梁利梅
宫颈癌前病变需要经过较长的病程才可能发展为宫颈癌,因此只要给予病人及时有效的治疗,即可阻断病情进展,有效预防宫颈癌的发生[1]。但临床中近66%的CIN Ⅱ级和CIN Ⅲ级病人因未得到及时治疗而发展为原位癌,对此类病人的治疗十分重要[2]。子宫颈环形电极切除(LEEP)手术是临床常用的治疗宫颈癌前病变的方式,尤其是对于因存在生育需求而不愿意切除子宫的妇女来说,该术式操作简便、出血量少、术后恢复快,因此而广泛使用[3]。但随着LEEP手术在临床中的推广和使用,已发现5%~30%的病人术后存在残留病灶,甚至复发,且多数复发病例在术后2年内,若病人术后残留病灶或者复发而无法被及时发现,其进展为宫颈癌的概率将大大增加[4]。因此本研究分析宫颈癌前病变妇女LEEP手术后2年内复发的危险因素,对于改善病人LEEP术后的预后,提高生存率具有重要意义。现作报道。
1 资料与方法
1.1 一般资料 回顾性分析2014年1月至2017年1月我院收治的458例宫颈癌前病变病人的临床资料,所有病人均于我院顺利完成LEEP手术治疗。年龄21~58岁,平均(33.85±6.22)岁;平均孕次(3.18±1.55)次;平均产次(1.19±0.87)次。
复发:宫颈细胞学检查为阴性(3个月内),组织学证实宫颈病变(3个月后)。
纳入标准:(1)经临床诊断为宫颈癌前病变;(2)年龄≥18周岁;(3)顺利完成LEEP手术治疗;(4)无内外科合并症;(5)临床资料和随访资料完整者。排除标准:(1)合并其他肿瘤;(2)病理诊断为宫颈癌;(3)因残留病灶或复发而再次行LEPP手术治疗;(4)临床资料不完整或中途失访。
1.2 方法 所有病人术后均通过电话、微信、短信、门诊等方式随访2年,收集并回顾性分析病人的临床资料,包括LEEP术后31例复发病人的CIN分级情况。并单因素和logistic多因素分析宫颈癌前病变妇女LEEP术后2年内复发的危险因素,包括年龄、孕次、产次、是否绝经、是否吸烟、病变程度、是否腺体累及、是否累及颈管、象限累及、病变最深处距离切缘距离、术前HR-HPV RLU/CO、术前液基薄层细胞检测(TCT)、切缘情况、术后同一型别人类乳头瘤病毒(HPV)持续感染、术后细胞学检查。
1.3 统计学方法 采用t检验、χ2检验和logistic回归分析。
2 结果
2.1 LEEP术后复发的CIN分级情况 458例病人中随访2年内31例复发,治愈率为93.23%,复发率为6.77%。术后半年内6例复发,术后半年至1年内8例复发,术后1年至2年内17例复发。平均复发时间为(15.53±4.23)个月(见表1)。

表1 LEEP术后复发的CIN分级情况[ n;百分率(%)]
2.2 宫颈癌前病变妇女LEEP手术后2年内复发因素的单因素分析 2组的年龄、绝经、吸烟、颈管累及、象限累及、术前HR-HPV RLU/CO、术前TCT、切缘情况、术后同一型别HPV持续感染间差异均有统计学意义(P<0.05~P<0.01)(见表2)。

表2 宫颈癌前病变妇女LEEP手术后2年内复发因素的单因素分析[ n;百分率(%)]
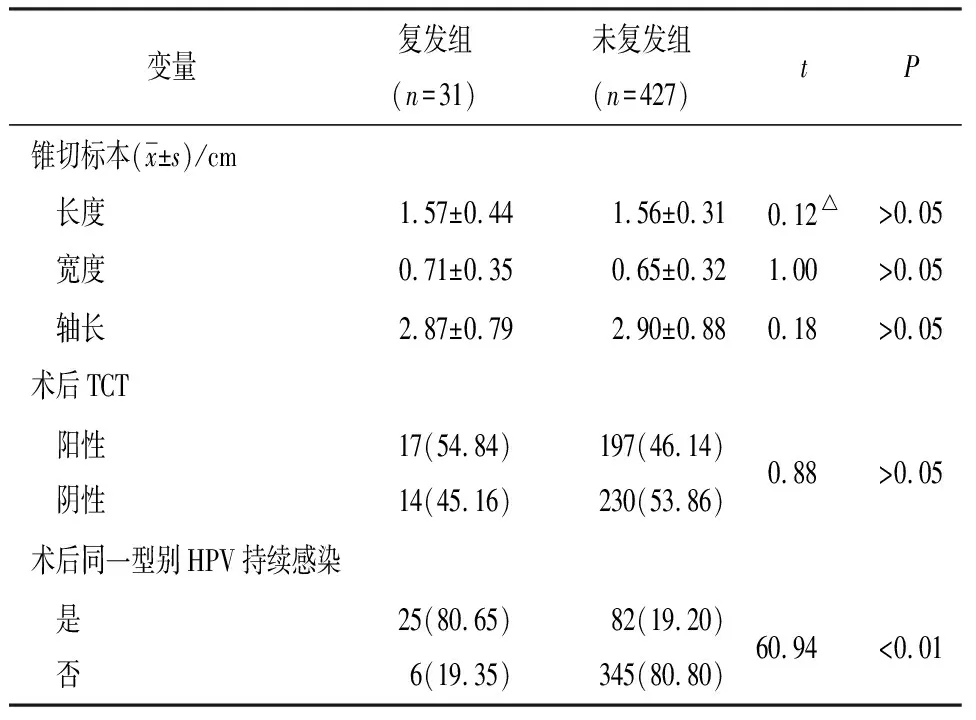
续表2
2.3 宫颈癌前病变妇女LEEP手术后2年内复发因素的logistic回归分析 以宫颈癌前病变妇女LEEP手术后2年内是否复发为因变量,以单因素分析有意义者为自变量进入回归方程,各自变量赋值如下:高龄>40岁=1,<40岁=0;绝经=1,未绝经=0;颈管累及=1,颈管未累及=0;术前HR-HPV RLU/CO≥1 000=1,术前HR-HPV RLU/CO<1 000=0;切缘阳性=1,切缘阴性=0;术后同一型别HPV持续感染=1,术后其他类型HPV感染=0。结果显示高龄、绝经、颈管累及、术前HR-HPV RLU/CO≥1 000、切缘阳性、术后同一型别HPV持续感染为宫颈癌前病变妇女LEEP手术后2年内复发的危险因素(P<0.05~P<0.01)(见表3)。
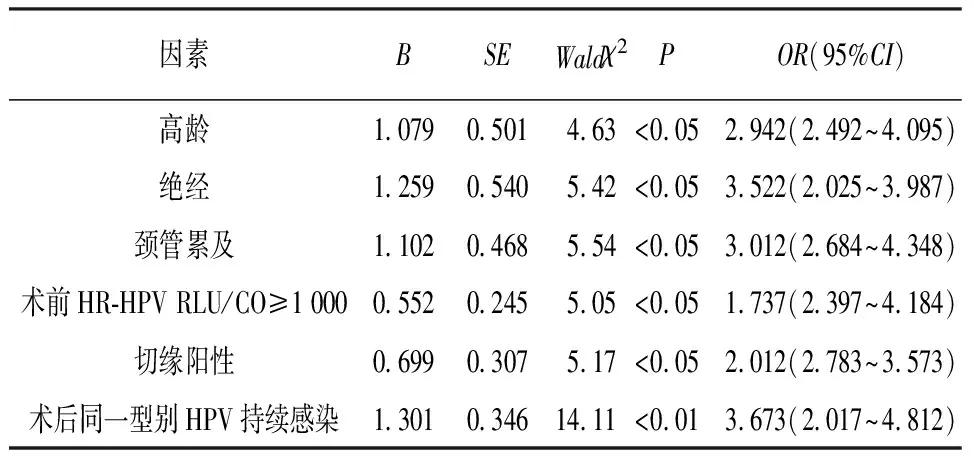
表3 宫颈癌前病变妇女LEEP手术后2年内复发因素的logistic回归分析
3 讨论
宫颈癌为全球女性癌症死亡的主要原因之一,对女性健康产生严重威胁。近年来随着宫颈癌筛查技术的不断提高和普及,宫颈癌的发病率和死亡率均显著降低[5]。但是宫颈癌前病变的发生率并未降低,依旧是年轻妇女群体常见的妇科疾病,并且发病呈年轻化趋势[6]。临床中通过将HPV检测与细胞学检查联合使用,不仅降低了宫颈癌的发生率和死亡率,也提高了宫颈癌前病变的检出率[7]。近年来随着人们生活方式的变化,女性初次性生活的年龄降低,流产次数增加,结合宫颈癌筛查技术的推广和使用,无论是宫颈癌前病变还是宫颈癌的发生,均存在年轻化的趋势[8]。且年轻人群对生活质量和生育能力的要求也较高,因此抓住宫颈癌前病变进展缓慢且可逆的特点,给予病人积极有效的治疗措施,是控制其进展为宫颈癌的重要方法[9]。临床中常给予宫颈癌前病变病人宫颈锥形切除术治疗,LEEP刀因操作快捷、出血量少且恢复快而成为宫颈锥切的首选手术方式,在各级医疗机构中得到广泛使用[10]。但由于各级医生对LEEP手术操作技术的掌握程度不同,部分医生经验不足,无法彻底清除病灶,术后常残留病灶,宫颈癌前病变在LEEP术后的复发率较高[11]。但考虑宫颈癌前病变的发生率不仅与残留病灶相关,还会受到其他因素的影响,因此本研究对宫颈癌前病变妇女LEEP手术后2年内复发的相关因素进行了探究。
本研究中458例病人中随访2年内31例复发,治愈率为93.23%,复发率为6.77%。术后半年内6例复发,术后半年至1年内8例复发,术后1年至2年内17例复发。平均复发时间为(15.53±4.23)个月。这提示我们LEEP术后2年内宫颈癌前病变病人的复发率较高,复发多集中在术后1年至2年内,临床中应对此阶段的病人加强监控,以及时给予有效的预防措施。进一步探究发现,高龄、绝经、累及颈管、术前HR-HPV RLU/CO≥1 000、切缘阳性、术后同一型别HPV持续感染为宫颈癌前病变妇女LEEP手术后2年内复发的危险因素(P<0.05~P<0.01)。宫颈癌前病变具有多灶性、多点分布的特点,宫颈萎缩会造成移行带内移,进而造成高龄人群的宫颈移行带移入宫颈管内,并隐匿其中。其次高龄人群的免疫能力降低,术后HPV持续感染或再次感染的发生率较高[12]。且高龄人群接受宫颈癌筛查的机会较少,多数病人初次就诊时病程时间已经较长,甚至部分病人因雌激素撤退而绝经,而雌激素作为保护女性生殖系统的主要物质,绝经后生殖系统保护能力减退,因此高龄、绝经病人转化区内移的病人LEEP术后的复发率较高[13]。高度及以上级别的宫颈癌前病变病人容易累及宫颈管,并向内发展,随着病变级别的升高,颈管隐窝累及率也升高[14]。考虑宫颈管隐窝内藏匿着异形细胞,因此累及颈管时病灶的宽度和深度均扩大,治疗难度加大,且由于部分病灶被正常上皮细胞所覆盖,因此阴道镜检查及细胞学检查均可能表现出假阴性,术后随访中漏诊率较高,因此术后复发率较高[15]。本研究中80.65%的术后复发病人为同一型别HPV持续感染,且病人术前HR-HPV RLU/CO≥1 000的发生率较高,这提示我们术后同一型别HPV持续感染为宫颈癌前病变病人术后复发的高危信号,且高负荷HPV能够降低术后清除率,持续感染或再次感染可能是能造成宫颈癌前病变的复发因素,临床中我们应当避免术后HR-HPV再次感染,减少新的宫颈癌前病变产生,降低病灶的术后复发[16]。手术病理切缘阳性这一结果提示术后可能残留病灶。有学者[17]指出,病灶残留病人术后可能复发或发生浸润性宫颈癌。
综上所述,宫颈癌前病变妇女LEEP手术后2年内复发率为6.77%,高龄、绝经、累及颈管、术前HR-HPV RLU/CO≥1 000、切缘阳性、术后同一型别HPV持续感染均会增大其复发率,临床中应加强监测。

