结肠息肉圈套器冷切除术后瞬时性出血风险因素分析
李杨,汪胡根,蔡轶,冯慧,王亚雷,孙斌
结肠癌是我国最常见的消化道恶性肿瘤之一,多数结肠癌系腺瘤-腺癌途径演变而来,故内镜下结肠息肉切除是降低结肠癌发病率和死亡率的最有效治疗手段。但因医疗条件的地域差异,结肠息肉切除的技巧及设备也有所不同。近年来因结肠息肉圈套器冷切除术(cold snare polypectomy,CSP)相较于传统息肉电切除术,无需电热效应及黏膜下注射操作,具有操作便捷、迟发性出血及穿孔风险低的优势,并能保证低残留率及高完整切除率,故其应用愈加广泛。欧洲胃肠镜学会亦推荐对于≤9 mm 的结肠息肉采用 CSP 切除。但CSP切除后,因无电热效应处理创面,创面渗血不可避免,多数渗血可在数秒至数分钟内自行止血,但部分病变切除后会持续性出血,当CSP 术后创面出血超过2 min 仍无法自止,需要追加止血操作,则定义为CSP术相关瞬时性出血。故甄别CSP术后瞬时性出血风险因素,适时进行必要的内镜下止血操作,有助于减少CSP 并发症,提高操作效率及安全性。
1 资料与方法
1.1 一般资料
选取 2019 年 1 月至 2020 年 8 月于安徽医科大学第一附属医院行结肠息肉CSP治疗的住院病人58 例。纳入标准:接受CSP 切除直径<1 cm 的结肠息肉病人。排除标准:(1)正在使用抗血小板/抗凝药物或停药不足7 d;(2)内镜图片及临床资料不完整者。所有病人或其近亲属对研究知情同意,签署知情同意意见书。本研究符合《世界医学协会赫尔辛基宣言》相关要求。1.2 研究方法及观察指标
本研究使用的电子内镜系统包括CV-170(Olympus,日本)和EPX-4450HD(Fujifilm,日本),肠镜型号为CF-H170L/I(Olympus,日本)和EC-530WM/WI(Fujifilm,日本),圈套器型号为SD-230U-20(Olympus,日本)。依据是否发生瞬时性出血将病变分为瞬时出血组及无出血组,记录两组病人性别、年龄、病变大小、部位(升结肠、横结肠、降结肠、乙状结肠或直肠)、形态(0-IIa 或0-Is)、病理类型(腺瘤型或非腺瘤型)、是否形成血肿、是否形成圈套器冷切除创面突出物(cold snare defect protrusion ,CSDP)、CSP 术后创面大小及创面出血分级(1~3 级)。其中创面出血分级表示CSP术后瞬时创面渗血情况:1 级为几乎无血液渗出,2级为少量渗血,血液渗出<50%创面,3 级为明显渗血,血液渗出≥50%创面。记录上述各项观察指标后进行对比研究,分析引致CSP 瞬时性出血的危险因素。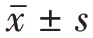
2 结果
2.1 一般情况
本研究共搜集病例58 例,瞬时出血组7例,需追加电凝止血或金属夹夹闭止血操作,7 例均为男性,年龄 58 岁,年龄范围为 51~65 岁,无出血组病例51 例,男性35 例,女性16 例,年龄57岁,年龄范围为22~80岁,两组年龄及性别差异无统计学意义(P
>0.05)。2.2 CSP 瞬时性出血风险因素分析
瞬时出血组病变共14 处,无出血组病变共123 处。单因素统计分析结果提示,两组病变分布位置、形态、是否形成CSDP、创面大小均差异无统计学意义(P
>0.05),两组病变大小、病理性质、是否形成血肿以及创面出血分级差异有统计学意义(P
<0.05)。进一步通过logistic 回归分析统计发现,仅CSP 术后创面血肿形成与创面瞬时出血分级差异有统计学意义(P
<0.05),校正比值比分别为121.585及26.472(表1)。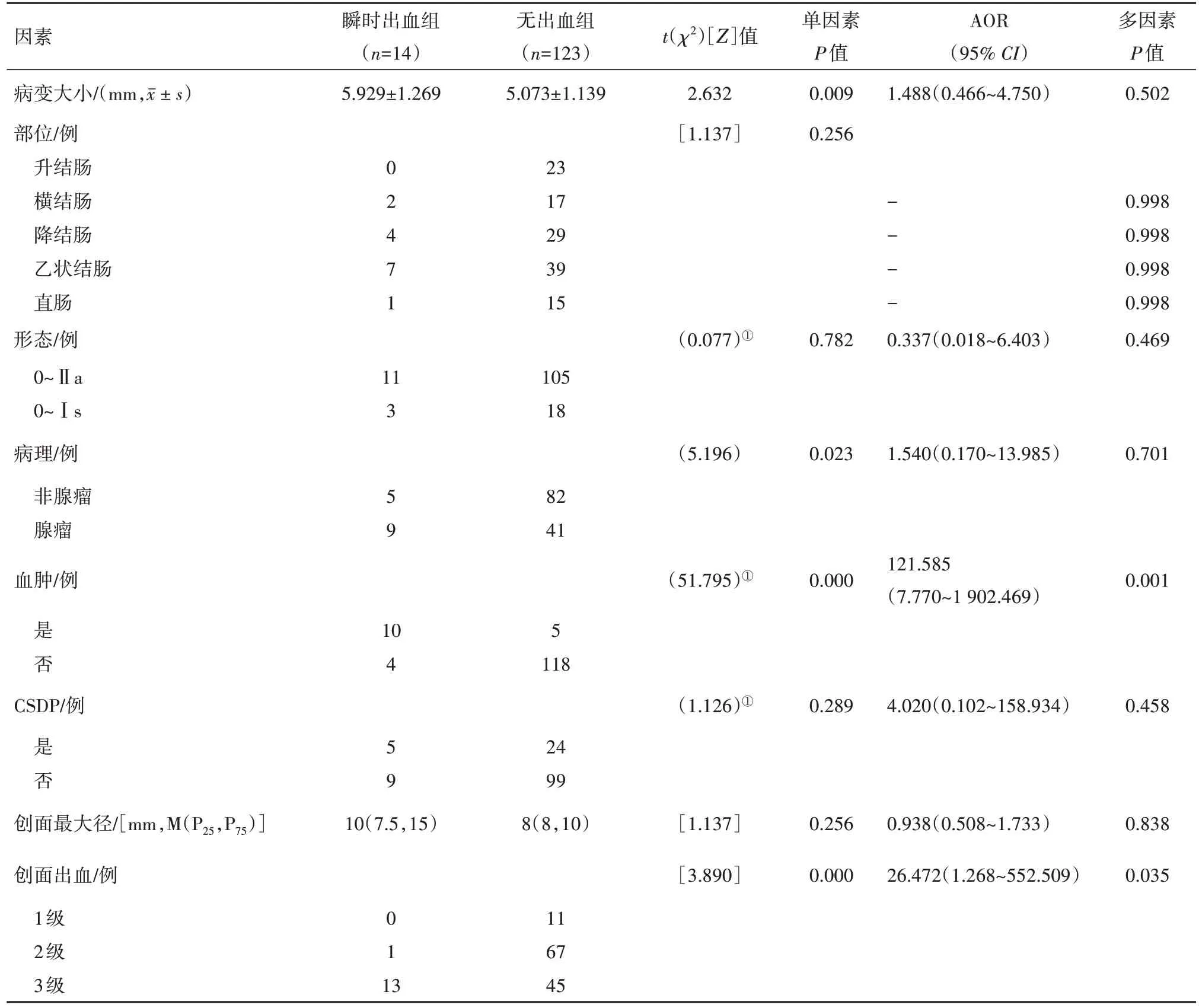
表1 结肠息肉圈套器冷切除术(CSP)后瞬时出血组与无出血组单因素及多因素分析结果
3 讨论
结肠镜下息肉切除是预防结肠癌的重要诊疗手段,以往息肉切除治疗多依赖高频电所产生的电热效应对需要切除的靶组织进行烧灼、凝固或切割治疗,但电切除所带来的热扩散效应不可避免,会影响消化道管壁深部组织结构从而发生迟发性出血、穿孔及电凝综合征等并发症。而相较于其他消化道管壁,结肠管壁更为纤薄,左半结肠管壁厚度仅约3 mm,右半结肠管壁厚度更薄至1.5 mm,黏膜下注射抬举病变操作难度更大,电切除治疗热扩散风险更高。随着对结肠息肉认知及诊疗技术的发展,<1 cm 的结肠息肉采用CSP 技术切除得以推广应用,该技术可很好的规避结肠息肉电切除所带来的迟发性出血及穿孔风险,且由于CSP 切除的息肉切缘无电灼痕迹,获取的组织量更多,病理评估更为准确。在息肉完整切除率方面,相较于传统的电灼除治疗,CSP 的安全性及完整切除率更高,与内镜下黏膜切除术或圈套器电切除治疗差异无统计学意义。CSP 因操作相对简单,对于符合标准的结肠息肉,应用CSP 技术还可显著缩短操作时间,提高治疗效率,避免反复更换内镜附件或反复黏膜下注射。
尽管CSP 切除<1 cm 结肠息肉相较于传统电切除优势明显,但由于缺少电热效应对切缘凝固作用,创面渗血几乎不可避免,多数CSP创面渗血可在数秒至数分钟内停止,但少数病变创面渗血时间超过2 min 无法自行停止,存在瞬时性出血可能,故识别瞬时性出血高危因素,以便预防性追加相应止血操作将有助于提高CSP安全性及镜下治疗效率。本项研究搜集了接受CSP 治疗的58 例结肠息肉病人,共计137 处病变,其中有14 处病变发生瞬时性出血,占比10.22%,观察2 min 创面仍无法自行止血,均追加金属夹夹闭或局部喷洒促止凝血药物,以最终确保CSP创面无活动性渗血。对息肉大小、部位、形态、病理类型、是否形成血肿、是否形成CSDP、CSP术后创面大小及创面出血分级等各项观察指标进行单因素及分析发现,更大的腺瘤型息肉,CSP术后发生创面血肿或创面出血分级较高均为瞬时性出血的危险因素,考虑尺寸较大腺瘤型息肉相比增生性息肉,往往拥有更加丰富的血管,CSP术后血管断端更多,出血风险更高。CSP切除病变过程中,由于圈套器尖端形状固定,圈套收紧后会对组织进行机械性撕扯,部分创面会形成CSDP,CSDP主要由黏膜下层及部分残留黏膜肌层构成,故CSP 切除会存在黏膜层部分残留的可能,当CSP 切除黏膜层病变时,血管断端较粗大或较多时,渗出的血液仍可快速充满创面处黏膜下层形成血肿,导致CSP 术后短时间内渗血无法自止,增加瞬时性出血风险。当创面黏膜层切除完整,创面无CSDP 形成,但出血分级较高,切割组织瞬间创面迅速渗满血液,也提示断端血管丰富或血管较粗大,短时间止血更加困难,需注意追加内镜下止血操作。因此单因素分析中,息肉大小、病理类型、血肿形成及出血分级均与瞬时性出血风险相关,而将全部观察指标纳入多因素分析后,统计结果仅提示CSP 创面血肿形成与出血分级与瞬时性出血有关,考虑息肉大小与病理类型决定了病变血管丰富程度及粗细程度,而这两项指标直接决定了创面血肿形成与出血分级的风险,是瞬时性出血风险因素更加直观的体现,故在多因素分析中可能将息肉大小与病理类型统计成为了混杂因素加以排除。综合本研究单因素分析及多因素分析结果,创面血肿形成与出血分级是预测CSP 瞬时性出血的最重要最直观的指标,而息肉病
理类型与息肉大小也具有一定的相关性,在CSP 术实施前具有一定的瞬时性出血风险提示意义。
国外相关研究结果提示,更大的息肉、隆起型形态的息肉进行CSP切除术后瞬时性出血风险更高,本研究中息肉大小仅在单因素分析时与瞬时性出血相关,而与息肉形态无明显相关性,考虑本项研究的搜集的病例数及样本量仍相对较少为主要局限性,出现阳性观察结果的例数仅为14 例,样本量不足导致统计偏差也具有一定相关性,继续扩大样本量将有助于获得更加准确的统计分析结果。此外,本项研究将进一步探讨CSP 术中应用的圈套器类型是否有助于改善瞬时性出血风险、提高完整切除率,以求更充分的评估相关风险因素,提升CSP治疗的有效性及安全性。
综上所述,结肠息肉CSP术后创面形成血肿,瞬间创面渗血明显,均提示CSP 术后瞬时性出血风险可能,短时间内自行止血可能性较低,需追加必要的内镜下止血操作,以提高治疗效率及安全性。

