不同形式壳聚糖基水凝胶的微观结构与控释性能对比
梁刚强,项拓,梁妍,司徒文贝
(华南农业大学食品学院,广东广州 510640)
随着人们生活水平的提高,功能食品备受人们的关注,其中活性蛋白由于具有调节人体生理作用、抗衰老、提高免疫力等功能,而备受关注[1,2]。但由于活性蛋白容易受人体消化道的消化酶、胃酸等降解,需要载体材料对其进行保护,以提高其生物利用度。同时,水凝胶是一种具有三维网络结构的载体,可通过氢键、共价键等与活性蛋白结合,从而对其进行保护[3]。天然来源的壳聚糖、淀粉、果胶等,具有形成水凝胶的能力,常被用于活性蛋白的包载及递送[4]。
壳聚糖是自然界中唯一的聚阳离子碱性多糖,拥有大量的游离氨基,化学性质十分活泼,可引入其他基团对其进行修饰。通过巯基化改性的壳聚糖,由于二硫键的引入,增强了壳聚糖分子链间的作用力,对活性蛋白的控释能力增强。巯基壳聚糖较之未改性的壳聚糖具有更好的细胞黏附性和渗透性,而且巯基壳聚糖溶液在生理pH值下具有原位胶凝特性,因此非常适合用于药物控释的载体[5]。此外可以对壳聚糖进行交联改性,交联改性壳聚糖具有一定的溶胀性能,可形成较容易被人们接受的水凝胶。三聚磷酸钠和六偏磷酸钠等无机试剂,无毒安全,常作为交联剂,用于壳聚糖改性[6]。不同的改性方法可产生不同的壳聚糖微观结构,进而影响水凝胶的三维网络结构,同时也对活性蛋白的生物利用情况产生影响。
巯基化改性与离子交联改性是常用的壳聚糖基水凝胶制备手段,在活性蛋白包埋递送方面有大量研究,但前人较少对两种水凝胶的结构性质差异进行比较。为此,本文采用离子交联及巯基化两种不同方式对壳聚糖进行改性,以牛血清白蛋白(BSA)为模型活性蛋白,制备壳聚糖基水凝胶,探讨了pH值、壳聚糖与交联剂的质量比、BSA浓度等因素对两种壳聚糖基水凝胶的包载性能影响,同时比较两种壳聚糖基水凝胶的平均粒径、Zeta电位、表面形貌、链结构,探讨两种壳聚糖水凝胶在模拟消化道环境中对活性蛋白的控释机理,为提高活性蛋白生物利用率提供依据,研究结果对蛋白类功能食品具有一定的促进意义。
1 材料与方法
1.1 原料
壳聚糖(分子量150000 g/mol):上海楷洋生物技术有限公司;三聚磷酸钠(TPP):天津市大茂化学试剂厂,分析纯;盐酸、氢氧化钠、N-羟基琥珀酰亚胺(NHS):广州化学试剂厂,分析纯;L-半胱氨酸、Ellman’s试剂:阿拉丁试剂上海有限公司,分析纯;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDAC)、5,5',-二硫代双(2-硝基苯甲酸),上海麦克林生化科技有限公司,分析纯;冰醋酸,上海国药公司,分析纯;牛血清白蛋白,北京博奥拓达科技有限公司;透析袋(截留分子量范围8000~12000 g/mol):广州市丛源仪器有限公司。
1.2 主要仪器设备
冷冻干燥机(FDU-1200):上海爱朗仪器有限公司;台式高速离心机(H/T16MM):湖南赫西仪器装备有限公司;紫外分光光度仪:上海美谱达仪器有限公司;扫描电镜(Verios 460):Thermo Fisher公司;纳米粒度及ZETA电位分析仪(Zetasizer Nano ZS 90):马尔文仪器有限公司;透射电镜(型号Talos L120 G2):Thermo Fisher公司。
1.3 实验方法
1.3.1 交联壳聚糖及其载有活性蛋白的凝胶微粒的制备
称量一定量的TPP和牛血清白蛋白(BSA),按一定的壳聚糖和交联剂的质量比称取壳聚糖,把壳聚糖溶于不同pH的乙酸-乙酸钠缓冲液,在磁力搅拌器搅拌的过程中把溶有交联剂和BSA的溶液滴加到壳聚糖溶液中,磁力搅拌2 h,10000 r/min中离心30 min,得到载有活性蛋白的交联壳聚糖凝胶微粒。同时,取上清液,通过BCA试剂盒测定、计算上清液中BSA的含量,进而计算BSA的包封率。
未包载有活性蛋白的交联壳聚糖按照上述步骤,不添加BSA进行制备,其余条件不变,离心得到交联壳聚糖后,经冷冻干燥得到粉末。
1.3.2 巯基化壳聚糖及其载有活性蛋白的凝胶微粒的制备
精确称量1.0000 g壳聚糖粉末,溶解在1%(V/V)醋酸溶液中,向其中加入EDAC和NHS溶液(比例3:1),使得最终溶液体积为100 mL,在室温下避光搅拌15 min,使其充分反应;随后,按照向溶液中加入2.0 g半胱氨酸,然后加入1 mol/L的NaOH溶液调节pH至5~6,室温避光反应5 h。将反应混合物装入透析袋中,用5 mM的盐酸透析两次,以除去未反应的L-半胱氨酸,用0.1 mol/L的NaCl溶液透析两次,以减少阳离子聚合物和阴离子巯基化合物之间的离子交换,再用1 mM盐酸透析3 d,取出透析袋中的液体与-80 ℃中预冻一天,真空冷冻干燥,得到巯基化壳聚糖粉末。利用Ellman’s试剂法,对所得巯基化壳聚糖粉末进行测定,所得的巯基化壳聚糖的巯基含量为558 μmol/g。
称量一定量的TPP和BSA,按照质量比称取巯基化壳聚糖并溶于不同pH的乙酸-乙酸钠缓冲液,磁力搅拌2 h,10000 r/min中离心30 min,取上清液,通过Bradford试剂盒的方法准确测量上清液中BSA的含量。在595 nm处测定BSA的紫外吸光度值,代入相应的标准曲线计算BSA浓度,按照下列公式,计算BSA的包封率。
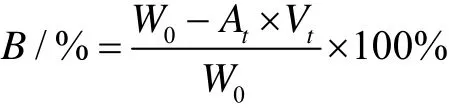
式中:B为BSA的包封率,%;W0为称取的BSA的质量,g;At为上清液中BSA的浓度,g/L;Vt为上清液体积,L。
1.3.3 傅里叶红外光谱分析
取适量改性壳聚糖粉末,与溴化钾粉末混合并充分研磨,在20 MPa下压片成型。称取适量的待测样品,将其在红外光下照射干燥后,与KBr在研钵中充分研磨2~5 min,置于自动压片装置中压片后进行测试。设置分辨率为4 cm-1,利用DTGS检测器先扫去空气的空白,扫描波数在4000~400 cm-1范围内,扫描64次后仪器取平均值显示的即为测试样品的红外特征光谱图。
1.3.4 形貌分析
取少量样品置于相应的缓冲液中,在40 MPa的条件下均质,使其均匀分布在溶液中。进行透射电镜分析时,将溶液滴加在400目普通碳支持膜的电镜铜网上,将样品置于40~50 ℃的烘箱中进行干燥处理后,滴加2%的磷钨酸溶液进行染色处理,90 s后将染色液吸干,静置风干。将铜网固定于样品杆,置于电镜,进行样品形貌观察,拍照记录。进行扫描电镜分析时,将溶液滴在导电胶上,静置风干后镀金,置于电镜,进行样品形貌观察,拍照记录。
1.3.5 平均粒径分析
称取一定量的载有活性蛋白的壳聚糖基凝胶微粒分别溶于不同pH值的缓冲液中,在40 MPa的条件下高压均质,使其均匀分布在溶液中,再取适量溶液润洗样品池后加入待测样品,将其置入测试槽中进行测试,平衡2 min,温度为25 ℃。采用粒度仪测定壳聚糖基凝胶微粒在不同pH值条件的平均粒径大小及数量分布。
1.3.6 Zeta电位分析
称取一定量的交联壳聚糖凝胶微粒分别溶于不同pH值的缓冲液中,在40 MPa的条件下高压均质,使其均匀分布在溶液中,取适量溶液润洗带电极的样品池,再将样品溶液用注射器注入样品池中,确保样品内无气泡,擦干电极部分,并保持干燥,将样品池置入测试槽中,平衡2 min,采用Zeta电位分析仪测定壳聚糖基凝胶微粒在不同pH值条件下的Zeta电位。
1.3.7 载有活性蛋白的壳聚糖基凝胶微粒的体外模拟消化
参考相关文献[7],将上述制备的两种微粒,置于200 mL溶出介质中,在37 ℃、100 r/min条件下进行搅拌,微粒在模拟人工胃液中运转2 h,然后在模拟小肠液中运转6 h,最后在模拟结肠液环境中运转42 h,并每隔一定时间对溶出介质进行取样,取样后的溶出介质。取出的溶出液通过Bradford试剂盒测量其中BSA的含量,进而得到壳聚糖基凝胶微粒在模拟消化过程中释放曲线。
1.3.8 数据统计
采用SPSS 21.0软件分析实验数据,数据差异性采用单因素方差分析处理,p<0.05表示具有显著差异,实验重复三次。
2 结果与讨论
2.1 改性壳聚糖的链结构分析
图1 是未改性壳聚糖、交联改性壳聚糖和巯基化改性壳聚糖的红外光谱,未改性壳聚糖在3420 cm-1处的宽峰为羟基和氨基的伸缩振动峰,是多糖特征峰。在2750~3000 cm-1附近为C-H伸缩振动峰,1560~1650 cm-1为酰胺Ⅰ带的-NH2振动,1280~1450 cm-1为酰胺Ⅱ带的-NH2振动,1050 cm-1和1100 cm-1为C-OH的振动峰[8]。与未改性壳聚糖相比,交联改性壳聚糖在3400 cm-1附近的吸收谱带变宽,说明交联后增加了壳聚糖的氢键作用力,1148 cm-1附近产生了典型的TPP振动峰[9],1070 cm-1附近产生了新峰,对应于P=O的拉伸和变形,这表明壳聚糖分子链通过TPP发生了交联[10]。而对于巯基化改性壳聚糖则在2570 cm-1附近有-SH的伸缩振动峰,说明改性后的壳聚糖中含有自由巯基[11],在1380 cm-1和1480 cm-1处两峰合并,说明形成了更多的酰胺键。两种不同的改性方式对壳聚糖分子链的影响,将影响后续壳聚糖水凝胶的各项性能。
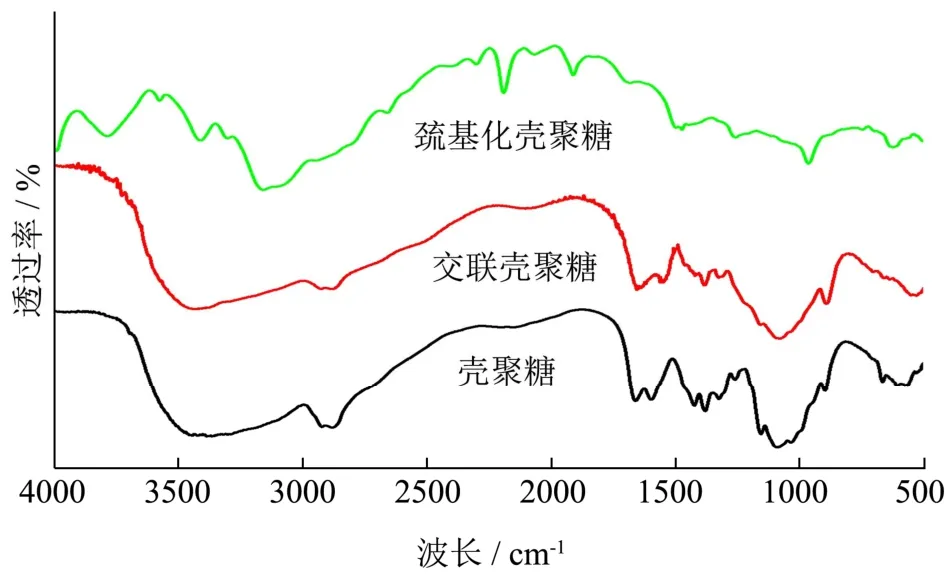
图1 不同壳聚糖材料的红外光谱图Fig.1 FT-IR of chitosan-based materials
2.2 不同因素对两种壳聚糖基水凝胶的包载性能影响
2.2.1 pH值的影响
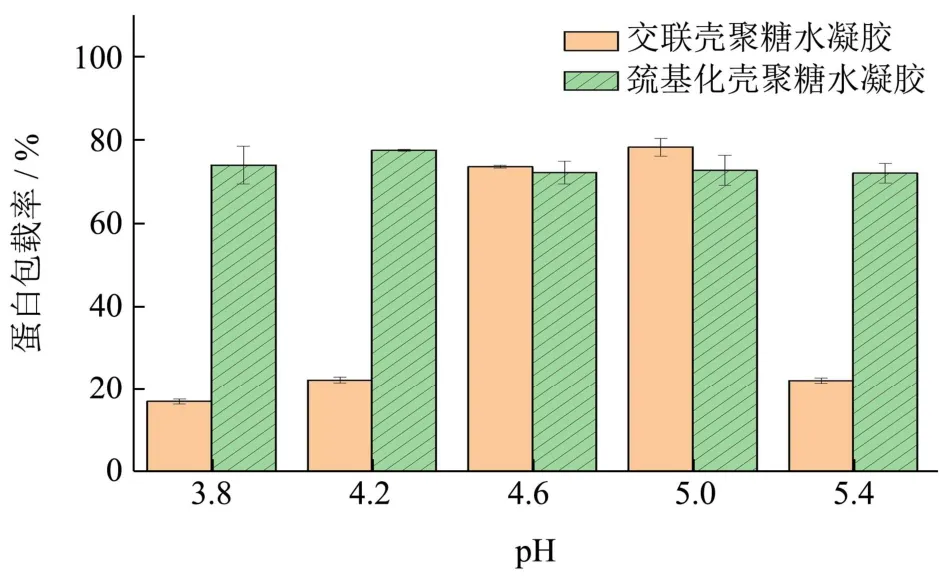
图2 pH对壳聚糖基水凝胶蛋白包载率的影响Fig.2 Effect of pH on protein entrapment efficiency of chitosan-based hydrogel
如图所示,交联壳聚糖水凝胶的蛋白包载率随着pH的增加呈现先增后减的趋势,并在pH为5时达到最大值78.30%;巯基化壳聚糖水凝胶的蛋白包载率随着pH的增加呈现先增后减的趋势,并在pH为4.2时达到最大值77.54%。
在相同pH条件下,交联壳聚糖水凝胶蛋白包载率受pH影响更加剧烈,最小包载率为16.97%,最大包载率为78.30%;巯基化壳聚糖水凝胶蛋白包载率受pH影响不大,包载率稳定在72.04%~77.54%之间。参考有关文献可知,酸性条件下,壳聚糖氨基与交联剂离子基团之间的静电相互作用受到破坏,壳聚糖分子链中未参与交联的氨基发生质子化,氢键发生解离[12],交联壳聚糖凝胶稳定性降低,蛋白包载率降低;而巯基化壳聚糖包载蛋白过程中,有部分牛血清蛋白与巯基化壳聚糖分子上的二硫键结合,从而形成凝胶[13],因此凝胶稳定性提高,在pH 3.8~5.4之间变化对其蛋白包载率影响不大。
2.2.2 壳聚糖与TPP质量比的影响
如图3所示,交联壳聚糖水凝胶的蛋白包载率随着CS:TPP质量比的增加呈现先增大后减小的趋势,并且在CS:TPP值为8时,包载率达到最大值为95.66%;巯基化壳聚糖水凝胶的蛋白包载率随着CS:TPP值的增加呈现先增大后减小的趋势,并且在CS:TPP值为8时。包载率达到最大值为71.07%。
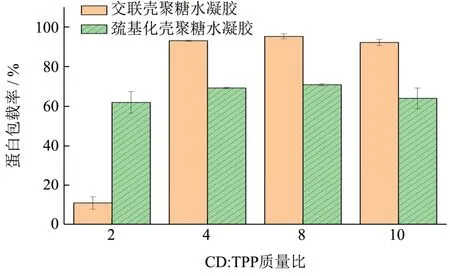
图3 CS:TPP质量比对壳聚糖基水凝胶蛋白包载率的影响Fig.3 Effect of CS:TPP mass ratio on protein entrapment efficiency of chitosan-based hydrogel
在相同条件下,交联壳聚糖水凝胶蛋白包载率受CS:TPP质量比影响较大,最小包载率为10.88%,最大包载率为95.66%;巯基化壳聚糖水凝胶蛋白包载率受CS:TPP质量比影响较小,蛋白包载率稳定在62.12%~71.07%。参考有关文献可知,因为交联剂中磷酸根离子可以与壳聚糖上的氨基结合,随着交联剂浓度的不同,交联反应程度不同,从而影响到蛋白的包载率[12],而巯基化壳聚糖水凝胶受交联剂影响小,因此蛋白包载率变化较小。
2.2.3 BSA浓度的影响

图4 BSA浓度对壳聚糖基水凝胶蛋白包载率的影响Fig.4 Effect of BSA concentration on the encapsulation efficiency of chitosan-based hydrogel
如图所示,交联壳聚糖水凝胶的蛋白包载率随着BSA浓度的增大呈现先增大后减小的趋势,并且在BSA浓度为0.6 g/L时,包载率达到最大值为98.38%;巯基化壳聚糖水凝胶的蛋白包载率随着BSA浓度的增大呈现先减小后增大的趋势,并且在BSA浓度为0.4 g/L时,包载率达到最大值为82.22%。在相同的BSA浓度下,交联壳聚糖水凝胶蛋白包载率总是大于巯基化水凝胶。如前所述,巯基化壳聚糖包载蛋白过程中,部分蛋白以二硫键与巯基化壳聚糖结合形成凝胶,新生成的凝胶层对未参与反应的壳聚糖链段的移动形成阻碍,从而降低了活性蛋白的包载率。
综合上述结果,pH值、CS:TPP质量比以及BSA浓度对交联壳聚糖水凝胶的蛋白包载率影响明显。交联壳聚糖水凝胶通过壳聚糖上的氨基与交联剂中的磷酸基团形成氢键,进而包络在活性蛋白外,而氢键容易受周围环境中pH值、离子种类/强度等影响。因此,改变制备条件,交联壳聚糖水凝胶的蛋白包载率变化明显。而对于巯基化壳聚糖水凝胶,巯基的引入减少了壳聚糖上氨基的数目,避免了壳聚糖链段相互作用,可提高壳聚糖水凝胶稳定,从而不易受到周围环境的影响,后续水凝胶的电位分析结果将进一步印证。
2.3 两种壳聚糖基水凝胶的形貌分析
图5 a为包载有BSA的交联壳聚糖水凝胶的透射电镜图,图片中浅灰色的物质是交联之后的壳聚糖,其中的黑色的颗粒为染色后的BSA,交联后的壳聚糖水凝胶对BSA形成有效包埋。图5b为包载有BSA的巯基化壳聚糖水凝胶的透射电镜图,载蛋白的巯基化壳聚糖水凝胶呈现球状,与交联壳聚糖水凝胶相比,BSA集中包载在水凝胶的中心,凝胶微粒结构紧凑。这与巯基的引入、壳聚糖链段相互作用减少和巯基化壳聚糖水凝胶稳定性提高有关。此外,图5c和d分别为包载有BSA的交联壳聚糖水凝胶和巯基化壳聚糖水凝胶的扫描电镜图,图中两种凝胶微粒呈球状。另外,根据扫描电镜配套软件测定,交联壳聚糖凝胶尺寸在830 nm左右,巯基化壳聚糖凝胶尺寸在150 nm左右。
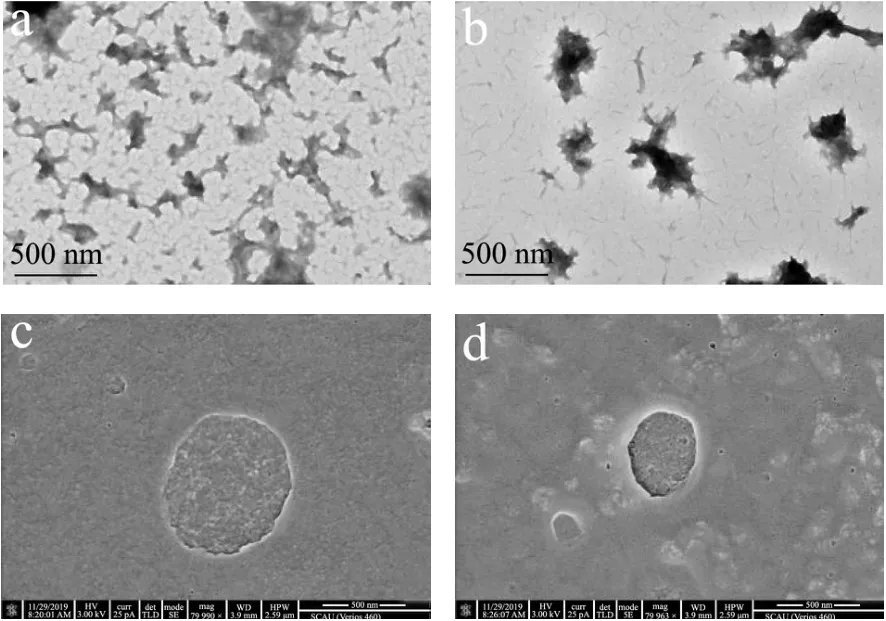
图5 两种壳聚糖基水凝胶的透射电镜图(a,b)和扫描电镜图(c,d)Fig.5 Morphology of two chitosan-based hydrogelsby TEM (a,b) and SEM (c, d)
2.4 两种壳聚糖基水凝胶的粒径与表面电位
2.4.1 粒径分析
图6 为两种壳聚糖基水凝胶在不同pH下的粒径比较,从图中可以看出交联壳聚糖水凝胶的粒径随着pH的增大先增大后减小,pH为4时,粒径最大为1085 nm。巯基化壳聚糖水凝胶的粒径随着pH的增大先减小增大,pH为8时,粒径最大为4987 nm。结果与参考文献的结果接近[14]。
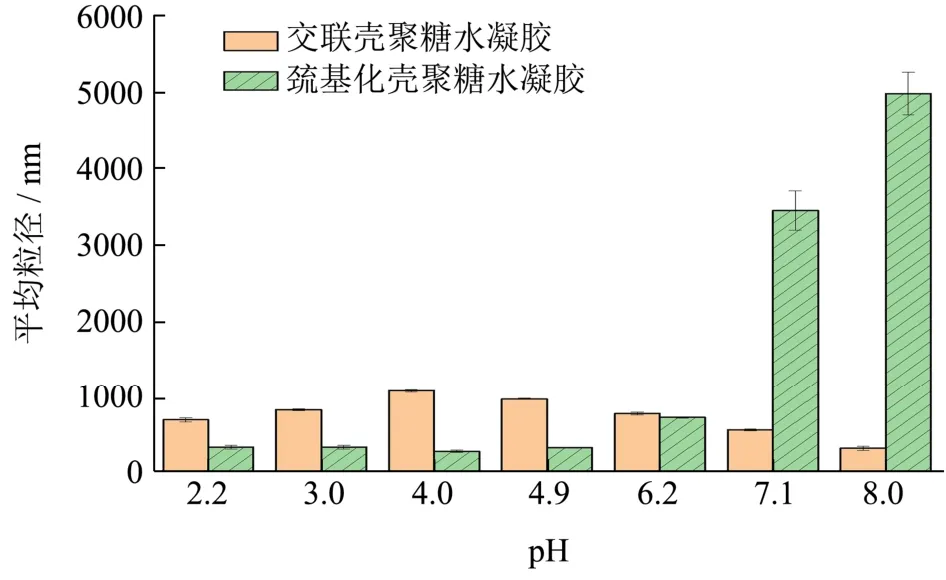
图6 两种壳聚糖水凝胶在不同pH下的粒径比较Fig.6 Comparison of the particle size of two chitosan-based hydrogels at different pH
2.4.2 Zeta电位
图7 为两种壳聚糖水凝胶在不同pH下的表面电荷比较,从图中可以看出,交联壳聚糖水凝胶表面电荷随着pH的增大由正值变为负值,当pH为8时,表面电荷绝对值达到最大为8.29 mV。巯基化壳聚糖水凝胶表面电荷在强酸环境下,基本接近0,之后随着pH的增大,表面电荷均变为负值。
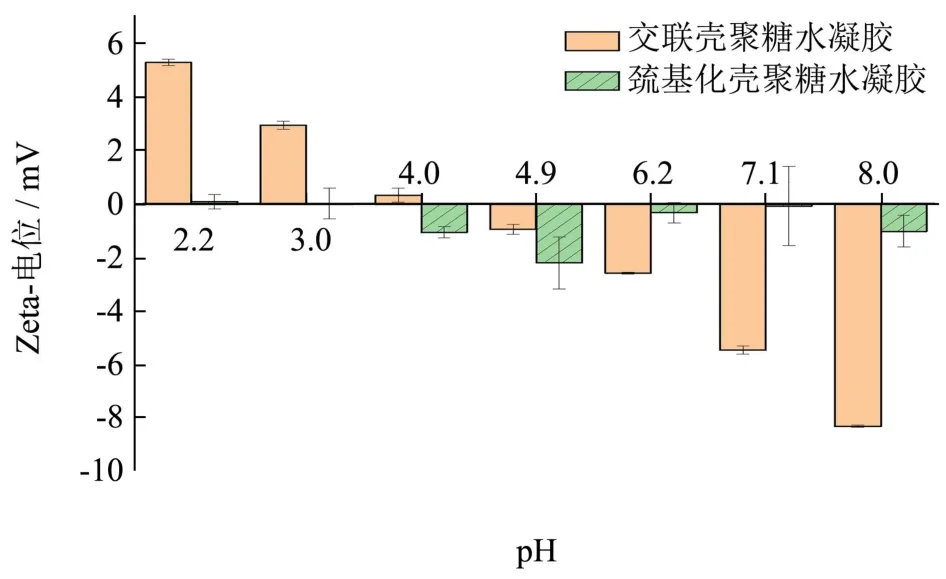
图7 两种壳聚糖水凝胶在不同pH下的表面电荷比较Fig.7 Comparison of the surface charges of two chitosan-based hydrogels at different pH
综合图6和图7,不同pH条件下交联壳聚糖凝胶平均粒径和Zeta电位信息可知,当pH=2.或3.0或4.0时,Zeta电位为正值,此时壳聚糖呈质子化,易于与交联剂进行交联。随着pH的增加,BSA表面带电荷越少,壳聚糖交联所形成的凝胶层包覆在BSA表面,溶液中由于正负离子的Zeta电位减小,平均粒径增加,这主要与BSA的等电点有关。当溶液pH接近等电点时,BSA相互斥力减弱,包载后BSA的交联壳聚糖凝胶微粒间相互聚集,从而增大平均粒径。当溶液pH远离等电点的时候,由于溶液离子间的斥力增加,交联壳聚糖凝胶微粒间相互排斥,进而降低平均粒径[4]。
对于巯基化壳聚糖水凝胶,当pH=3.0或4.0时,Zeta电位为正值,此时壳聚糖呈质子化,巯基降低了质子化氨基的排斥作用,使壳聚糖链变得柔顺并收缩,有利于通过静电作用形成球状结构,导致了较小粒径的形成。另外,巯基的引入减少了壳聚糖上氨基的数目,导致表面电势的降低,而且巯基在pH=5.3~5.6时能够部分去质子化形成S-,同样引起了表面电势的降低。当pH为7.1或8.0时,溶液中OH-离子增加,与壳聚糖水凝胶中巯基互相排斥,造成粒子结构松散,粒径增大[15]。这也是在水凝胶制备过程中,pH值在酸性条件下变化对巯基化壳聚糖水凝胶蛋白包载率影响较小的原因。
2.5 两种壳聚糖基水凝胶的消化性能比较
图8 为两种载有BSA的壳聚糖基水凝胶在体外模拟消化道中的释放情况。其中,在模拟胃液中(运转2 h),BSA分别从交联壳聚糖水凝胶和巯基化壳聚糖水凝胶中释放了6.36%和5.73%;在模拟小肠液中(运转6 h),BSA分别从交联壳聚糖水凝胶和巯基化壳聚糖水凝胶中释放了44.76%和8.42%;在体外模拟消化结束时(运转41 h),BSA分别从交联壳聚糖水凝胶和巯基化壳聚糖水凝胶中释放的累积释放率为50.34%和42.96%。
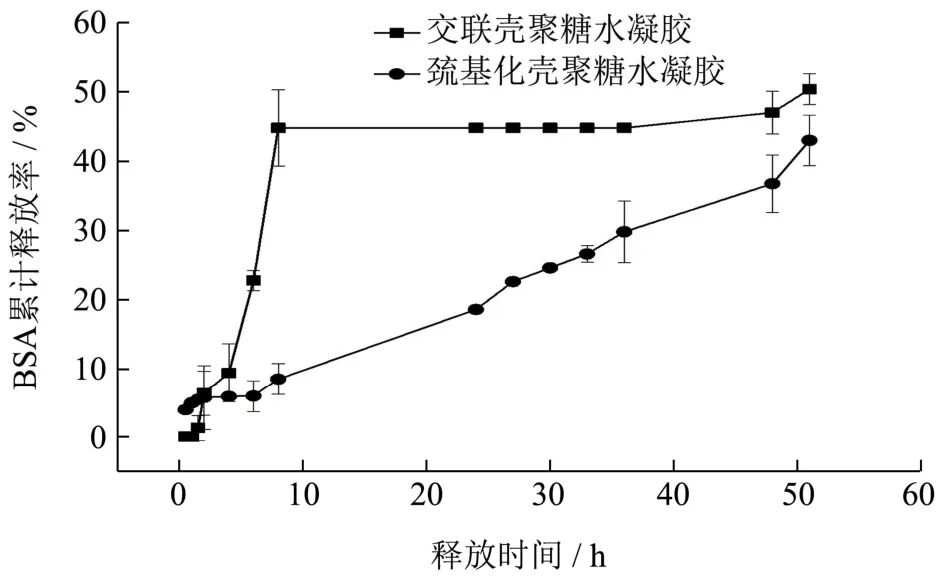
图8 两种壳聚糖基水凝胶在模拟人体消化道环境中的释放情况Fig.8 Releasing proterty of two chitosan-based hydrogels in a simulated human digestive tract environment
对比两种壳聚糖基水凝胶,交联壳聚糖水凝胶在消化前2 h已经出现突释的现象,并持续到6 h后释放速度减缓,上消化道释放率达到44.76%,后续结肠部位仅有5.58%释放;巯基化壳聚糖水凝胶在消化的前8 h内释放缓慢,释放率仅为8.42%,转运至模拟结肠液(10 h后),释放速度逐渐增加,呈现持续释放的效果,约有34.53% BSA释放在结肠中,与参考文献研究结果接近[16]。其原因在于交联壳聚糖水凝胶在胃液酸性环境下壳聚糖分子中氢键被破坏,BSA被快速释放出来;而巯基化壳聚糖包载蛋白过程中,会有部分BSA与巯基化壳聚糖上的二硫键结合,而被包载到水凝胶骨架上(图9),酸性环境下不被破坏,因此可以实现缓慢持续释放。当释放环境转变成偏中性的模拟小肠液(pH 6.8)和中性的模拟结肠液(pH 7.0),水凝胶中的巯基先经质子化形成S-,随后由于溶液中OH-离子增加,而使得分子链段相互排斥,从而使所包载的蛋白质释放。水凝胶粒径与zeta电位的结果也显示,当pH增大至7.0~8.0之间,巯基化水凝胶表面电位增加,粒径增大,粒子结构松散,这也将进一步增大蛋白质的释放。

图9 两种壳聚糖基水凝胶对BSA包埋及控释机理图Fig.9 BSA embedding and controlled-releasing mechanism of two chitosan-based hydrogel
3 结论
本文采用离子交联及巯基化两种不同方式对壳聚糖进行改性,制备不同形式的载有活性蛋白的壳聚糖基水凝胶,由于通过离子交联形成氢键,pH值、CS:TPP质量比以及BSA浓度等对交联壳聚糖水凝胶的蛋白包载率影响明显。而巯基的引入减少了壳聚糖上氨基的数目、在低pH环境,可降低壳聚糖上质子化氨基的相互排斥作用,增加壳聚糖链段的柔顺性,使得在酸性环境下,巯基化壳聚糖水凝胶具有较小的粒径和较低的表面电势。壳聚糖基水凝胶结构的改变也影响其消化性能,其中交联壳聚糖水凝胶在模拟胃液中已出现突释现象,在运送至结肠前,已有44.76%的活性蛋白释放,而巯基化壳聚糖水凝胶在模拟上消化道展现良好的控释性能,仅有8.42%的活性蛋白释放,当运送至模拟结肠环境,释放速度逐渐增加,呈现持续释放的效果,约有30%的BSA逐渐释放在结肠中,这对活性蛋白的生物利用改善具有重要作用。

