紫苏叶乙醇提取物的抗过敏活性及其作用机制
邢钰彬,刘思佳,星萍,陈晓平
(吉林农业大学食品科学与工程学院,吉林长春 130118)
紫苏(Perilla frutescens)为唇形科一年生草本植物,又名回回苏、红紫苏、赤苏、苏子等。国家卫健委公布2019最新版药食同源目录里,将紫苏、紫苏子归纳到了药食同源可用种类里。我国已有2000多年的栽培历史,在我国多作为香辛配料,食用方式单一。紫苏叶中含有多种化学成分都具有很好的生物活性,如挥发油、黄酮类、花色苷类、酚酸类、苷类、和三萜类等。国外研究者发现紫苏一类香料植物,除了具有香辛料特有的增进食欲、矫臭、赋香、着色等四大作用外,还具有抗氧化性[1,2]、抗菌性[3,4]、抗过敏性等多种机能[5,6]。Shin T Y[7]等通过对紫苏叶水提物进行研究,发现紫苏的水提物在老鼠体内或体外均有治疗I型过敏和C48/80引发的过敏,阻止组织胺的释放。Takagi S[8]从紫苏叶中首次分离出了紫苏糖肽,紫苏糖肽具有抑制组胺释放及蛋白激酶C活性的作用,认为该种物质能够阻止Ca2+触发靶细胞脱颗粒,干扰组胺物质的释放,达到抗过敏的作用。
近年来,全球化进程加快,食品的种类和加工工艺越来越多,致使潜在过敏人群不断扩大,由食品过敏引发的过敏疾病已占过敏总数的90%左右[9,10]。过敏引发的皮肤瘙痒难耐,红肿等一系列反应使许多患者深受其害[11,12]。近年来发现一些天然活性物质具有抗过敏活性,并且天然活性物质的作用靶点多,对机体不易产生毒性和副作用,因此越来越多的研究开始转向天然活性物质[13,14]。本研究在构建小鼠全身皮肤瘙痒模型和小鼠迟发型超敏反应模型基础上,通过小鼠被动皮肤过敏反应试验和DNCB诱发迟发型小鼠超敏反应试验,确定紫苏叶乙醇提取物对目前最常见的I、IV型过敏的抗过敏作用,以期明确紫苏叶乙醇提取物的抗过敏作用,并进一步探讨其作用机制,为紫苏叶这一种食药两用植物的应用及高值化开发提供依据。
1 材料与方法
1.1 材料
1.1.1 药品与试剂
紫苏叶:由课题组采购市售皱叶紫苏鲜叶。自然晾干,去杂,粉碎过80目筛,密封袋保存备用。
主要试剂:无水乙醇、丙酮天津市富宇精细化工有限公司;生理盐水石家庄四药有限公司;卵白蛋白范德北京生物科技有限责任公司;地塞米松索莱宝生物科技有限公司;2,4-二硝基氯苯天津市光复精细化工研究所;免疫球蛋白E(IgE)试剂盒、白三烯B4(LTB4)试剂盒、血小板活化因子(PAF)试剂盒、α肿瘤坏死因子(TNF-α)试剂盒、白细胞介素4(IL-4)试剂盒、γ-干扰素(IFN-γ)试剂盒上海抚生实业有限公司。
1.1.2 实验动物
SPF级KM小鼠,5~7周龄,体质量30~35 g,SPF级,购于斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019-0010;小鼠维持饲料,购于北京华阜康生物科技股份有限公司,生产许可证号(SCXK(京)2019-0008)。
饲养条件:饲养于吉林农业大学实验动物中心清洁级动物饲养室。室温20~25 ℃、湿度40%~60%,人工照明,12 h明/12 h暗,笼具及垫料定期清洗更换,动物于饲养中心隔离适应一周后用于试验。
1.1.3 仪器与设备
FW100微型高速万能粉碎机,天津市泰斯特仪器有限公司;BSA2202S电子天平、BSA124S电子天平,赛多利斯科学仪器(北京)有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;FD-2A-30真空冷冻干燥机,江苏天翔仪器有限公司;S-1-150S高速冷冻离心机,巩义市宏华仪器设备工贸有限公;HBS-1101酶标分析仪,南京德铁实验设备有限公司;SG330H超声仪,上海冠特超声仪器有限公司;电子数显千分尺,由吉林农业大学实验动物中心提供。
1.2 方法
1.2.1 紫苏叶乙醇提取物制备
紫苏叶由课题组采购。自然晾干,去杂,粉碎过80目筛,密封袋保存备用。精密称取紫苏叶粉末,每50 g加入1000 mL 60%乙醇浸泡2 h,间歇式超声提取,功率200 W,时间1 h,温度50 ℃。将上清液滤出,相同条件下将滤渣再提取2次,合并滤液,离心除去残渣,所得上清液用旋转蒸发仪减压浓缩,超低温冰箱预冻后冷冻干燥,备用[15]。
1.2.2 紫苏叶乙醇提取物对小鼠被动皮肤过敏反应的影响
选取KM小鼠5只,5~7周龄,体质量30~35 g,雌雄各半。称取20 mg/mL卵白蛋白生理盐水溶液与等体积紫苏叶乙醇提取物(Folium Perillae Extract,FPE)水溶液混合均匀后作为致敏液,每只动物腹腔注射致敏液0.2 mL致敏,隔日1次,共3次,于首次致敏后第14 d对小鼠进行眼球取血,将采集的血液样本常温放置40 min,3000 r/min 4 ℃离心10 min,分离血清,置4 ℃冰箱,用于后续抗血清生理盐水稀释液制备[16]。
另取KM小鼠60只,体质量30~35 g,雌雄兼用,按体质量随机分为6组即正常对照组(Control)、模型组(Model)、阳性对照组(Positive)、紫苏叶乙醇提取物低剂量组(FPE-L)、中剂量组(FPE-M)、高剂量组(FPE-H),每组10只。Control组和Model组灌胃给予纯化水,FPE-L、FPE-M、FPE-H组分别灌胃给予0.25、0.5、1 g/kg FPE水溶液,除Positive组于实验第12 d开始腹腔注射给药外,其余各组小鼠均在实验第1 d开始灌胃给药,每只0.1 mL/10 g,1次/d,连续给药14 d。Positive组于第12 d开始腹腔注射1.6 mg/kg地塞米松,注射剂量每只0.1 mL/10 g。连续注射给药3 d。试验期间自由采食、采水,每2 d称量一次体重。
末次灌胃后60 min,小鼠背部常规备皮(3 cm×3 cm),除Control组外,其他试验组背部皮内注射0.2 mL抗血清生理盐水稀释液(将之前制备并于4 ℃保存备用的抗血清:0.9%生理盐水=1:5的混合配制液)。48 h后,尾静脉注射1%卵白蛋白生理盐水混合溶液0.2 mL/只致敏。以前后爪搔抓头部和躯干、嘴咬身体各部位作为皮肤瘙痒指征,即刻观察并记录各组小鼠30 min内出现的瘙痒次数及首次开始瘙痒时间,即瘙痒阈值[17,18]。
瘙痒阈值测试后,小鼠眼球取血,将采集的血液样本常温放置40 min,3000 r/min 4 ℃离心10 min,分离血清,按试剂盒说明测定血清中免疫球蛋白E(immunoglobulin E,IgE)、白三烯B4(leukotriene B4,LTB4)、血小板活化因子(platelet activating factor,PAF)水平。取血后将小鼠颈椎脱臼致死,分离完整的胸腺、脾脏、心脏、肝脏称重,根据公式(1)计算脏器系数。

1.2.3 紫苏叶乙醇提取物对DNCB诱发的小鼠迟发型超敏反应的影响
选取KM小鼠60只,5~7周龄,体质量30~35 g,雌雄兼用,按体质量随机分为6组即正常对照组(Control)、模型组(Model)、阳性对照组(Positive)紫苏叶乙醇提取物低剂量组(FPE-L)、中剂量组(FPE-M)、高剂量组(FPE-H),每组10只。Control组和Model组灌胃给予纯化水,FPE-L、FPE-M、FPE-H组分别灌胃给予0.25、0.5、1 g/kg紫苏叶乙醇提取物水溶液,除Positive组于试验第12 d开始腹腔注射给药外,其余各组小鼠均在试验第1 d开始灌胃给药,每只0.1 mL/10 g,1次/d,连续给药13 d。Positive组于第11 d开始腹腔注射1.6 mg/kg地塞米松,注射剂量每只0.1 mL/10 g。连续注射给药3 d[19]。试验期间自由采食、采水,每2 d称量一次体重。
试验开始前1 d小鼠背部常规备皮(3 cm×3 cm),各组试验动物除空白对照组外于脱毛24 h后(试验第1 d)在其脱毛区域均匀涂抹3% DNCB(4:1丙酮橄榄油混合液配制)40 μL致敏1次,第2 d加强致敏一次,涂抹剂量减半。空白组给予等量4:1丙酮橄榄油。实验第5 d在小鼠右耳内外侧均匀涂抹1% DNCB 20 μL激发,左耳涂等量4:1丙酮橄榄油,实验第8、11 d重复此刺激。从小鼠背部致敏前1 d开始,利用电子数显千分尺分别测量每组小鼠左、右耳中部的厚度,平行测量2次,取平均值,根据公式(2)计算耳肿胀度。每隔2 d同法测定耳肿胀度(即耳部激发24 h后)。末次激发48 h后(第13 d)脱颈处死小鼠,用打孔器摘取各鼠右耳相同部位同样大小的耳片,加入0.9 mL冰冷的生理盐水,于冰水浴中充分研磨,匀浆,3000 r/min、4 ℃离心15 min取上清液,按试剂盒说明测定α肿瘤坏死因子(tumor necrosis factor,TNF-α)、白细胞介素4(interleukin-4,IL-4)、γ-干扰素(interferon-γ,IFN-γ)水平[20,21]。取耳后分离完整的胸腺、脾脏、心脏、肝脏称重,根据公式(1)计算脏器系数。

1.3 数据处理与统计学分析
应用Excel 2019对数据进行处理。应用SPSS 23.0.0软件进行统计分析,所有数据均以平均数±标准差(±s)来表示,组间t检验,p<0.05表示组间差异有统计显著性,p<0.01表示组间差异极显著。
2 结果与讨论
2.1 紫苏叶乙醇提取物对小鼠被动皮肤过敏反应的影响
2.2.1 紫苏叶乙醇提取物对被动皮肤过敏模型小鼠脏器系数的影响
脏器系数是试验动物某脏器的重量与其体重之比值。正常时各脏器与体重的比值比较恒定。脏器系数增大,表示脏器充血、水肿或增生肥大等;脏器系数减小,表示脏器萎缩及其他退行性改变。由表1可见,各组小鼠脾脏、胸腺、心脏、肝脏无显著性变化,差异无统计学意义(p>0.05)。
表1 FPE对被动皮肤过敏模型小鼠脏器系数的影响Table 1 Effect of FPE on organ coefficient of mice with passive skin allergy (±s, n=10)

表1 FPE对被动皮肤过敏模型小鼠脏器系数的影响Table 1 Effect of FPE on organ coefficient of mice with passive skin allergy (±s, n=10)
注:与Control组比较:#表示差异显著(p<0.05),##表示差异极显著(p<0.01);与Model组比较:*表示差异显著(p<0.05),**表示差异极显著(p<0.01)。下表同。
?
2.1.2 紫苏叶乙醇提取物对被动皮肤过敏模型小鼠瘙痒次数及瘙痒阈值的影响
被动皮肤过敏试验为抗Ⅰ型过敏反应药物的常用筛选方法,该类反应主要由IgE抗体介导。卵白蛋白作为一种异种蛋白,首次注射入小鼠体内,可致敏机体产生富含IgE的抗体。抗体再次注入体内,IgE抗体与肥大细胞或嗜碱粒细胞结合,形成致敏靶细胞,使机体呈高敏状态。当机体再次接触同种抗原时,抗原与特异性IgE发生联桥,导致肥大细胞活化及脱颗粒,释放包括组胺、PAF、LTB4等多种生物活性物质,引起平滑肌收缩、黏膜水肿、血管通透性增高形成过敏症候群,包括皮肤红肿、瘙痒等一系列局部或全身反应[22]。本试验中,结果由表2可以看出,FPE-M、FPE-H组小鼠与Model组小鼠相比,瘙痒次数明显减少,有极显著性差异(p<0.01)。FPE-L、FPE-M、FPE-H组与Model组相比显著延长小鼠首次瘙痒时间,提高瘙痒阈值,FPE-M与Model组比较,有显著性差异(p<0.05),FPE-H组与Model组有极显著性差异(p<0.01),且呈现一定的剂量相关性。提示FPE对被动皮肤过敏小鼠全身瘙痒有一定的止痒作用,对I型过敏反应有一定的抑制作用。但效果没有阳性对照组显著。
表2 FPE对被动皮肤过敏模型小鼠瘙痒次数及瘙痒阈值的影响Table 2 Effects of FPE on pruritus frequency and pruritus threshold in mice with passive skin allergy (±s, n=10)

表2 FPE对被动皮肤过敏模型小鼠瘙痒次数及瘙痒阈值的影响Table 2 Effects of FPE on pruritus frequency and pruritus threshold in mice with passive skin allergy (±s, n=10)
?
2.1.3 紫苏叶乙醇提取物对被动皮肤过敏模型小鼠血清中IgE、PAF、LTB4水平的影响
结果见图1。Model组(11.90 ng/mL)小鼠与Control组(4.68 ng/mL)相比,血清中IgE水平显著提高(p<0.01),显示建模成功。与Model组相比,各剂量组小鼠血清中IgE水平均有所下降。其中FPE-M组小鼠血清中IgE水平(10.15 ng/mL)下降了14.7%,存在显著差异(p<0.05),FPE-H组小鼠血清中IgE水平(8.22 ng/mL)下降了30.92%,存在极显著差异(p<0.01)。说明紫苏叶乙醇提取物可显著降低致敏小鼠血清中IgE的水平,高剂量作用效果更加显著。日本学者ImaokaK等人的研究也表明,日本种绿叶紫苏的提取物能够显著的抑制IgE类抗体,但对IgG类抗体无影响,表明了日本种绿叶紫苏的提取物对IgE类抗体产生的过敏性疾病有疗效作用[23]。
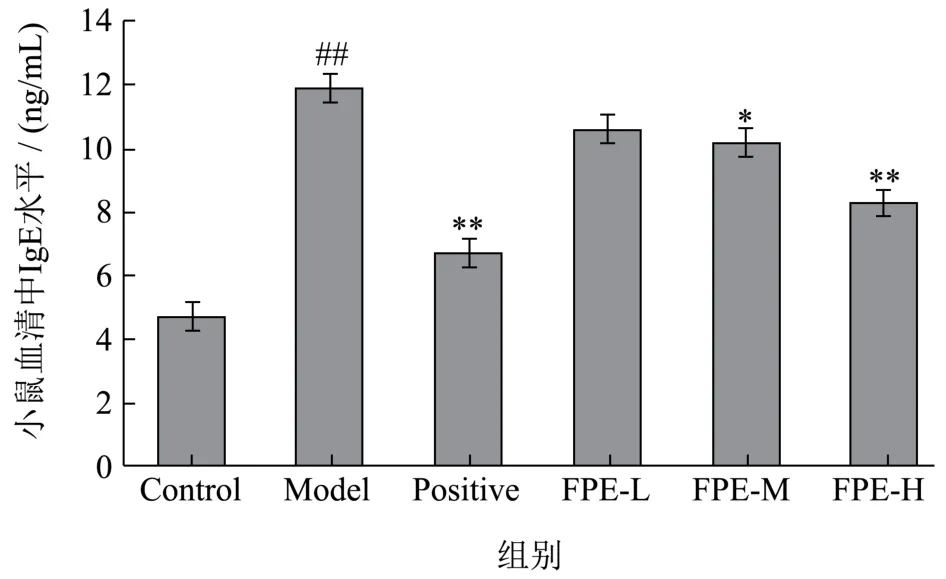
图1 紫苏叶乙醇提取物对被动皮肤过敏模型小鼠血清中IgE水平的影响Fig.1 Effect of ethanol extract of perilla leaf on serum IgE level in mice with passive skin allergy
血小板激活因子(PAF)是另一种炎症介质,乃由IgE致敏的嗜碱性粒细胞在结合抗原后产生。PAF一方面可直接作用于靶细胞,还可刺激细胞合成其他炎症介质,特别是前列腺素和白三烯的合成。由图2可知,Model组小鼠血清中PAF水平(22.27 pg/mL)明显高于Control组(14.98 pg/mL)(p<0.01),显示建模成功。与Model组相比较,各剂量组小鼠血清PAF水平均有所下降,低、中、高剂量组中PAF的含量分别下降4.2%、13.8%和15.5%。其中FPE-M组(19.20 pg/mL)和FPE-H组(18.86 pg/mL)与Model组比较存在极显著差异(p<0.01)。上述数据表明:Model组致敏小鼠血清中PAF含量会增加,紫苏叶乙醇提取物可以有效的控制致敏小鼠血清中PAF的含量,暂时未发现明显的剂量依赖关系。

图2 紫苏叶乙醇提取物对被动皮肤过敏模型小鼠血清中PAF水平的影响Fig.2 Effect of ethanol extract of perilla leaf on serum PAF level in mice with passive skin allergy
白三烯是花生四烯酸(arachidonic acid,AA)分别经环氧酶、5-脂氧合酶代谢途径生成的重要的炎症介质,广泛参与机体炎性、过敏性反应的发生,还可强化肥大细胞释放炎症介质的效应参与过敏反应发病机制的调节[24]。由图3可以看出,与Control组(20.22 pg/mL)相比,Model组(36.17 pg/mL)小鼠血清中LTB4水平显著提高,显示建模成功。与Model组相比,各剂量组小鼠血清中LTB4水平均有所下降。以FPE-H组(28.05 pg/mL)效果最明显,血清中LTB4含量下降了22.45%,与Model组存在极显著差异,差异有统计学意义(p<0.05)。说明紫苏叶乙醇提取物可以有效控制致敏小鼠血清中LTB4水平的上升,对过敏有一定的对抗作用。
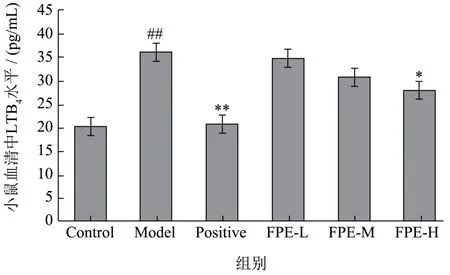
图3 紫苏叶乙醇提取物对被动皮肤过敏模型小鼠血清中LTB4水平的影响Fig.3 Effect of ethanol extract of perilla leaf on serum LTB4 level in mice with passive skin allergy
2.2 紫苏叶乙醇提取物对DNCB诱发的小鼠迟发型超敏反应的影响
2.2.1 紫苏叶乙醇提取物对DNCB诱发的迟发型超敏反应小鼠脏器系数的影响
除FPE-H组小鼠胸腺系数有所下降外(p<0.05),其余各组小鼠脾脏、胸腺、心脏、肝脏无显著性变化,差异无统计学意义(p>0.05)。结果见表3。
表3 FPE对DNCB诱发的迟发型超敏反应小鼠脏器系数的影响Table 3 Effect of FPE on organ coefficient of DNCB induced delayed hypersensitivity mice (±s, n=10)
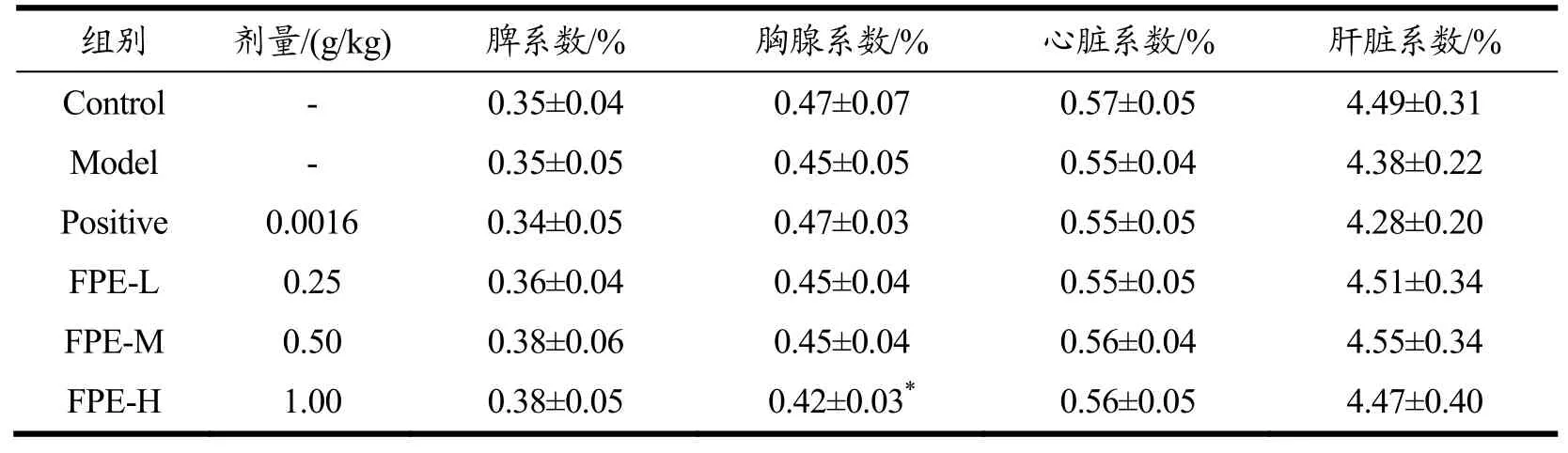
表3 FPE对DNCB诱发的迟发型超敏反应小鼠脏器系数的影响Table 3 Effect of FPE on organ coefficient of DNCB induced delayed hypersensitivity mice (±s, n=10)
?
2.2.2 紫苏叶乙醇提取物对DNCB诱发的迟发型超敏反应小鼠耳肿胀度的影响
Ⅳ型过敏反应又称迟发型超敏反应,主要由T淋巴细胞介导。本试验中选用的二硝基氯苯系一种半抗原,常被用作制备变应性接触性皮炎动物模型,以评价药物抑制Ⅳ型变态反应的效果。本试验中,小鼠致敏侧与非致敏侧的耳片厚度差可说明过敏反应的程度,差值越小,说明抗过敏作用越明显。与空白组小鼠比较,模型组小鼠耳肿胀度均显著提高(p<0.01),显示建模成功。与模型组相比,各组耳肿胀度均有所降低,其中以FPE-H组抑制DNCB引起的小鼠耳肿胀效果最好,在耳部致敏第3 d、第6 d耳肿胀度显著降低(p<0.05),第9 d耳肿胀度极显著降低(p<0.01)。结果见表4。相关研究也发现,佛波醇-12-十四烷酰-13-乙酸酯、花生四烯酸或噁唑酮诱导的耳炎小鼠灌胃给予1 kg/L野生紫苏的水提物0.4 mL,可显著缓解耳肿胀[25]。
表4 FPE对DNCB诱发的迟发型超敏反应小鼠耳肿胀度的影响Table 4 Effect of FPE on ear swelling in DNCB induced delayed hypersensitivity mice (±s, n=10)
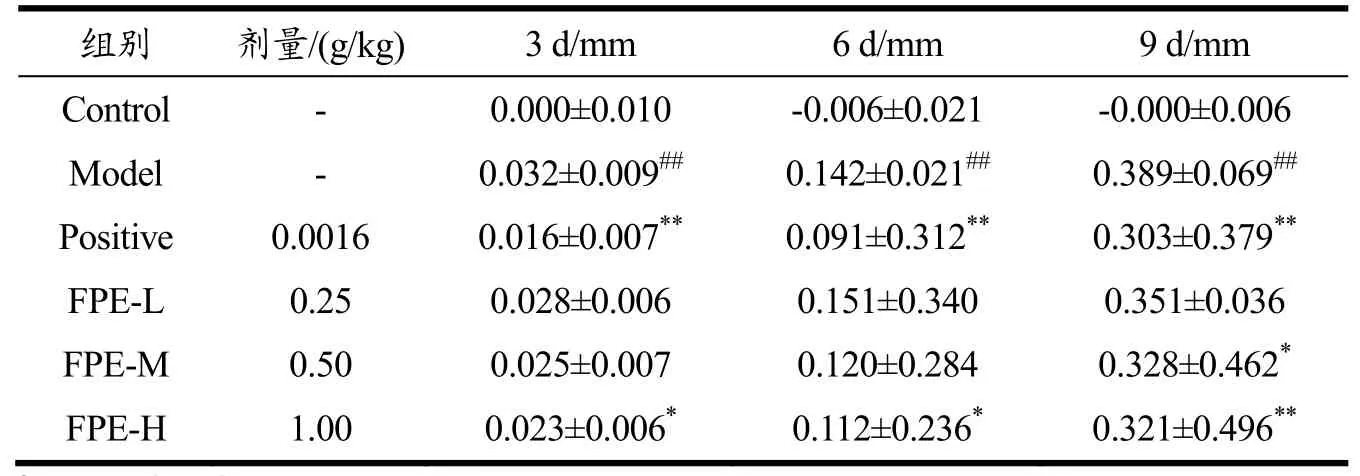
表4 FPE对DNCB诱发的迟发型超敏反应小鼠耳肿胀度的影响Table 4 Effect of FPE on ear swelling in DNCB induced delayed hypersensitivity mice (±s, n=10)
?
2.2.3 紫苏叶乙醇提取物对DNCB诱发的迟发型超敏反应小鼠耳组织液IL-4、IFN-γ、TNF-α水平影响
IL-4是T细胞自身分泌的生长因子,在过敏反应中能促进巨噬细胞提呈抗原。本文试验中,FPE-M组(458.10 pg/mL)小鼠与Model组(507.94 pg/mL)相比,耳组织液中IL-4水平显著降低(p<0.05),FPE-H组(410.67 pg/mL)与Model组比较耳组织液中IL-4水平下降了19.14%,效果极显著(p<0.01)。说明紫苏叶乙醇提取物可显著降低致敏小鼠耳组织液中IL-4水平,缓解过敏过程中过敏介质的释放。高剂量作用效果更加显著。结果见图4。

图4 紫苏叶乙醇提取物对DNCB诱发的迟发型超敏反应小鼠耳组织液IL-4水平影响Fig.4 Effect of ethanol extract from Perilla frutescens leaves on IL-4 level in ear tissue of mice with DNCB induced delayed hypersensitivity
IFN-γ能作用于内皮细胞和巨噬细胞等,提高将抗原呈递给局部CD4+T细胞的效率,是迟发性超敏反应中最重要的细胞因子。与Model组(29.52 pg/mL)相比,低、中、高剂量组小鼠耳组织液中IFN-γ含量分别降低了7.3%、21.1%、32.52%。FPE-M组(23.29 pg/mL)致敏小鼠耳组织液中IFN-γ水平显著降低(p<0.05),FPE-H组(19.83 pg/mL)效果极显著(p<0.01)。结果见图5。数据显示紫苏叶乙醇提取物对于DNCB诱发的迟发型超敏反应小鼠耳部IFN-γ上升有所抑制,对DNCB诱发的IV型超敏反应有一定的对抗作用,且紫苏叶乙醇提取物的抗过敏效果与用量呈一定的剂量相关性。

图5 紫苏叶乙醇提取物对DNCB诱发的迟发型超敏反应小鼠耳组织液IFN-γ水平影响Fig.5 Effect of ethanol extract from Perilla frutescens leaves on IFN-γ level in ear tissue of mice with DNCB induced delayed hypersensitivity
TNF-α能放大小静脉内皮细胞结合和活化白细胞的能力,从而导致炎症反应。本试验结果如图6所示,Model组(175.63 pg/mL)小鼠与Control组(54.84 pg/mL)相比,耳组织液中TNF-α水平显著提高(p<0.01),显示建模成功。与Model组相比,各剂量组小鼠耳组织液中TNF-α水平均有不同程度的下降,其中FPE-H组(146.45 pg/mL)小鼠耳组织液中TNF-α水平显著性降低(p<0.05),与Model组相比下降了16.6%。

图6 紫苏叶乙醇提取物对DNCB诱发的迟发型超敏反应小鼠耳组织TNF-α水平影响Fig.6 Effect of ethanol extract from Perilla frutescens leaves on TNF-α level in ear tissue of mice with DNCB induced delayed hypersensitivity
3 结论
本试验结果显示,紫苏叶乙醇提取物对小鼠脏器生长没有影响。小鼠被动皮肤过敏试验中,FPE具有抗I型过敏反应活性,能显著降低小鼠瘙痒次数延长首次瘙痒时间。高剂量组与模型组相比极显著降低小鼠瘙痒次数(p<0.01),由24.3次降低至15.8次,首次瘙痒时间由121.59 s显著延长至231.90 s。FPE能显著降低致敏小鼠血清中IgE、PAF、LTB4水平,高剂量组小鼠血清中IgE、PAF、LTB4水平分别下降了30.92%、15.50%、22.45%,表明FPE抗过敏作用机制与阻止过敏反应生物活性物质释放、干预花生四烯酸代谢产物的生成有关。DNCB诱发的小鼠迟发型超敏反试验中,FPE能显著降低小鼠耳肿胀度,第9 d极显著降低小鼠耳肿胀度(p<0.01)。高剂量组水平小鼠耳组织液中TNF-α、IL-4、IFN-γ水平分别下降了19.14%、32.52%、16.61%。综上所述,通过体内动物试验,证实紫苏叶乙醇提取物水溶液对I型过敏和IV型过敏的抗过敏活性,并初步探讨其对I型过敏作用机制与阻止过敏反应生物活性物质释放、干预花生四烯酸代谢产物的生成从而发挥抗过敏作用有关。但更深入的分子生物学机制和功效因子尚不明确,有待今后进一步研究。

